长江口表层沉积物中有机碳的来源、分布与成岩状态❋
赵 彬, 姚 鹏, 潘慧慧, 张婷婷, 李 栋, 王金鹏
(1. 中国海洋大学海洋化学理论与工程技术教育部重点实验室,山东 青岛 266100; 2. 中国海洋大学化学化工学院,山东 青岛 266100; 3.海洋科学与技术青岛协同创新中心,山东 青岛 266100; 4. 中国海洋大学海洋有机地球化学研究所,山东 青岛 266100)
长江口表层沉积物中有机碳的来源、分布与成岩状态❋
赵 彬1,2, 姚 鹏1,3,4❋❋, 潘慧慧1,2, 张婷婷1,2, 李 栋1,2, 王金鹏1,2
(1. 中国海洋大学海洋化学理论与工程技术教育部重点实验室,山东 青岛 266100; 2. 中国海洋大学化学化工学院,山东 青岛 266100;
3.海洋科学与技术青岛协同创新中心,山东 青岛 266100; 4. 中国海洋大学海洋有机地球化学研究所,山东 青岛 266100)
在长江口及其邻近海域采集了表层沉积物样品,分析了粒级组成、有机碳(OC)含量及其稳定同位素丰度(δ13C)、木质素和沉积色素含量和相关指标,并结合基于蒙特卡洛模拟的三端元混合模型,讨论了此区域沉积有机碳的来源、分布和成岩状态。结果表明,长江口表层沉积物中OC含量为0.21%~0.63%,长江口泥质区和浙闽沿岸OC含量较高,而河口外陆架上含量较低;δ13C为-23.1‰~-20.9‰,显示沉积有机碳是海洋和陆地来源的混合。木质素含量(Λ8)为0.16~1.41 mg/100 mg OC,其组成特点显示了木质素的草本和木本被子植物的混合来源。沉积色素以叶绿素的降解产物为主,主要分布在河口外陆架上;类胡萝卜素中以岩藻黄素为主,表明硅藻是此区域浮游植物的优势类群。以δ13C和Λ8为来源指标的端元混合模型显示长江口沉积有机碳主要来自海洋浮游植物,其贡献为54.3%~88.1%(平均70.2%),从河口向陆架逐渐升高,其次是土壤(9.3%~32.1%,平均22.3%)和C3维管植物(2.7%~13.6%,平均7.5%),两者贡献均在长江口和浙闽沿岸附近较高。沉积物粒级组成、OC含量、δ13C丰度和生物标志物含量之间显著的相关性和分布一致性表明水动力分选过程在决定陆源OC(包括土壤和C3维管植物OC)在河口外的输运和分布中发挥了重要作用。富含木质素的新鲜植物碎屑主要与粗颗粒物相联系,并主要沉积在河口附近,而贫木质素的土壤有机碳则主要赋存在细颗粒物上,可输运到离河口较远的位置。木质素降解参数,如酸醛比、3, 5-Bd/V和P/(S+V)在长江口外陆架上的砂质区域相对较高,显示此区域陆源有机碳降解程度较高,而叶绿素降解产物的比例在长江口泥质区较高,则可能与泥质沉积物中较强的有机碳再矿化作用有关。关键词: 长江口;沉积有机碳;来源;水动力分选;早期成岩作用
大河三角洲前缘河口(Large-river delta-front estuaries,LDEs)及其邻近陆架边缘海是陆源有机碳在海洋中的主要沉积汇[1]。了解LDE系统中沉积有机碳的来源、组成、分布和成岩状态对于更好地理解LDE在全球碳循环中的作用有重要意义[2]。长江口及邻近的东海内陆架是世界上最大的LDE之一,其输送的大部分陆源有机碳在长江冲淡水、沿岸流、风暴以及上升流等因素的共同作用下,形成了沿浙闽沿岸向南的输送路径,只有很少一部分从河口向北或离岸输运[3-5]。在输送过程中,这些有机碳不仅受到波浪、潮汐和沿岸流等动力分选过程,还会经历分解、矿化以及生物作用等[6]。在这些过程中,其他来源(如海洋、潮滩、沿岸其它河流等)有机碳的加入使得长江LDE沉积有机碳来源和保存更加复杂。过去的几十年来,应用稳定同位素和生物标志物(如正构烷烃、甾醇、长链烯酮、木质素、沉积色素等),已经对长江LDE及其邻近东海内陆架上沉积有机碳的来源、输运、分布和埋藏等开展了广泛研究,获得许多有价值的成果[7-14]。长江所输运的陆源有机碳不仅含有新鲜的高等植物碎屑,还含有大量难降解的土壤有机碳[11]。然而,到目前为止,很少有研究区分陆源有机碳中来自陆地高等植物和土壤的相对贡献及两者在长江口输运的分异[11, 13-14],之前的研究也很少关注这一区域沉积有机碳的保存特点和成岩状态等[12]。
本文分析了长江口2010年4月航次表层沉积物的粒级组成、总有机碳(TOC)及其稳定碳同位素(δ13C)等全样参数与沉积色素和木质素等生物标志物,运用基于蒙特卡洛模拟的三端元混合模型区分了土壤、C3维管植物和海洋浮游植物对沉积有机碳的贡献,并结合沉积色素和木质素的相关指标探讨了有机碳的保存特点和成岩状态。
1 材料与方法
1.1 样品采集
采样站位位于长江口及其邻近海域(30.0°N~31.1 °N,122.2°E~123.5 °E),水深范围11~65m(见表1,图1)。样品是2010年4月在“润江1号”科考船上通过箱式采泥器获得。每个站位采集表层0~3cm沉积物,充分混匀后放入经马弗炉450 ℃灼烧4h的铝盒中,-20 ℃冷冻保存。
1.2 粒级组成分析
将采集的表层沉积物样品冷冻干燥后,取适量于干净的小烧杯中,加入5%六偏磷酸钠([NaPO3]6)分散剂,浸泡24h,然后使用激光粒度分析仪(MS 2000,英国马尔文)进行测定,按照以下3个粒级:砂(>63μm)、粉砂(4~63μm)和黏土(<4μm)进行划分,得到按体积百分比计算的粒级组成百分比[26]。多次测定的相对偏差小于3 %(n=6)。
1.3 元素和稳定同位素分析
将冷冻干燥后的沉积物样品研磨,称取大约30mg装入银囊中,在干燥器中用优级纯浓盐酸熏蒸8h以去除无机碳,在60 °C的烘箱中烘干后装入锡囊制样,然后使用元素分析仪(美国Thermo Flash 2000 EA)测定[13],最终结果表述为TOC%和TN%。重复测量的标准偏差分别为±0.02 %(TOC%)和±0.01%(TN%)。在元素分析仪(Thermo Flash 1112 HT EA)-连续流同位素比值质谱(Thermo DeltaplusXL)联用仪上对上述去除无机碳的样品进行稳定碳同位素分析。稳定碳同位素比值采用VPDB 标准, 符号采用δ, 单位为‰, 计算式如下:
δ13CTOC(‰) = (Rsample/Rstandard-1)×1000。
(1)
其中,Rsample和Rstandard分别是样品和标准的13C/12C比值。分析精度为±0.1‰ (n=10)。所有样品均测量2次,最终结果取2次测量数据的平均值。

(卫星地图来自NASA:http://veimages.gsfc.nasa.gov/1452/China.A2000260.0310.3600x4800.jpg)
图1 长江口2010年4月采样站位图
Fig.1 Sampling locations at the Changjiang Estuary in April 2010
1.4 木质素分析
木质素的测定采用碱性CuO氧化法[15]。在氮气箱中将适量冻干并研磨之后的沉积物放入不锈钢反应容器内,并加入CuO和NaOH溶液,之后在150 ℃下消化3h。反应结束后加入乙基香草醛(EVAL)作为内标,离心分离,取上清液加入HCl中和至pH<2,用乙醚连续萃取3次,萃取液过无水Na2SO4干燥,然后在柔和的氮气流下浓缩至干。吹干的样品先加入吡啶溶解,再加入双(三甲基硅烷基)三氟乙酰胺(BSTFA)在70 °C下衍生化1h,然后进样分析。所用仪器为Agilent 7890A气相色谱仪,配火焰离子化检测器(FID),固定相为Supelco Equity 5毛细管色谱柱(30m×0.25mm×0.25μm)。木质素氧化产物木质酚的定量基于外标工作曲线,并使用内标EVAL获得的回收率进行校正。单个木质酚多次测量的精密度在2%~10 %之间。共对12种木质酚单体进行了定量,包括3种香草基酚(V系列)、3种紫丁香基酚(S系列)、2种肉桂基酚(C系列)、3种对羟基芳烃(P系列)和3,5-二羟基苯甲酸(3, 5-Bd)[13]。Σ8表示S、V、C系列8种木质酚单体的绝对含量之和,而Λ8则表示其相对于100mg OC的含量之和,后者可以校正粒度的影响[16]。
木质素的特征参数可以分为指示来源和指示降解的两大类。在指示来源的参数中,S/V和C/V可以用来判断木质素来源于被子植物和裸子植物或木本植物和草本植物[17]。但是,不同木质酚单体的降解差异降低了C/V和S/V这两种参数的准确性,所以近年来木质素酚类单体植被指数(Lignin Phenol Vegetation Index, LPVI)广泛地应用于判断植被来源,它可以示踪植被和环境较小的变化,一般来说木本被子植物的LPVI为67~415;非木本被子植物为378~2782[18]。在P酚类的单体中,对羟基苯乙酮(PON)只有木质素一个来源,但对羟基苯甲醛和对羟基苯甲酸还可以由蛋白质的氧化产物产生,所以PON/P可以用来指示陆地维管植物[19]。在指示降解的参数中,(Ad/Al)v和(Ad/Al)s代表V系列单体和S系列单体的酸醛比,它们可以指示木质素受白腐菌的降解程度,新鲜植物组织的(Ad/Al)v<0.3,(Ad/Al)s<0.14;高度降解的木质素的(Ad/Al)v>0.6,(Ad/Al)s>0.16[19]。P/(S+V)能够指示木质素侧链的真菌(棕腐菌)降解[20]。3, 5-Bd是土壤中有机质的降解产物,3,5-Bd/V可以指示组成复杂的陆源有机物的降解程度[21-23]。
1.5 沉积色素分析
取适量冻干并研磨之后的沉积物样品,加入丙酮,在冰水浴中超声提取5min,然后在-20°C放置萃取12h,离心收集上清液,离心后的沉积物再次加入丙酮,超声提取多次直至提取液无色,将离心后得到的所有上清液混合,在柔和的氮气流下吹干,然后用300 μL丙酮溶解后上机测试[24]。整个提取过程均在弱光及低温下进行。所用仪器为Waters 2695高效液相色谱,配Waters 2996二极管阵列检测器(PDA)和2475多波长荧光检测器(激发波长440nm,发射波长660nm),固定相为Waters Spherishorb反相C18色谱柱(250mm×4.6mm×5μm),梯度洗脱程序参照文献[25]。使用色素标准(丹麦DHI Water & Environment)和文献值与PDA光谱进行比较来定性鉴定和定量色素。类胡萝卜素在440nm下定量;叶绿素及其衍生物均在666nm下定量,在该波长下这些色素的灵敏度更高。对于没有标准的色素,如焦脱镁叶绿素a(pPHtin-a)、胡萝卜醇绿素酯(CCEs)、甾醇绿素酯(SCEs)等,使用脱镁叶绿素a(PHtin-a)的响应因子来计算[26]。色素含量用nmol色素每克有机碳(nmol·g-1)来表示。该方法多次测量的精密度< 3%,检测限为1 nmol g-1[27]。
1.6 基于蒙特卡洛模拟的三端元混合模型
为了区分土壤、C3维管植物和海洋来源有机碳的相对贡献,建立了基于Λ8和δ13C的三端元混合模型:
Λ8sample=fsoil×Λ8soil+fvp×Λ8vp+fmarine×Λ8marine,
(2)
δ13Csample=fsoil×δ13Csoil+fvp×δ13Cvp+
fmarine×δ13Cmarin,
(3)
fsoil+fvp+fmarine=1。
(4)
其中:Λ8sample和δ13Csample分别代表所测沉积物样品的Λ8和δ13C值;fsoil、fvp和fmarine分别代表土壤、C3维管植物和海洋来源有机碳的贡献率(%);其他符号代表相应来源的端元值。
使用蒙特卡洛模拟(Monte-Carlo simulation)方法来对端元混合模型进行求解[28]。该方法假定端元值在给定的范围内(通常是1倍的标准偏差)的变化符合正态分布,在此区间内按正态分布随机取值,然后选取部分或全部进行计算,得到的结果(即fsoil、fvp和fmarine)也一样符合正态分布。该方法稳健、准确,已成功地用于若干不同海洋环境中沉积有机碳来源的模型计算[29-30],包括长江口-东海内陆架[13]。本研究所用端元值均来自文献[8, 31],其中土壤端元值为Λ8= (1.64±0.89) mg/100mg和δ13C= (-26.3±3.00) ‰,C3维管植物端元值为Λ8= (6.00±5.22) mg/100mg和δ13C= (-28.1±1.70) ‰,海洋端元值为Λ8= 0mg/100mg 和δ13C= (-20.0±1.00) ‰。样品的Λ8和δ13C的标准偏差分别取0.06mg/100mg和0.1‰。在模拟过程中,首先在端元值范围内产生1亿个符合正态分布的随机数,然后再在这1亿个数的基础上按正态分布随机选取能够满足(2)~(4)式的100万个进行计算。计算通过Matlab(R2013a版)软件进行,程序由August Andersson编写(个人通讯)。多次重复运算给出的土壤、C3维管植物和海洋来源有机碳的贡献率的平均值的变化分别是0.44 ‰、0.05 ‰和0.50 ‰,说明模型结果在统计上的稳定性(n=7)。
1.7 统计分析
使用SPSS 20统计软件进行皮尔森相关性分析和双尾显著性检验以确定测定参数之间的关系。绘图使用Surfer 11和Origin 9 软件。
2 结果
2.1 沉积物全样参数
研究区域表层沉积物中值粒径为6.7~150 μm,平均为39.6 μm(见表1)。在长江口附近和近岸站位,粉砂是主要成分,平均为59.2 %,黏土为22.9 %,而砂最少,只有17.9 %(见图2)。在陆架上的站位(A3、A5和B5)砂的比例明显高于粉砂和黏土,平均为56.9 %。
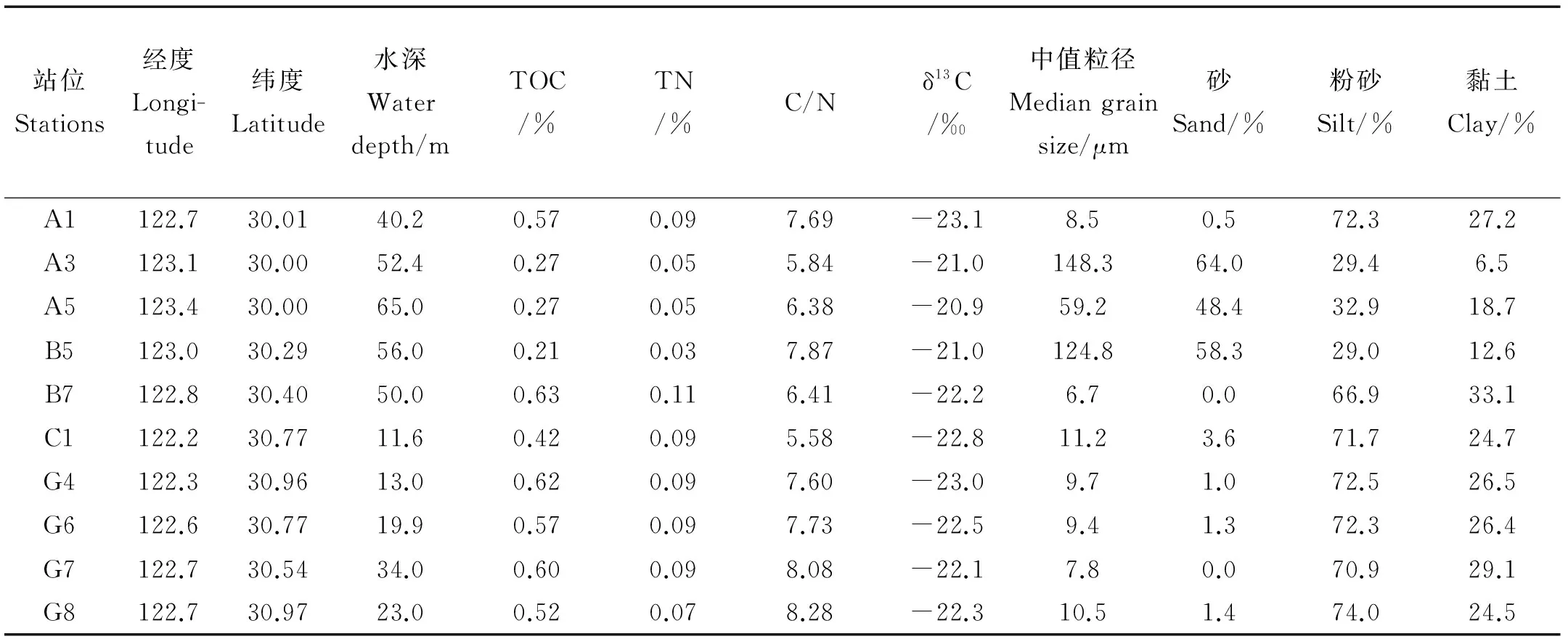
表1 长江口2010年4月表层沉积物站位信息和全样参数 Table 1 Sampling locations and bulk parameters of surface sediments from Changjiang Estuary in April 2010
研究区域表层沉积物中TOC含量为0.21%~0.63 %,平均为0.47 %(见表1)。长江口附近和近岸站位(平均0.56%)明显高于砂质区域站位(平均0.25%)(见图3(a))。C/N(摩尔比)范围为5.58~8.28,平均为7.15(见表1)。总的来说,长江口附近和近岸站位沉积物中的C/N比要高于砂质区域站位,但是在离河口最近的C1站位,其C/N比最低,而在砂质区域的B5站位,其C/N比为7.87,高于其它2个站位(见表1,图3(b))。沉积物中有机碳的δ13C为-23.1‰~ -20.9‰,平均为-22.1‰;13C具有明显的由河口向东南外海富集的趋势,与TOC的趋势正好相反(R2=0.67,p<0.01)(见图 3(c))。
2.2 木质酚及相关参数的组成和分布
研究区域表层沉积物中8种木质酚的含量(Σ8)为4.5~79.7 μg/g干沉积物,平均为36.4 μg/g,而对有机碳含量归一化之后的木质酚含量(Λ8)为0.16~1.41 mg·100mg-1,平均为0.71mg·100mg-1,两者均具有显著的离岸降低趋势(见表2,图 4(a), (b))。在木质素的氧化产物中,V系列单体和S系列单体的含量较高,分别占Λ8的51.1%~59.4 %(平均为53 %)和37.4%~44.3 %(平均为39 %)。S系列对V系列的比值(S/V)和C系列对V系列的比值(C/V)的变化范围分别为0.63~0.84(平均为0.74)和0.05~0.12(平均为0.09)(见表2)。在长江口外泥质沉积区C/V和S/V比值较高,而离河口最近的站位和陆架上的砂质沉积区的比值较小(A5除外)。LPVI指标的范围在30~69之间,平均为48,与C/V的分布趋势也相同(见图4(c))。PON/P在研究区域内整体变化较小(0.12~0.23,平均0.16),在杭州湾外的G7站位具有最高值。在指示木质素降解的参数中,(Ad/Al)v和(Ad/Al)s在长江口表层沉积物中的变化范围分别为0.24~0.38和0.30~0.67,平均为0.29和0.43,砂质区站位明显高于泥质区站位,具有由河口向陆架逐渐升高的趋势(见图 4(e),(f))。3,5-Bd/V和P/(S+V)比值分别为0.05~0.24(平均0.28)和0.15~0.63(平均0.28),它们的分布趋势与(Ad/Al)s和(Ad/Al)v大致相同,最高值都出现在砂质区站位(见图 4(g), (i))。
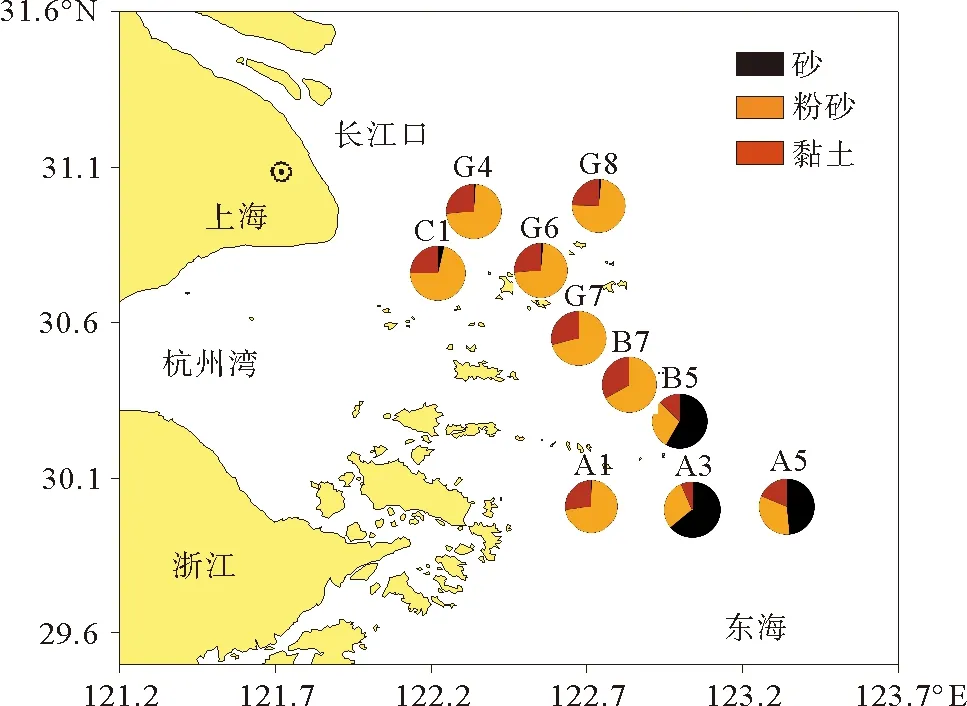
图2 长江口2010年4月表层沉积物的粒级组成Fig.2 Grain size composition of surface sediments from Changjiang Estuary in April 2010
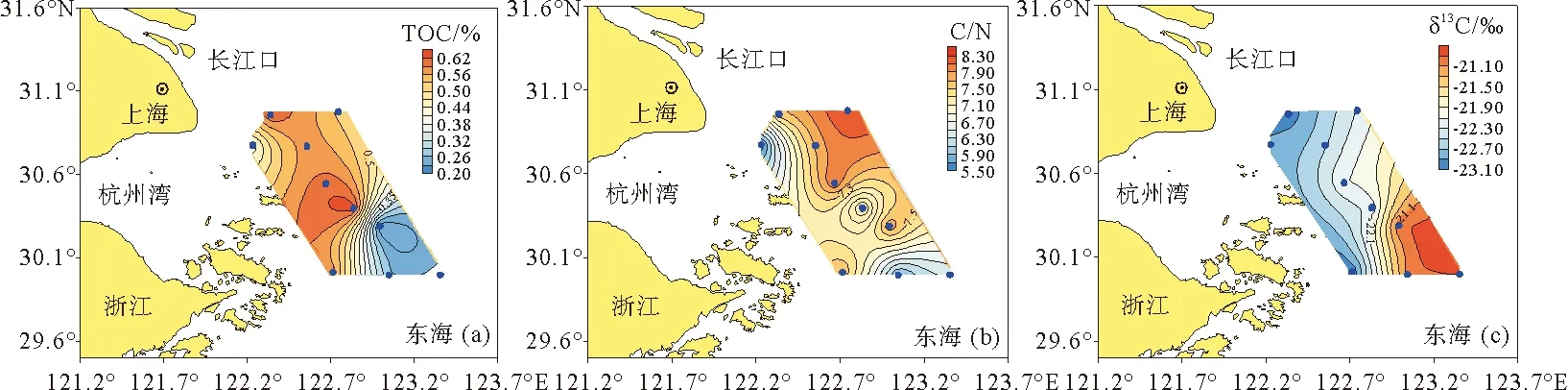
图3 长江口2010年4月表层沉积物TOC、C/N比和δ13C的分布Fig.3 Spatial distribution of TOC, C/N, δ13C in surface sediments from Changjiang Estuary in April, 2010
2.3 沉积色素的含量分布
在样品中共检测出16种色素,其中Chl-b和β-Car仅在A3、A5和B5等河口外陆架站位检出,且含量较低,未在表中列出(见表3)。长江口表层沉积物中Chl-a的含量在5.5~47.6nmol/g之间,平均为20.2nmol/g,Chl-a降解产物,如PHtin-a、PHide-a、CCEs、pPHtin-a和SCEs等的含量远高于Chl-a的浓度,这表明大部分的Chl-a已发生了降解。沉积色素的分布趋势与木质素含量的相反,长江口泥质区和浙闽沿岸较低,而河口外陆架上的砂质区较高,具有明显的由河口向东南外海升高的趋势,B5站位各沉积色素含量最高(见图5)。在类胡萝卜素中Fuco的含量最高,为9.0~441.8nmol/g,平均为116.2 nmol/g。类胡萝卜素的分布趋势与Chl-a大致相同,除Zea外,其余类胡萝卜素类含量都在B5站位达到最大值,且B5站位Fuco、Neo和Lutein的含量远高于其他站位,而Zea的含量在距B5最近的A3站位最高。
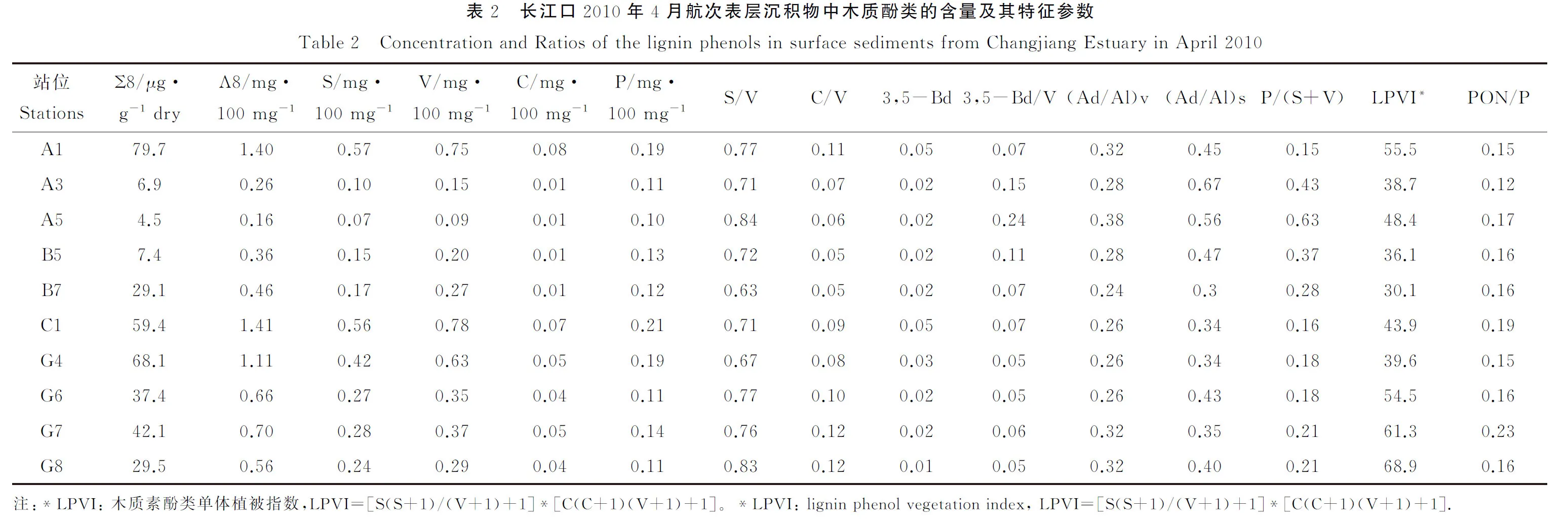
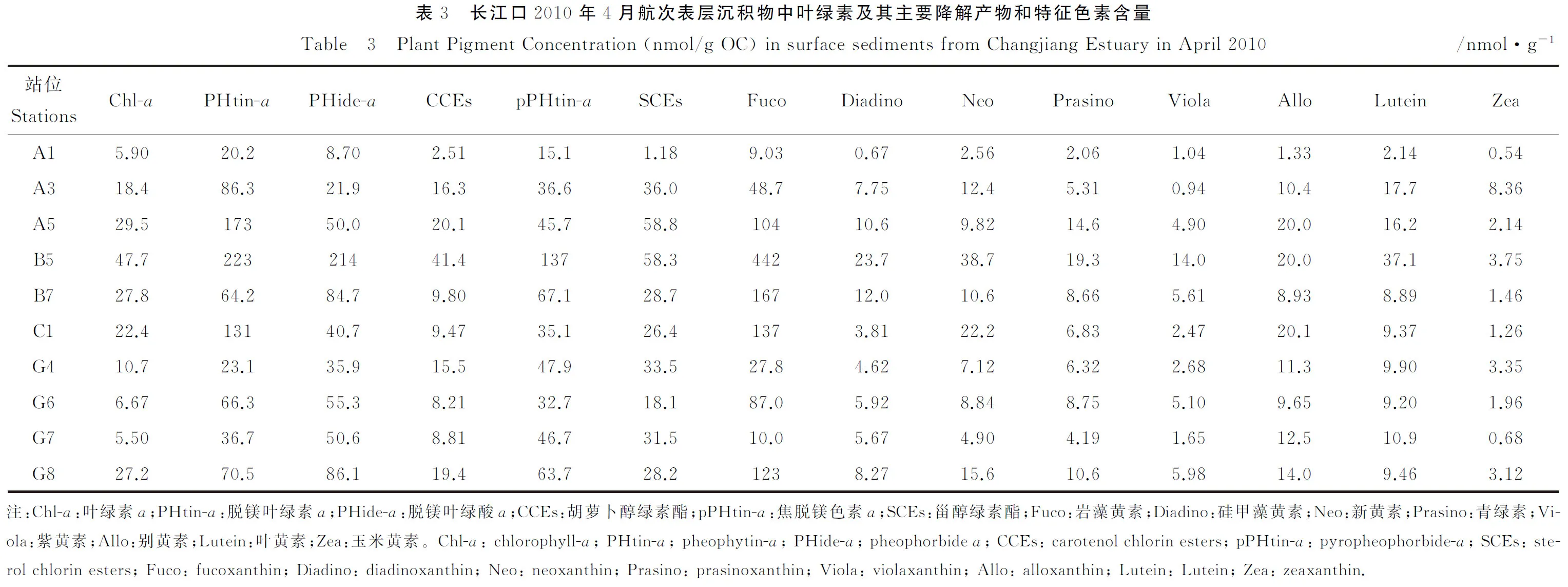
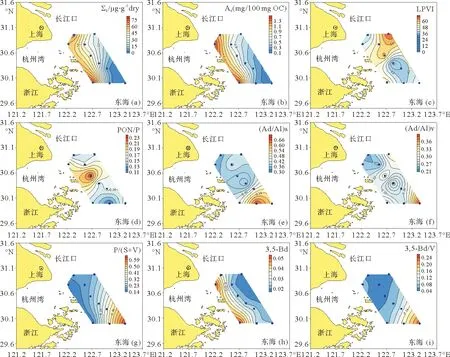
图4 长江口2010年4月表层沉积物中木质素参数Σ8(μg/g dry)(a)、Λ8(mg/100 mg OC)(b)、LPVI(c)、PON/P(d)、(Ad/Al)v(e)、(Ad/Al)s(f)、P/(S+V)(g)、3,5-Bd(h)和3,5-Bd/V(i)的分布Fig.4 Spatial distribution ofΣ8(μg/g dry) (a)、Λ8(mg/100 mg OC) (b)、LPVI (c)、PON/P (d)、(Ad/Al)v (e)、(Ad/Al)s (f)、P/(S+V) (g)、3, 5-Bd (h) and 3, 5-Bd/V (i) in surface sediments from Changjiang Estuary in April 2010
图5 长江口2010年4月航次表层沉积物中色素Chl-a(nmol/g OC)(a)、PHide-a(nmol/g OC)(b)、CCEs(nmol/g OC)(c)、SCEs(nmol/g OC)(d)、Fuco(nmol/g OC)(e)和Zea(nmol/g OC)(f)的分布Fig.5 Spatial distribution of Chl-a(nmol/g OC)(a)、PHide-a(nmol/g OC)(b)、CCEs(nmol/g OC)(c)、SCEs(nmol/g OC)(d)、Fuco(nmol/g OC)(e)and Zea(nmol/g OC)(f)in surface sediments from Changjiang Estuary in April 2010
2.4 不同来源有机碳的丰度和分布
利用蒙特卡洛模拟的方法对长江口表层沉积物不同来源有机碳的相对贡献进行了计算,表4给出了计算结果,包含平均值和标准偏差。图6为基于不同来源有机碳的平均贡献所做的分布图。从表4和图6可以看出,长江口表层沉积物中有机碳主要来源于海洋浮游植物,其平均贡献为70.2 %,其次是土壤,其贡献为22.3%,C3维管植物的贡献最少,为7.5%。海洋有机碳贡献的分布与沉积色素的分布相似,由长江口附近向河口外陆架区域逐渐增加(见图6),A1站位海洋有机碳的贡献最小,为54.3%,A5站位的贡献最大,达88.1%。土壤和C3维管植物对沉积有机碳的贡献具有相似的分布特点,均在长江口附近和浙闽沿岸较高,而在河口外陆架区域较低,A1站位两者的贡献最大,分别占TOC的32.1%和13.6%。

图6 长江口2010年4月表层沉积物中不同来源有机碳的贡献Fig.6 Relative proportions of marine (blue), soil (yellow) and C3-plant (red) and contributions to OC in surface sediments from Changjiang Estuary in April 2010
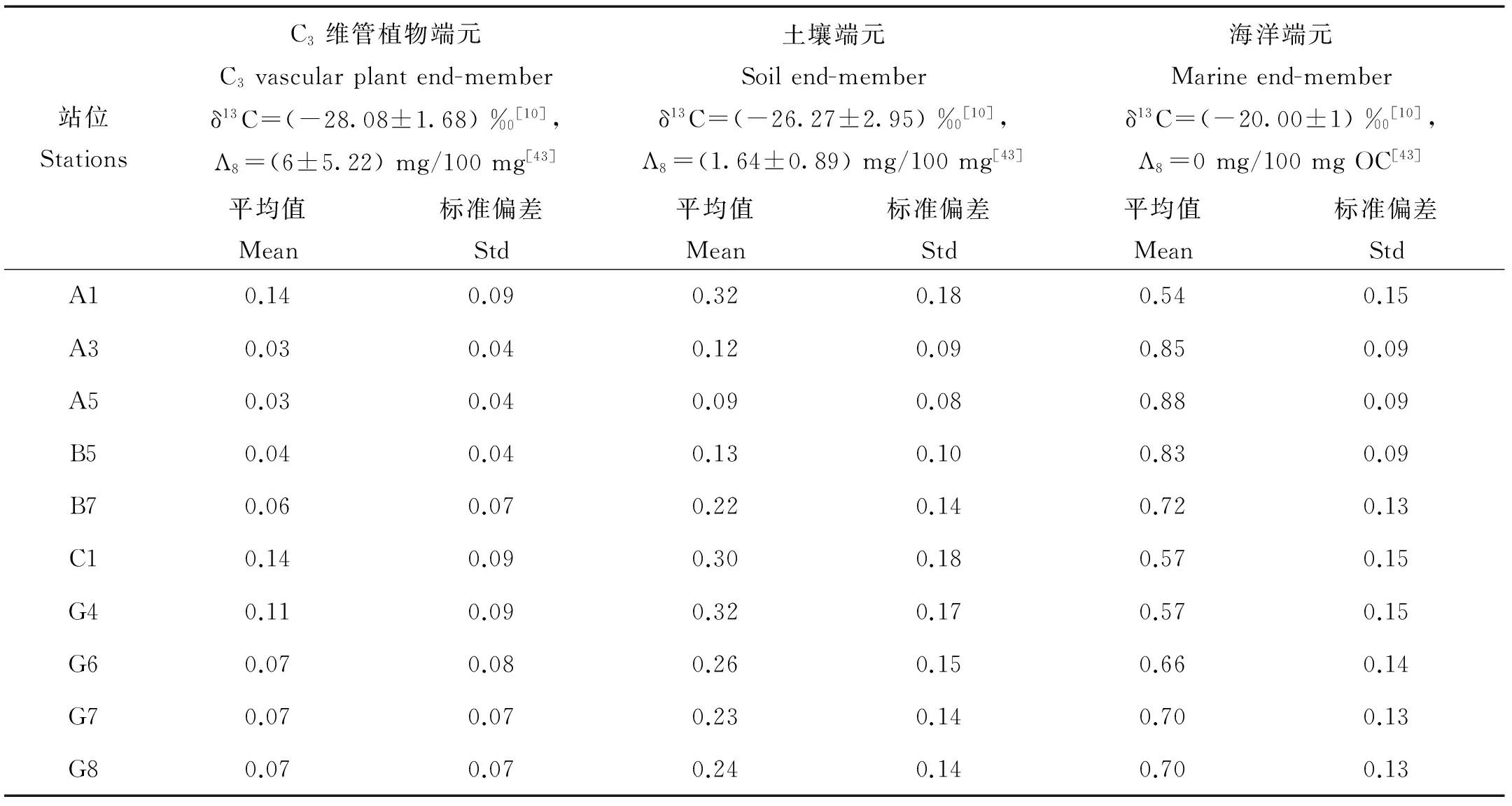
表4 基于蒙特卡洛模拟的长江口2010年4月表层沉积物中有机碳来源的三端元混合模型计算结果
3 讨论
3.1 长江口表层沉积物中有机碳的来源和分布
不同来源有机碳往往具有不同的化学组成,其全样参数和生物标志物的含量或指标具有明显的差异,可以用来对其进行区分[32]。例如,由于摄取无机碳的来源和代谢途径的不同,C3陆地植物往往具有较亏损的13C(约-33‰~-25‰)和较高的C/N比(>15),而土壤有机碳和海洋浮游植物的13C较富集(分别为-29‰~-23 ‰和-22‰~-19‰),C/N比较低(分别为8~12和5~8)[32-36]。研究区域表层沉积物具有较宽的δ13C和C/N比范围(见表1),显示沉积有机碳为陆地和海洋的混合来源。长江口泥质区和浙闽沿岸的沉积有机碳具有明显亏损的13C和较高的C/N比,显示了陆源输入的显著贡献;而在河口外陆架上砂质区域,较低的C/N比和相对富集的13C表明此区域主要受到海源有机碳的影响。需要说明的是,长江口及近岸海域人类活动频繁,污水排放、船舶污染和化石燃料燃烧等都会向近岸沉积物中输送大量有机碳[37-38],这部分有机碳的δ13C与土壤有机碳相似,如长江口附近排污口颗粒物的δ13C约为-26.7‰[39],可能会增加土壤有机碳的贡献,但是在端元模型中无法区分两者的贡献。总的来说,本研究结果与前人在此区域及其它大河河口及其邻近陆架相似,如东海内陆架、珠江口、密西西比河口和亚马逊河口等(均为被动陆架边缘(Passive Margins))(见图7),尽管这些区域都有大量的陆源有机碳输入[8, 13, 15, 40-42]。活动性陆架边缘(Active margins),如华盛顿陆架、新西兰惊奇湾、罗纳河三角洲,则具有明显的陆源特征[43-44]。这种分布趋势的差异可能归因于不同的理化和生物过程,如大河河口较强的沉积动力条件所造成的微生物的丰富多样性、有机碳的低保存以及人类活动(如石油输入和土壤施肥等)的影响[7, 32, 34, 45- 47]。
木质素是一个非常有用的陆源有机碳的示踪计[47]。木质素含量(Λ8)以及指示木质素相对贡献的PON/P指标从长江口附近到河口外陆架区域逐渐降低,表明陆源输入有机碳的影响在减少,伴随着海源有机碳的贡献在增加,与全样参数δ13C和C/N比所表现的不同来源有机碳分布变化是一致的(见图3)。同样地,与那些活动性陆架边缘海相比,本研究区域及其它被动陆架边缘海具有低木质素含量和相对富集的δ13C(见图7)[13, 15, 40-42],表明这些区域海洋和土壤来源有机碳的重要贡献,如端元混合模型的结果所揭示的(见图6)。长江口表层沉积物中的C/V和S/V比表明此区域陆源有机碳主要来源于草本和木本混合的被子植物,与前人在此区域的研究是一致的(见图8)[13, 40]。在世界范围内,纬度较低的墨西哥湾等区域C/V和S/V的范围较大,而中高纬度地区C/V和S/V范围较窄(见图 8),这可能是不同地区的土壤和植被类型不同所导致的[13, 31, 47-53]。本研究中大部分样品的LPVI值均比长江流域中裸子植物组织的值要高[31],表明木质素主要来源于被子植物,与C/V和S/V的结果一致。
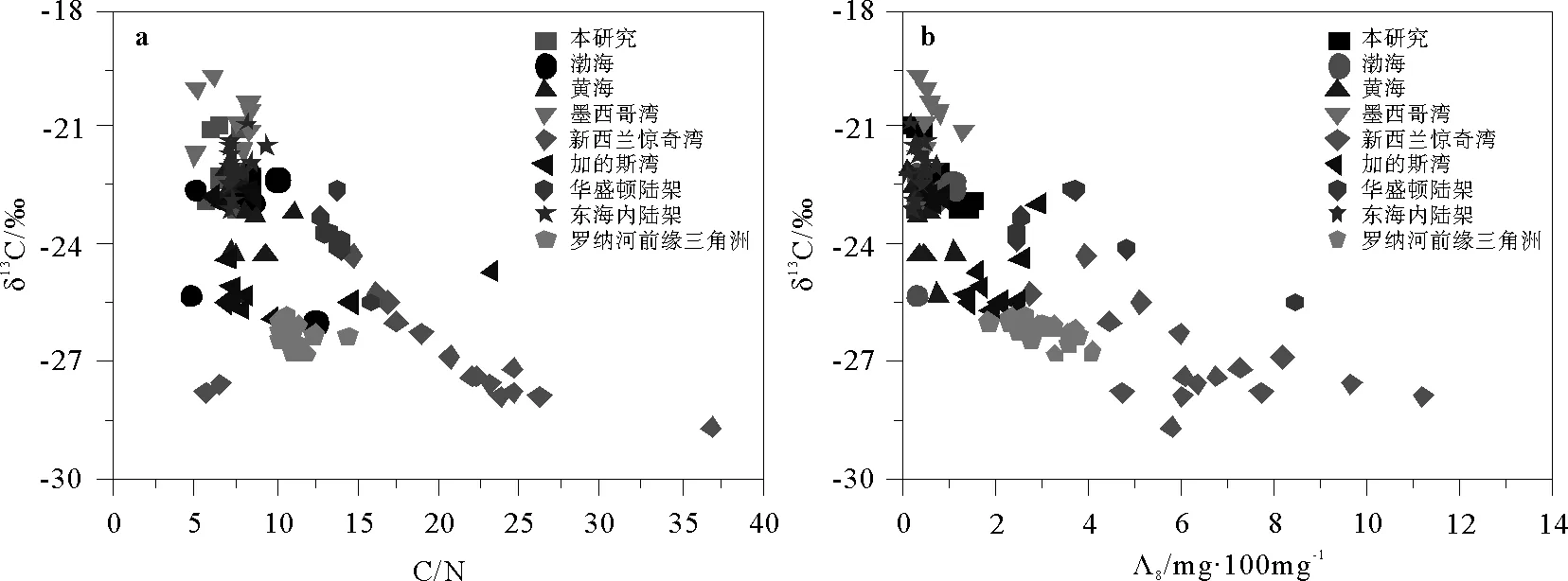
图7 长江口2010年4月表层沉积物δ13C与C/N(a)、δ13C与Λ8(b)的关系(图中其它河口和边缘海数据来自文献[47-49, 52-57])Fig.7 Plot of δ13C versus C/N(a) and Λ8(b) for surface sediments from Changjiang Estuary in April 2010 (Data from references [47-49, 52-57])
沉积色素主要来源于海洋浮游植物,而海洋浮游植物生物量主要是受营养盐水平、光照和水动力条件所控制的[58-59]。虽然长江冲淡水带来了大量的营养盐,但是长江口附近水体浊度较大,光的渗透性较弱,阻碍了浮游植物的生长[59],导致长江口附近沉积色素含量相对较低。河口外陆架砂质区是上升流与长江冲淡水的交汇处,大量营养盐从底部补充到上层,并且水体浊度较低,光的渗透性强,从而导致浮游植物生物量高,沉积色素的含量也因此升高[59]。在类胡萝卜素中,岩藻黄素的含量最高,尤其是在上升流与长江冲淡水的交汇处的B5站位,这表明长江口表层沉积物中海源有机碳可能更多的来自于硅藻的贡献,与长江口附近水体中浮游植物的优势类群为硅藻是一致的[60-61]。
3.2 陆源有机碳在长江口的水动力分选
很多研究表明基于粒径和/或密度的沉积物颗粒的水动力分选在决定陆源有机碳在河口及其邻近海域的输运和分布中发挥了重要作用[15, 47]。水动力分选作用使得低有机碳富含木质素的粗颗粒物主要沉积在长江口口门附近,而有机碳含量较高的细颗粒物则主要沉积在口门外的泥质区,并在冲淡水和沿岸流的作用下向浙闽沿岸输送,北上的台湾暖流的阻隔作用使其不能向河口外陆架区域输送(见图3,4)。在河口外陆架区,主要为砂质沉积,有机碳和木质素的含量也都很低,有研究表明这些区域的粗沉积物为晚更新世低海面时堆积的,不为现代河流输送的沉积物所覆盖的“残余砂”[62]。A1站位也具有较高的含砂量,其粗砂组分可能来自于舟山群岛附近岛屿的岩石风化以及潮流所带来的杭州湾物质[63]。从图9可以看出,长江口表层沉积物中TOC含量随砂%比例的降低与粉砂%和黏土%比例的升高而增加(R2分别为0.79、0.68和0.87,p<0.01),而TOC含量与中值粒径之间呈现指数关系(R2=0.95,p<0.001)。由此可见,长江LDE表层沉积物中有机碳的分布主要是受现代河流输送的黏土和粉砂所控制(同时也受到更新世改造沉积的影响),水动力分选在其中起了决定作用[64]。
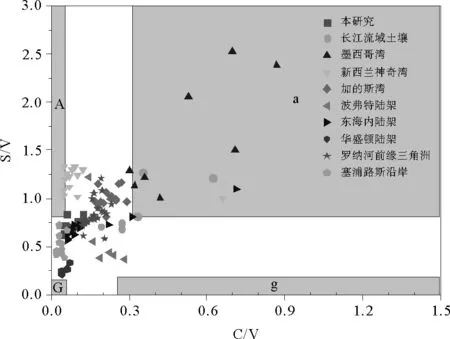
(A:被子植物木质组织;a:被子植物草或叶;G:裸子植物木质组织;g:裸子植物草或叶。图中其它河口和边缘海数据来自文献[13, 31, 47-53]。A: angiosperm wood; a: angiosperm grasses&leaves; G: gymnosperm wood; g: gymnosperm grasses&leaves). Data from references [13, 31, 47-53].)
图8 长江口2010年4月表层沉积物C/V与S/V的关系
Fig.8 Plot of C/V versus S/V or surface sediments from Changjiang Estuary in April 2010
端元混合模型所得到的土壤有机碳和C3维管植物来源有机碳的分布差异也体现了水动力分选作用。如图6和表4所示,与河口外陆架上具有相对较高海源有机碳贡献的站位相比,长江口附近积累了较多的土壤有机碳,并可以离岸输运到较远的位置或沿岸向南输运,虽然很少可以输运到河口外陆架上,而C3维管植物有机碳整体贡献很小,且主要集中在离河口较近或沿岸(A1)的位置,这表明这两种来自陆源的有机碳在输运过程中发生了分异,导致不同的分布特点。
3.3 长江口表层沉积物中有机碳的成岩状态
作为典型的大河影响下的边缘海,长江LDE沉积有机碳的保存受到沉积动力条件、沉积物粒级组成、有机碳来源和组成等多种因素影响,不同区域、不同来源参数可以用来分别指示难降解的陆源有机碳和易降解的海洋有机碳的成岩状态[13-14]。如图4所示,代表木质素降解的参数,如(Ad/Al)v、(Ad/Al)s、P/(V+S)和3,5-Bd/V均表现出从河口向陆架逐渐升高的基本趋势,说明在河口木质素含量较高的区域,多是一些新鲜的植物碎屑,降解程度相对较低,而在陆架上的砂质区域,木质素含量低且降解程度较大,应与此处属于“残余砂”,陆源沉积比较古老有关[40, 62]。3, 5-Bd/V和P/(S+V)与Λ8均表现出较强的非线性关系(R2分别为0.96和0.98,p<0.001)(见图10),随着Λ8的增大,3, 5-Bd/V和P/(S+V)逐渐减小,进一步说明木质素含量高的沉积物,其陆源有机质的降解程度低[22, 50]。另外,水动力分选作用也可能将一部分降解程度高的陆源有机碳选择性输运到离河口较远的位置。如前所述,富含木质素的新鲜植物碎屑主要与粗颗粒物相联系,因此主要沉积在河口附近,而贫木质素的土壤有机碳主要与细颗粒物相联系,可以被选择性长距离输运,而这部分土壤有机碳是属于年龄较老,降解程度较大的有机碳[3-4, 40-41]。长江口沉积物中的木质素降解指标,如(Ad/Al)v要明显高于长江流域新鲜植物组织(~0.23)和河流悬浮颗粒物(~0.25)中的[31, 66],说明陆源有机碳在输运过程中会发生一定程度的分解,也进一步说明了水动力分选在选择性输运和选择性降解陆源有机碳过程中的重要作用[50]。
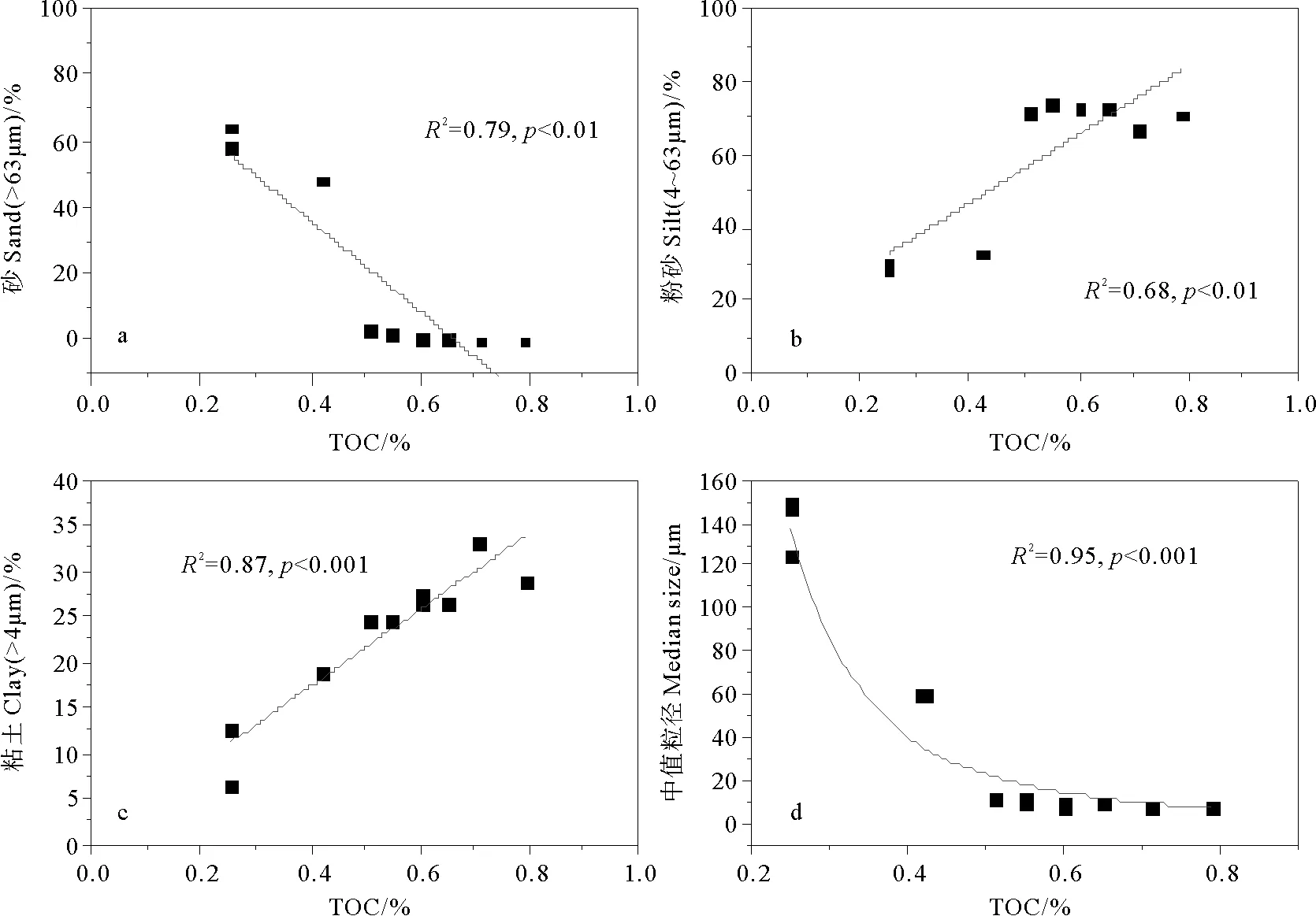
图9 长江口2010年4月表层沉积物中TOC随砂(a)、粉砂(b)、黏土(c)和中值粒径(d)的变化Fig.9 Plot of TOC versus sand(a), TOC versus silt(b), TOC versus clay(c) and TOC versus median size(d) for surface sediments from Changjiang Estuary in April 2010
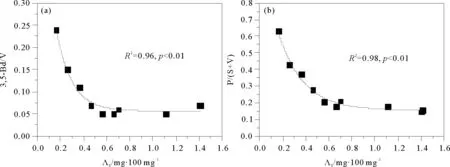
图10 长江口2010年4月表层沉积物3, 5-Bd/V(a)与P/(V+S)(b)随Λ8的变化
与木质素的降解参数相似,一些叶绿素降解产物的分布也呈现从河口向陆架逐渐升高的趋势,不过最高值并不是出现在离岸最远的A5站位,而是长江口泥质区边缘的B5站位(见图5)。这种分布特点显然与这一区域的初级生产水平高,沉积色素含量本身较高有关。为了衡量不同站位之间的相对差异,定义叶绿素降解指标P/C为叶绿素降解产物在总叶绿素(叶绿素a与其降解产物之和)中的比例, P/C越大代表叶绿素降解程度越高,这与文献中使用的表示叶绿素新鲜程度的指标正好相反[25],其指示意义在于能够更直接地表示叶绿素在不同站位的降解程度。从图11可以看出,大部分站位P/C比值都在90%以上,这说明长江口沉积物中的海洋有机碳绝大部分是高度降解的。从空间分布上来说,长江口泥质区的站位具有最高的P/C比,说明这一区域发生的海洋有机碳降解作用更显著,虽然此处的海洋有机碳比例并不高(见图6)。研究表明,大河河口泥质沉积物中特殊的沉积动力过程和生物地球化学作用对其中沉积有机碳的降解起了重要的促进作用[2]。大河河口泥质沉积物易于受到强烈的物理改造作用(潮汐、洋流、风暴等)的影响,而发生频繁地再悬浮和移动,从而改变其中的氧化还原序列,形成次氧化的成岩条件,促进其中沉积有机碳的再矿化作用[67]。长江口泥质区较低的有机碳丰度(<1.0%)、木质素含量和单位比表面积有机碳含量(<0.40 mg·m-2,未发表数据)进一步表明在这些区域沉积有机碳经历了显著的再矿化分解[12],这与世界上其它具有泥质沉积的大河河口,如亚马逊河口[68]、巴布亚湾飞河河口[45, 69]和密西西比河口[15]是相似的。长江口与这些大河河口一样,都是典型的具有高的沉积速率,但有机碳保存效率较低的河口[2, 67]。另外,研究表明,海源有机碳降解的同时,会由于“激发效应”的存在而促进难降解的陆源有机碳的降解[67-68, 70-71],这可能是为什么在叶绿素降解产物含量最高的区域木质素的降解程度也最大的原因。

图11 长江口2010年4月表层沉积物叶绿素降解产物与叶绿素的含量比
3 结语
长江口及邻近海域表层沉积物中的有机碳具有相对较宽的全样参数和生物标志物含量范围,显示沉积有机碳是海洋和陆地来源的混合。蒙特卡洛模拟的结果表明沉积有机碳主要来源于海洋浮游植物,其贡献从河口向陆架逐渐升高,其次是土壤和C3维管植物,其分布与海源有机碳相反。木质素的组成显示其主要来自草本和木本被子植物的混合,而岩藻黄素含量较高则表明硅藻是此区域主要的浮游植物类群。水动力分选在陆源有机碳的输运和分布及选择性降解中发挥了重要作用。富含木质素的新鲜植物碎屑主要与粗颗粒物相联系,并主要沉积在河口附近,而贫木质素的难降解土壤有机碳则主要赋存在细颗粒物上,可输运到离河口更远的地方。长江口外陆架上的砂质区域具有相对较高的木质素降解程度,可能与砂质沉积物中的陆源有机碳较古老有关。叶绿素降解产物的比例在长江口泥质区较高,则可能与泥质沉积物中较强的有机碳再矿化作用有关。长江口泥质沉积物在有机碳再矿化和保存中的潜在重要性、微生物在其中的作用以及大河河口泥质沉积在全球碳循环中的地位应当引起今后研究的重视,特别是在人类活动对河流物质输送的影响日益增大的大背景下。
[1] Bianchi T S, Allison M A. Large-river delta-front estuaries as natural “recorders” of global environmental change [J]. Proceedings of the National Academy of Sciences, 2009, 106(20): 8085-8092.
[2] Blair N E, Aller R C. The fate of terrestrial organic carbon in the marine environment [J]. Annual Review of Marine Science, 2012, 4: 401-423.
[3] Liu J P, Li A C, Xu K H, et al. Sedimentary features of the Yangtze River-derived along-shelf clinoform deposit in the East China Sea [J]. Continental Shelf Research, 2006, 26(17): 2141-2156.
[4] Liu J P, Xu K H, Li A C, et al. Flux and fate of Yangtze River sediment delivered to the East China Sea [J]. Geomorphology, 2007, 85(3): 208-224.
[5] Yang Z S, Guo Z G, Wang Z X, et al. Basic pattern of transport of suspended matter from the Yellow Sea and East China Sea to the eastern deep seas [J]. Acta Oceanologica Sinica, 1992, 14(2): 81-90.
[6] Rice D L, Tenore K R. Dynamics of carbon and nitrogen during the decomposition of detritus derived from estuarine macrophytes [J]. Estuarine, Coastal and Shelf Science, 1981, 13(6): 681-690.
[7] Xing L, Zhang H, Yuan Z, et al. Terrestrial and marine biomarker estimates of organic matter sources and distributions in surface sediments from the East China Sea shelf [J]. Continental Shelf Research, 2011, 31(10): 1106-1115.
[8] Zhang J, Wu Y, Jennerjahn T C, et al. Distribution of organic matter in the Changjiang (Yangtze River) Estuary and their stable carbon and nitrogen isotopic ratios: Implications for source discrimination and sedimentary dynamics [J]. Marine Chemistry, 2007, 106(1): 111-126.
[9] Zhu C, Wang Z H, Xue B, et al. Characterizing the depositional settings for sedimentary organic matter distributions in the Lower Yangtze River-East China Sea Shelf System [J]. Estuarine, Coastal and Shelf Science, 2011, 93(3): 182-191.
[10] Wang J P, Yao P, Bianchi T S. The effect of particle density on the sources, distribution, and degradation of sedimentary organic carbon in the Changjiang Estuary and adjacent shelf [J]. Chemical Geology, 2015, 402: 52-67.
[11] Li D, Yao P, Bianchi T S, et al. Organic carbon cycling in sediments of the Changjiang Estuary and adjacent shelf [J]. Implication for the influence of Three Gorges Dam, 2014: 139, 409-419.
[12] Yao P, Zhao B, Bianchi T S, et al. Remineralization of sedimentary organic carbon in mud deposits of the Changjiang Estuary and adjacent shelf: Implications for carbon preservation and authigenic mineral formation [J]. Continental Shelf Research. 2014, 91(0): 1-11.
[13] Li X, Bianchi T S, Allison M A, et al. Composition, abundance and age of total organic carbon in surface sediments from the inner shelf of the East China Sea [J]. Marine Chemistry, 2012, 145: 37-52.
[14] Li X, Bianchi T S, Allison M A, et al. Historical reconstruction of organic carbon decay and preservation in sediments on the East China Sea shelf [J]. Journal of Geophysical Research: Biogeosciences, 2013, 118(3): 1079-1093.
[15] Bianchi T S, Mitra S, McKee B A. Sources of terrestrially-derived organic carbon in lower Mississippi River and Louisiana shelf sediments: implications for differential sedimentation and transport at the coastal margin [J]. Marine Chemistry, 2002, 77(2): 211-223.
[16] 杨丽阳, 吴莹, 张经, 等. 长江口邻近陆架区表层沉积物的木质素分布和有机物来源分析 [J]. 海洋学报, 2008, 30(5): 35-42.
[17] Hedges J I, Parker P L. Land-derived organic matter in surface sediments from the Gulf of Mexico [J]. Geochimica et Cosmochimica Acta, 1976, 40(9): 1019-1029.
[18] Tareq S M, Tanaka N, Ohta K. Biomarker signature in tropical wetland: lignin phenol vegetation index (LPVI) and its implications for reconstructing the paleoenvironment [J]. Science of the Total Environment, 2004, 324(1): 91-103.
[19] Jex C N, Pate G H, Blyth A J, et al. Lignin biogeochemistry: from modern processes to Quaternary archives [J]. Quaternary Science Reviews, 2014, 87: 46-59.
[20] Dittmar T, Lara R J. Molecular evidence for lignin degradation in sulfate-reducing mangrove sediments (Amazonia, Brazil) [J]. Geochimica et Cosmochimica Acta, 2001, 65(9): 1417-1428.
[21] Farella N, Lucotte M, Louchouarn P, et al. Deforestation modifying terrestrial organic transport in the Rio Tapajos, Brazilian Amazon [J]. Organic Geochemistry, 2001, 32(12): 1443-1458.
[22] Houel S, Louchouarn P, Lucotte M, et al. Translocation of soil organic matter following reservoir impoundment in boreal systems: Implications for in situ productivity [J]. Limnology and Oceanography, 2006, 51(3): 1497-1513.
[23] Louchouarn P, Lucotte M, Farella N. Historical and geographical variations of sources and transport of terrigenous organic matter within a large-scale coastal environment [J]. Organic Geochemistry, 1999, 30(7): 675-699.
[24] Zhao J, Yao P, Yu Z, et al. Orthogonal design for optimization of pigment extraction from surface sediments of the Changjiang River Estuary [J]. Acta Oceanologica Sinica, 2011, 30(4): 33-42.
[25] Zhao J, Bianchi T S, Li X, et al. Historical eutrophication in the Changjiang and Mississippi delta-front estuaries: Stable sedimentary chloropigments as biomarkers [J]. Continental Shelf Research, 2012, 47: 133-144.
[26] Chen N, Bianchi T S, Bland J M. Implications for the role of pre-versus post-depositional transformation of chlorophyll-ain the Lower Mississippi River and Louisiana shelf [J]. Marine Chemistry, 2003, 81(1): 37-55.
[27] Chen N, Bianchi T S, McKee B A, et al. Historical trends of hypoxia on the Louisiana shelf: application of pigments as biomarkers [J]. Organic Geochemistry, 2001, 32(4): 543-561.
[28] Andersson A. A systematic examination of a random sampling strategy for source apportionment calculations [J]. Science of the Total Environment, 2011, 412: 232-238.
[29] Vonk J E, Sanchez-Garcia L, Semiletov I P, et al. Molecular and radiocarbon constraints on sources and degradation of terrestrial organic carbon along the Kolyma paleoriver transect, East Siberian Sea [J]. Biogeosciences Discussions, 2010, 7(4): 5191-5226.
[30] Karlsson E S, Charkin A, Dudarev O, et al. Carbon isotopes and lipid biomarker investigation of sources, transport and degradation of terrestrial organic matter in the Buor-Khaya Bay, SE Laptev Sea [J]. Biogeosciences Discussions, 2011, 8(2): 3463-3496.
[31] 于灏, 吴莹, 张经, 等. 长江流域植物和土壤的木质素特征 [J]. 环境科学学报, 2007, 27(5): 817-823.
[32] Hedges J I, Keil R G, Benner R. What happens to terrestrial organic matter in the ocean? [J]. Organic geochemistry, 1997, 27(5-6): 195-212.
[33] Fry B, Sherr E B. delta super (13) C measurements as indicators of carbon flow in marine and freshwater ecosystems [J]. Contributions in Marine Science, 1984, 27: 13-47.
[35] Meyers P A. Organic geochemical proxies of paleoceanographic, paleolimnologic, and paleoclimatic processes [J]. Organic Geochemistry, 1997, 27(5-6): 213-250.
[36] Redfield A C. The influence of organisms on the composition of sea water [M]. The Sea, 1963: 26-77.
[37] Bouloubassi I, Fillaux J, Saliot A. Hydrocarbons in surface sediments from the Changjiang (Yangtze river) estuary, East China Sea [J]. Marine Pollution Bulletin, 2001, 42(12): 1335-1346.
[38] 刘征涛, 张映映, 周俊丽, 等. 长江口表层沉积物中半挥发性有机物的分布 [J]. 环境科学研究, 2008, 21(2):10-13.
[39] 吴莹, 张经, 张再峰, 等. 长江悬浮颗粒物中稳定碳、氮同位素的季节分布 [J]. 海洋与湖沼, 2002, 33(5):546-552.
[40] Wu Y, Eglinton T, Yang L, et al. Spatial variability in the abundance, composition, and age of organic matter in surficial sediments of the East China Sea [J]. Journal of Geophysical Research: Biogeosciences, 2013, 118(4): 1495-1507.
[41] Hu L, Shi X, Yu Z, et al. Distribution of sedimentary organic matter in estuarine-inner shelf regions of the East China Sea: Implications for hydrodynamic forces and anthropogenic impact [J]. Marine Chemistry, 2012, 142: 29-40.
[42] Zhang L, Xue M, Wang M, et al. The spatiotemporal distribution of dissolved inorganic and organic carbon in the main stem of the Changjiang (Yangtze) River and the effect of the Three Gorges Reservoir [J]. Journal of Geophysical Research: Biogeosciences, 2014, 119(5): 741-757.
[43] Prahl F G, Ertel J R, Goni M A, et al. Terrestrial organic carbon contributions to sediments on the Washington margin [J]. Geochimica et Cosmochimica Acta, 1994, 58(14): 3035-3048.
[44] Smith R W, Bianchi T S, Savage C. Comparison of lignin phenols and branched/isoprenoid tetraethers (BIT index) as indices of terrestrial organic matter in Doubtful Sound, Fiordland, New Zealand [J]. Organic Geochemistry, 2010, 41(3): 281-290.
[45] Aller R C, Blair N E, Brunskill G J. Early diagenetic cycling, incineration, and burial of sedimentary organic carbon in the central Gulf of Papua (Papua New Guinea) [J]. Journal of Geophysical Research: Earth Surface (2003-2012), 2008, 113(F1): 1-22.
[46] Hu L, Shi X, Guo Z, et al. Sources, dispersal and preservation of sedimentary organic matter in the Yellow Sea: The importance of depositional hydrodynamic forcing [J]. Marine Geology, 2013, 335: 52-63.
[47] Tesi T, Miserocchi S, Goi M A, et al. Source, transport and fate of terrestrial organic carbon on the western Mediterranean Sea, Gulf of Lions, France [J]. Marine Chemistry, 2007, 105(1): 101-117.
[48] Prahl F G, Ertel J R, Goni M A, et al. Terrestrial organic carbon contributions to sediments on the Washington margin [J]. Geochimica et Cosmochimica Acta, 1994, 58(14): 3035-3048.
[49] Smith R W, Bianchi T S, Savage C. Comparison of lignin phenols and branched/isoprenoid tetraethers (BIT index) as indices of terrestrial organic matter in Doubtful Sound, Fiordland, New Zealand [J]. Organic Geochemistry, 2010, 41(3): 281-290.
[50] Sánchez-García L, de Andrés J R, Martín-Rubí J A, et al. Diagenetic state and source characterization of marine sediments from the inner continental shelf of the Gulf of Cádiz (SW Spain), constrained by terrigenous biomarkers [J]. Organic Geochemistry, 2009, 40(2): 184-194.
[51] Bianchi T S, Argyrou M, Chippett H F. Contribution of vascular-plant carbon to surface sediments across the coastal margin of Cyprus (eastern Mediterranean) [J]. Organic Geochemistry, 1999, 30(5): 287-297.
[54] Rice D L, Tenore K R. Dynamics of carbon and nitrogen during the decomposition of detritus derived from estuarine macrophytes [J]. Estuarine, Coastal and Shelf Science, 1981, 13(6): 681-690.
[55] 李先国, 杜培瑞, 孙书文, 等. 山东半岛东北岸近海表层沉积物中木质素的分布特征及有机物来源 [J]. 海洋湖沼通报, 2013 (002): 81-88.
[56] 李先国, 王敏, 孙书文, 等. 渤海表层沉积物中木质素的分布特征及其对陆源有机物来源的示踪意义 [J]. 海洋环境科学, 2013, 3: 2.
[57] Hastings R H, Goi M A, Wheatcroft R A, et al. A terrestrial organic matter depocenter on a high-energy margin: The Umpqua River system, Oregon [J]. Continental Shelf Research, 2012, 39: 78-91.
[58] Cloern J E. Turbidity as a control on phytoplankton biomass and productivity in estuaries [J]. Continental Shelf Research, 1987, 7(11): 1367-1381.
[59] Zhu Z Y, Ng W M, Liu S M, et al. Estuarine phytoplankton dynamics and shift of limiting factors: A study in the Changjiang (Yangtze River) Estuary and adjacent area [J]. Estuarine, Coastal and Shelf Science, 2009, 84(3): 393-401.
[60] 金海燕. 近百年来长江口浮游植物群落变化的沉积记录研究 [D]. 杭州: 浙江大学, 2009.
[61] 孔凡洲. 长江口赤潮区浮游植物的粒级结构, 种类组成和色素分析 [D]. 北京: 中国科学院研究生院 (海洋研究所), 2012.
[62] Zhu C, Wagner T, Pan J M, et al. Multiple sources and extensive degradation of terrestrial sedimentary organic matter across an energetic, wide continental shelf [J]. Geochemistry, Geophysics, Geosystems, 2011, 12(8): 297-307.
[63] 周连成, 李军, 高建华, 等. 长江口与舟山海域柱状沉积物粒度特征对比及其物源指示意义 [J]. 海洋地质与第四纪地质, 2009 (5): 21-27.
[64] 于培松, 薛斌, 潘建明, 等. 长江口和东海海域沉积物粒径对有机质分布的影响 [J]. 海洋学研究, 2011, 29(3): 202-208.
[65] 姚鹏, 于志刚, 郭志刚. 大河影响下的边缘海沉积有机碳输运与埋藏及再矿化研究进展 [J]. 海洋地质与第四纪地质, 2013, 1: 24.
[66] Yu H, Wu Y, Zhang J, et al. Impact of extreme drought and the Three Gorges Dam on transport of particulate terrestrial organic carbon in the Changjiang (Yangtze) River [J]. Journal of Geophysical Research: Earth Surface (2003-2012), 2011, 116(F4): 389-395.
[67] 姚鹏, 郭志刚, 于志刚. 大河影响下的陆架边缘海沉积有机碳的再矿化作用 [J]. 海洋学报, 2014(2): 23-32.
[68] Aller R C, Blair N E. Carbon remineralization in the Amazon-Guianas tropical mobile mudbelt: A sedimentary incinerator [J]. Continental Shelf Research, 2006, 26(17): 2241-2259.
[69] Aller R C, Blair N E. Early diagenetic remineralization of sedimentary organic C in the Gulf of Papua deltaic complex (Papua New Guinea): Net loss of terrestrial C and diagenetic fractionation of C isotopes [J]. Geochimica et Cosmochimica Acta, 2004, 68(8): 1815-1825.
[70] Bianchi T S. The role of terrestrially derived organic carbon in the coastal ocean: A changing paradigm and the priming effect [J]. Proceedings of the National Academy of Sciences, 2011, 108(49): 19473-19481.
[71] Guenet B, Danger M, Harrault L, et al. Fast mineralization of land-born C in inland waters: first experimental evidences of aquatic priming effect [J]. Hydrobiologia, 2014, 721(1): 35-44.
责任编辑 徐 环
Sources, Distribution and Diagenetic State of Sedimentary Organic Carbon in The Changjiang Estuary
ZHAO Bin1, 2, YAO Peng1, 3, 4, PAN Hui-Hui1, 2, ZHANG Ting-Ting1, 2, LI Dong1, 2, WANG Jin-Peng1, 2
(1. Key Laboratory of Marine Chemistry Theory and Technology, Ministry of Education, Qingdao 266100, China; 2.College of Chemistry and Chemical Engineering, Ocean University of China, Qingdao 266100, China; 3.Qingdao Collaborative Innovation Center of Marine Science and Technology, Qingdao 266100, China; 4.Institute of Marine Organic Geochemistry, Ocean University of China, Qingdao 266100, China)
The sources and fate of sedimentary organic carbon (SOC) in LDEs play a critical role in controlling the global carbon cycle. Surface sediments were collected from the Changjiang Estuary and its adjacent sea. Grain size composition, OC and stable carbon isotope composition, lignin-phenols and pigments were analyzed by combining the results of three end-member mixing model based on Monte-Carlo Simulation to discuss the sources, distribution and diagenetic state of SOC. The results showed that OC content of surface sediments from Changjiang Estuary ranged from 0.21% to 0.63%. The δ13C of TOC in this study ranged from -23.1‰ to -20.9‰, indicating a mixture of terrestrial and marine derived OC. The OC-normalized lignin phenols (Λ8) ranged from 0.16 to 1.41 mg/100 mg OC and its composition characteristics showed that they originated from a mixture of woody and nonwoody angiosperms. The dominant fraction of sedimentary pigments was degradation products of chlorophyll and mainly distributed in outer shelf. The main fraction of carotenoid was fucoxanthin, indicating that diatoms were dominant species in the study area. Based on the three end-member mixing model, the contribution of marine OC increased from 54.3% in the river mouth to 88.1% in the outer shelf with an average of 70.2%. The contributions of soil (9.3 to 32.1%, 22.3% in average) and C3vascular plant (2.7 to 13.6%, 7.5% in average) were relatively small and both were higher in the Changjiang Estaury and Zhe-Min coast. Significant correlation and coincidence in the distribution of grain size composition, OC, δ13C and biomarker concentrations showed that hydrodynamic sorting processes play an important role on the transport of terrestrial OC. Fresh and lignin-rich terrestrial high plant debris mainly associated with coarse particles and settled on the estuary, whereas lignin-poor soil-derived OC mainly associated with fine particles and can be transported far away from estuary. The lignin degradation indices, such as ratios of acid and aldehyde, 3, 5-Bd/V and P/(S+V) were relatively high in offshore sandy regions indicated that terrestrial OC was highly degraded in this area, whereas the ratio of degradation products of chlorophyll was relatively high in the Changjiang Estuary mud-belt area, probably due to the strong OC remineralization in the mud deposits.
Changjiang Estuary; sedimentary organic carbon; source; hydrodynamic sorting; early diagenesis
国家自然科学基金面上项目(41176063);国家自然科学基金重大国际(地区)合作研究项目(40920164004);国家自然科学基金创新研究群体项目(41221004)资助
2014-09-09;
2015-03-23
赵 彬(1988-),男,博士生。E-mail: zhaobin1988@hotmail.com
❋❋通讯作者:E-mail: yaopeng@ouc.edu.cn
P734.5
A
1672-5174(2015)11-049-13
10.16441/j.cnki.hdxb.20140278

