不同温度、盐度和培育密度对脉红螺浮游幼虫生长存活的影响❋
杨智鹏, 于 红, 于瑞海, 李 琪
(中国海洋大学海水养殖教育部重点实验室,山东 青岛 266003)
不同温度、盐度和培育密度对脉红螺浮游幼虫生长存活的影响❋
杨智鹏, 于 红❋❋, 于瑞海, 李 琪
(中国海洋大学海水养殖教育部重点实验室,山东 青岛 266003)
为实现脉红螺苗种规模化生产,确立适宜苗种生长的环境条件。本文分析了6个不同温度、6个不同盐度和5个不同培育密度对脉红螺浮游幼虫生长和存活的影响。温度实验结果显示:适宜脉红螺浮游幼虫生长的温度范围是24~30℃,最适生长温度是30℃;适宜的存活温度范围是24~30℃,最适存活温度是27℃。盐度实验结果显示:适宜脉红螺浮游幼虫生长的盐度范围是22~30,最适生长盐度是26;适宜的存活盐度范围是22~34,最适存活盐度是26。密度实验结果显示:脉红螺浮游幼虫培育密度不应高于1个/mL,适宜的培育密度范围是0.1~0.5个/mL。
脉红螺;幼虫;温度;盐度;密度;生长;存活
脉红螺(Rapanavenosa)俗称海螺、红螺,隶属于软体动物门腹足纲(Gastropoda)新腹足目(Neogastropoda)骨螺科(Muricidae)红螺属(Rapana),主要分布于中国、朝鲜半岛和日本沿海,是中国北方沿海常见的经济贝类[1]。脉红螺足部肥大、肉味鲜美,除鲜食外,还可制罐、冷冻或加工成干制品,其壳还可以入药,是一种具有重要经济价值和医用价值的大型腹足类,深受国内外广大消费者欢迎[2-3]。近年来,随着海洋环境污染的加重及渔业捕捞强度的加大,中国脉红螺自然资源日趋衰减[4],因此开展人工育苗对于脉红螺种质资源保护及满足市场需求具有重要意义。
环境因子(如温度、盐度、培育密度等)是影响贝类幼虫生长发育、存活的重要因素。优化幼体生长发育的环境因子,是提高贝类苗种产量的必由之路。温度与贝类幼虫的生长、发育、摄食、新陈代谢等生命过程密切相关,例如:25℃时,毛蚶幼虫活力低下,消化不良,存活率高但是生长率较低[5];西施舌壳顶幼虫在水温29~31℃时,面盘收缩,停止摄食,72h全部死亡[6];缢蛏浮游幼虫在25℃时生长速度最快,存活率和变态率都很高,但在35℃时存活率极低[7]。大部分贝类没有渗透压的调节能力,当外界环境盐度不适宜时,会影响其摄食和代谢,最终导致生长率和存活率的下降[8-9],例如,滑顶薄壳鸟蛤面盘幼虫在盐度低于12时不能存活,最适盐度为28.0~32.2[10];在低盐的情况下方斑东风螺胚胎发育停滞甚至出现畸形[11]。培育密度影响着贝类幼虫的摄食、消化、生长和代谢[12],例如,菲律宾蛤仔幼虫适宜的生长密度是5~10个/mL,当密度超过15个/mL时浮游期延长[13]。
研究者已开展了脉红螺的繁殖生物学、人工育苗等方面的初步研究。据报道,脉红螺在山东沿海6月中、下旬进入交尾期,7月达到繁殖高峰[3],水温22℃时,在盐度20.0~39.5下的脉红螺卵袋都可以孵出幼体[14],水温34℃盐度30时,孵化时间最短只需12d,水温25℃盐度35时,孵化率最高为72.93%±4.85%[15]。杨大佐等进行了脉红螺的人工育苗试验,并取得了初步成功,研究发现附着底栖硅藻的波纹板采苗效果较好[16]。然而,有关环境因子对脉红螺浮游幼虫生长和发育影响的研究报道很少。因此,本研究通过设定不同温度、盐度和培育密度,研究环境因子对脉红螺浮游幼虫生长和存活的影响,查明脉红螺浮游幼虫生长存活的适宜环境条件,以期为脉红螺大规模人工育苗提供基础资料。
1 材料与方法
1.1 实验材料
2014年5月2日,挑选健康、壳体完整、壳高8~10 cm,采自莱州的脉红螺作为亲贝,暂养于烟台海益苗业有限公司。室内暂养过程中,投喂四角蛤蜊、菲律宾蛤仔和牡蛎作为饵料。5月22日产出第一批卵袋,6月7日第一批卵袋孵出,用孵出的第一批卵袋进行实验。卵袋孵化过程中的水温为22~25℃,盐度为30。
1.2 实验设计
温度实验设置36、33、30、27、24和21 ℃ 6个梯度,盐度为30;盐度实验设置38、34、30、26、22、18 6个梯度,温度为24~27℃;密度实验设置2、1、0.5、0.2和0.1个/mL 5个梯度,盐度为30,温度为24~27℃。温度、盐度和密度实验每个梯度设置3个生物学重复,实验均在15 L的塑料水桶中进行。温度和盐度实验组的幼虫初始密度为0.3个/mL。
实验过程中日换水2次,投喂饵料种类包括金藻、扁藻和小球藻,日投饵3次,每3d测一次幼虫的壳高和密度。各平行组随机选取30个幼虫进行测量,求取平均得到各平行组壳高数据,再对3个平行组的壳高进行平均得到该处理组的平均壳高;对各平行组的幼虫密度测3次,求取平均得到各平行组的密度,再对3个平行组的密度进行平均得到该处理组的平均密度。
1.3 实验数据处理
单因子ANOVA分析不同温度、盐度和培育密度对脉红螺浮游幼虫生长和存活的影响,利用LSD多重比较分别检测各温度、盐度和密度处理组之间的差异。显著性水平设定P<0.05。所有的统计分析均使用软件SPSS16.0进行。
2 结果
2.1 不同温度对脉红螺浮游幼虫生长存活的影响
2.1.1 不同温度对浮游幼虫生长的影响 由于第3天温度36和33℃组幼虫全部死亡,因此后面的分析中不包括这2组实验数据。单因子方差分析显示,第3天,温度30和27℃组生长最快,平均壳高分别为394和393 μm(见图1),与温度24和21℃组差异显著(P<0.05),温度21℃组生长最慢,平均壳高为378μm。第6天、第9天和第12天,温度30℃组均生长最快,平均壳高分别为437、639和699μm,与其它各组之间差异显著(P<0.05),温度21℃组生长最慢,平均壳高分别为390、416和467μm,与其它各组之间差异显著(P<0.05)。
2.1.2 不同温度对浮游幼虫存活的影响 如图2所示,整个实验过程中温度27℃组的存活率最高,其次分别是温度24和21℃组,温度30℃的存活率最低;第3天和第6天,温度27℃组和24℃组之间没有显著性差异(P>0.05),温度30℃组与各组之间差异显著(P<0.05);第9和第12天,温度27℃组和各组之间差异显著(P<0.05),温度30℃组与各组之间差异显著(P<0.05)。

图1 不同温度下浮游幼虫的壳高生长Fig.1 The shell length growth of the planktonic larvae at different temperatures

图2 不同温度下浮游幼虫的存活率Fig.2 The survival rates of the planktonic larvae at different temperatures
2.2 不同盐度对脉红螺浮游幼虫生长存活的影响
2.2.1 不同盐度对浮游幼虫生长的影响 单因子方差分析显示:第3天,盐度34组与盐度18组之间存在显著性差异(P<0.05),但是各自与其它各组不存在显著性差异。第6天,盐度26组生长最快,平均壳高为411μm,与盐度34、30、22、18组没有显著差异(P>0.05),盐度38组生长最慢,平均壳高为376μm(见图3),与其它各组之间差异显著(P<0.05)。第9天,盐度26组生长最快,平均壳高为487μm,与盐度30、22组没有显著性差异(P>0.05),盐度34组生长最慢,平均壳高为440μm,与盐度26组之间差异显著(P<0.05)。第12天,盐度26组生长最快,平均壳高为567μm,盐度34组生长最慢,平均壳高为488μm,与盐度18组之间差异不显著(P>0.05),与盐度22、26、30组具有显著性差异(P<0.05)。
2.2.2 不同盐度对浮游幼虫存活的影响 随着培育时间的延长,幼虫的存活率逐渐降低(见图4)。第3天,盐度38组存活率最低为52%,与其它各组之间具有显著性差异(P<0.05),盐度26和30组的存活率最高为90%,与盐度22组差异不显著(P>0.05)。第6天,盐度38组存活率最低为31%,与其它各组之间差异显著,盐度22和26组存活率最高都是80%,与盐度30和18组差异不显著(P>0.05)。第9天,盐度38组的幼虫全部死亡。第9天和第12天,存活率最低的都是盐度18组,分别为40%和37%,并且与其它各组之间差异显著(P<0.05),存活率最高的是盐度30组,分别为77%和67%,与盐度26、22、34组之间没有显著性差异(P>0.05)。

图3 不同盐度下浮游幼虫的壳高生长Fig.3 The shell length growth of the planktonic larvae in different salinities

图4 不同盐度下浮游幼虫的成活率Fig.4 The survival rates of the planktonic larvae in different salinities
2.3 不同密度对脉红螺浮游幼虫生长存活的影响
2.3.1 不同密度对浮游幼虫生长的影响 单因素方差分析显示:第3天,密度0.5个/mL组生长最快,平均壳高为398μm(见图5),密度2个/mL组生长最慢,平均壳高为359μm,二者之间差异显著(P<0.05);第6天,密度1个/mL组生长最快,平均壳高为435μm,与密度0.5、0.2和0.1个/mL组之间没有显著性差异(P>0.05),密度2个/mL组生长最慢,与其它各组之间差异显著(P<0.05);第9天和第12天,密度0.1、0.2和0.5个/mL组生长最快,三者之间差异不显著(P>0.05),并且显著高于密度1和2个/mL组,密度1和2个/mL组生长最慢,两者之间差异不显著(P>0.05)。
2.3.2 不同密度对浮游幼虫存活的影响 如图6所示,第3天,密度0.5个/mL组的存活率最高,密度2个/mL组的幼虫存活率最低,并且与其它各组之间差异显著(P<0.05);第6天,密度0.1个/mL和密度0.5个/mL组的存活率最高都是90%,密度2和1个/mL组的幼虫存活率最低分别为55%和62%,并且它们之间差异不显著(P>0.05);第9天,密度0.1个/mL和密度0.2个/mL组的存活率最高,密度2个/mL组的幼虫存活率最低为47%;第12天,密度2个/mL组的脉红螺幼虫全部死亡,密度0.1个/mL组存活率最高为80%,与密度0.2个/mL和密度0.5个/mL组之间差异不显著(P>0.05),密度1个/mL组幼虫存活率最低为22%;第15天,密度1个/mL组的脉红螺幼虫全部死亡,密度0.1、0.2和0.5个/mL组之间没有显著性差异(P>0.05)。

图5 不同密度下浮游幼虫的壳高生长Fig.5 The shell length growth of the planktonic larvae in different stocking densities
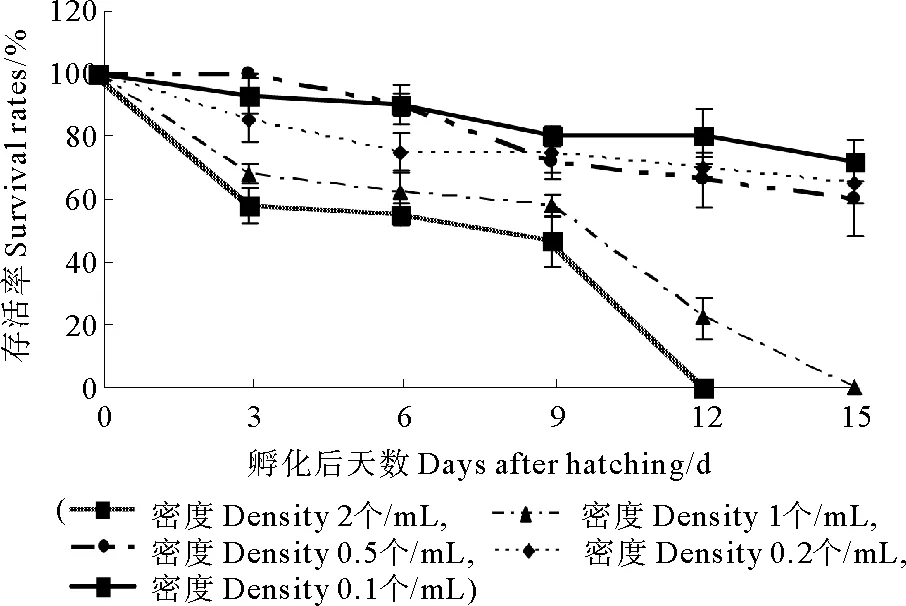
图6 不同密度下浮游幼虫的存活率Fig.6 The survival rates of the planktonic larvae in different stocking densities
3 讨论
温度是影响海洋无脊椎动物幼虫生长发育及成活的主要环境因子之一。本实验条件下,脉红螺浮游幼虫最适生长温度是30℃,适宜的生长温度范围是24~30℃,最适存活温度是27℃,适宜的存活温度范围是24~30℃,温度超过33℃时幼虫在第3天全部死亡,因此幼虫培育过程中温度不宜超过33℃。尽管本实验中脉红螺浮游幼虫30℃的时候生长率最高,但是此时存活率较低,类似的结果在Clinocardiumnuttallii[17]、Macomabalthica[18]等其他贝类中也有所报道。这证实,在苗种生产过程中,幼虫培育水温的升高可以促进幼虫的生长,但当水温升高到一定程度时,也会显著降低幼虫的存活率。有学者认为,高温加速了水中致病原生动物及细菌的滋生,增加了耗氧,同时可能导致幼虫摄食量下降,从而导致存活率较低[19-20]。因此,为提高苗种的生长率及成活率,脉红螺幼虫培育最适温度为27℃。
海洋贝类的苗种培育中,盐度对幼虫的生长发育影响至关重要,了解幼虫的盐度适宜范围,是人工育苗中的一项重要工作。王军等得出脉红螺浮游幼虫适宜的存活盐度为29.5~35.5[14],但是因为设计的盐度梯度较大,未能查清其最适存活盐度。本实验条件下,脉红螺浮游幼虫适宜的生长盐度范围是22~30,适宜的存活盐度范围是22~34,最适培育盐度是26。盐度26组幼虫日平均壳高生长为17μm,与魏利平等报道的脉红螺浮游幼虫前16天日平均壳高生长17.5μm相似[3]。本实验中,脉红螺幼虫孵化后前3天,各盐度组之间生长情况差异不明显,3 d后,随着盐度的升高,生长率升高,盐度达到26后,随着盐度的升高,生长率下降,类似的规律在栉孔扇贝、泥蚶等其它海水贝类的研究中也有过报道[21-22]。盐度38组在第9天全部死亡,因此盐度38是脉红螺浮游幼虫存活的盐度上限。
幼虫的培育密度是决定苗种培育中出苗量的重要因素之一。研究发现高密度养殖会抑制水产动物的生长存活,只有适当的提高培育密度才可提高苗种产量,降低成本。例如Hermissendacrassicornis幼虫适宜的生长密度为0.5~4个/mL,在密度为15个/mL时几乎不生长[23]。Argopectennucleus幼虫在培育密度为5个/mL时生长速度变慢,存活率明显降低[20]。对于文蛤Meretrixmeretrix,10~20个/mL是其幼虫适宜的培育密度[24]。本实验条件下,脉红螺浮游幼虫适宜的培育密度为0.1~0.5个/mL,超过1个/mL时,生长率和存活率都有显著降低。高密度导致的幼虫生长率下降是由于种内对食物和空间的竞争加剧[24]。浮游幼虫是通过面盘来游泳和摄食的,碰撞会导致面盘的收缩[25],从而降低了摄食活动,影响了幼虫的生长。高密度导致幼虫的死亡率上升被认为是由水质引起的,水质在幼虫密度很大的情况下会变得更加难于控制[24]。
由于是单因子试验,尚不能说明其温度、盐度、培育密度之间的关系,因此需要在今后的研究中探索多因子对脉红螺浮游幼虫生长存活的共同影响。
[1] 谢忠明. 海水经济贝类养殖技术 [M]. 北京: 中国农业出版社, 2003: 86-87.
[2] 孙晓朋, 袁春营, 崔青曼, 等. 4种天津近海产贝类牛磺酸和糖胺聚糖的粗提及含量比较 [J]. 水生态学杂志, 2010, 3(2): 80-83.
[3] 魏利平, 邱盛尧, 王宝钢, 等. 脉红螺繁殖生物学的研究 [J]. 水产学报, 1999, 23(2): 150-155.
[4] 梁淑轩, 倪新娟, 赵兴茹, 等. 渤海湾脉红螺中多氯联苯和多溴联苯醚的测定分析 [J]. 环境科学研究, 2012, 25(4): 441-446.
[5] 沈伟良, 尤仲杰, 施祥元. 温度与盐度对毛蚶受精卵孵化及幼虫生长的影响 [J]. 海洋科学, 2009, 33(10): 5-8.
[6] 刘德经, 张克存, 黄德尧, 等. 西施舌幼虫及稚贝致死温度初步研究 [J]. 动物学杂志, 2001, 36(1): 29-31.
[7] 林笔水, 吴天明. 温度和盐度对缢蛏浮游幼虫发育的影响 [J]. 生态学报, 1984, 4(4): 385-392.
[8] His E, Robert R, Dinet A. Combined effects of temperature and salinity on fed and starved larvae of the Mediterranean musselMytilusgalloprovincialisand the Japanese oysterCrassostreagigas[J]. Marine Biology, 1989, 100(4): 455-463.
[9] Gilles R. Osmoregulation in three molluscs:Acanthochitonadiscrepans(Brown),Glycymerisglycymeris(L.) andMytilusedulis(L.) [J]. Biol Bull, 1972, 142: 25-35.
[10] 李世英, 鲁男, 蒋双, 等. 温度、盐度对滑顶薄壳鸟蛤面盘幼虫存活和生长的影响 [J]. 大连水产学院学报, 1999, 14(2): 66-69.
[11] 吴进锋, 陈素文, 陈利雄, 等. 温度与盐度对方斑东风螺胚胎发育及幼虫生长的影响 [J]. 中国水产科学, 2005, 12(5): 652-656.
[12] MacDonald B A. Physiological energetics of Japanese scallopPatinopectenyessoensislarvae [J]. Journal of Experimental Marine Biology and Ecology, 1988, 120(2): 155-170.
[13] Yan X W, Zhang G F, Yang F. Effects of diet, stocking density, and environment factors on growth, survival, and metamorphosis of Manila clamRuditapesphilippinarumlarvae [J]. Aquaculture, 2006, 253(1): 350-358.
[14] 王军, 王志松, 董颖, 等. 盐度对脉红螺卵袋幼体的孵出及浮游幼体存活和生长的影响 [J]. 水产科学, 2003, 22(5): 9-11.
[15] Ban S J, Zhang T, Pan H Q, et al. Effects of temperature and salinity on the development of embryos and larvae of the veined rapa whelkRapanavenosa(Valenciennes, 1846) [J]. Chinese Journal of Oceanology and Limnology, 2014, 32(4): 773-782.
[16] 杨大佐, 周一兵, 管兆成, 等. 脉红螺工厂化人工育苗试验 [J]. 水产科学, 2007, 26(4): 237-239.
[17] Liu W, Gurney Smith H, Beerens A, et al. Effects of stocking density, algal density, and temperature on growth and survival of larvae of the basket cockle,Clinocardiumnuttallii[J]. Aquaculture, 2010, 299(1): 99-105.
[18] Drent J. Temperature responses in larvae ofMacomabalthicafrom a northerly and southerly population of the European distribution range [J]. Journal of Experimental Marine Biology and Ecology, 2002, 275(2): 117-129.
[19] Gruffydd L D, Beaumont A R. A method for rearingPectenmaximuslarvae in the laboratory [J]. Marine Biology, 1972, 15(4): 350-355.
[20] Velasco L A, Barros J. Experimental larval culture of the Caribbean scallopsArgopectennucleusandNodipectennodosus[J]. Aquaculture Research, 2008, 39(6): 603-618.
[21] 梁玉波, 张福绥. 温度、盐度对栉孔扇贝 (Chlamysfarreri) 胚胎和幼虫的影响 [J]. 海洋与湖沼, 2008, 39(4): 334-340.
[22] 尤仲杰, 徐善良, 边平江, 等. 海水温度和盐度对泥蚶幼虫和稚贝生长及存活的影响 [J]. 海洋学报, 2001, 23(6): 108-113.
[23] Avila C, Grenier S, Tamse C T, et al. Biological factors affecting larval growth in the nudibranch molluscHermissendacrassicornis(Eschscholtz, 1831) [J]. Journal of Experimental Marine Biology and Ecology, 1997, 218(2): 243-262.
[24] Liu B Z, Dong B, Tang B J, et al. Effect of stocking density on growth, settlement and survival of clam larvae,Meretrixmeretrix[J]. Aquaculture, 2006, 258(1-4): 344-349.
[25] Cragg S M. Swimming behaviour of the larvae ofPectenmaximus(L.) (Bivalvia) [J]. J Mar Biol Assoc UK, 1980, 60(3): 551-565.
责任编辑 朱宝象
Effects of Temperature, Salinity and Stocking Density on the Growth and Survival of Veined Rapa Whelk (Rapanavenosa) Pelagic Larvae
YANG Zhi-Peng, YU Hong, YU Rui-Hai, LI Qi
(The Key Laboratory of Mariculture, Ministry of Education, Ocean University of China, Qingdao 266003, China)
In this study, we investigated the effects of different temperatures (36, 33, 30, 27, 24 and 21 ℃), salinities (38, 34, 30, 26, 22 and 18) and stocking densities (2, 1, 0.5, 0.2 and 0.1 ind/mL) on the growth and survival of veined rapa whelk (Rapanavenosa) pelagic larvae. The results of temperature treatments showed that temperatures between 24 and 30 ℃ were suitable for the growth ofR.venosapelagic larvae, and the optimum growth temperature was 30 ℃. Such range of temperature was also suitable for their survival, and the optimal survival temperature was 27 ℃. The results of salinity treatments demonstrated that salinities between 22 and 30 were suitable for the growth ofR.venosapelagic larvae, and the optimum was 26. Salinities between 22 and 34 were suitable for their survival, and the optimal was also 26. The results of density treatments indicated that the stocking density ofR.venosapelagic larvae should less than 1 ind/mL, and the suitable density varied between 0.1 to 0.5 ind/mL.
Rapanavenosa; larva; temperature; salinity; stocking density; growth; survival
国家自然科学基金项目(31201998);国家科技支撑计划项目(2011BAD13B01);青岛市科技计划基础研究项目(13-1-4-178-jch)资助
2014-09-17;
2014-12-30
杨智鹏(1991-),男,硕士生。E-mail: yzpouc2013@163.com
❋❋通讯作者: E-mail: hongyu@ouc.edu.cn
S968.3
A
1672-5174(2015)11-015-05
10.16441/j.cnki.hdxb.20140302

