APX基因植物表达双元载体的构建及转化剑麻
覃海燕等

摘 要 剑麻是中国热带地区最重要的麻类经济作物。剑麻H.11648是中国唯一的当家品种,此品种虽高产但易感斑马纹病,而现有的化学农药防效差且病原菌易产生抗性。为了培育出剑麻抗病新品种,以Pcambia3300为基础质粒,构建由35S驱动的APX基因的植物表达载体Pcambia3300-35S-APX-nos,再通过农杆菌EHA105将其导入剑麻中,经PCR扩增后电泳检测分析,结果表明外源基因已整合到受体植物基因组中。
关键词 剑麻;APX基因;斑马纹病;转化
中图分类号 S563.8 文献标识码 A
Abstract Sisal is one of the most important cash crops in the tropical areas of China. Sisal H. 11648 is Chinas only variety dorminantly planted. The variety is of high yield but susceptable to zebra grain, and the control effect of chemical pesticides is poor and the pathogens are prone to resistance. In order to breed new sisal disease-resistant varieties, Agrobacterium-mediated APX gene transformation of sisal was tried. On the basis of Pcambia 3300 plasmid, an APX'S plant expression vector Pcambia-3300-APX which driven by 35S was built and transformed to sisal by agrobacterium EHA105. PCR amplification and electrophoresis detection analysis showed that the exogenous gene was integrated into the receptor plant genome.
Key words Sisal;APX;Zebra disease;Transformation
龙舌兰科植物共有21属约670种,龙舌兰麻系是龙舌兰科所属单子叶植物的统称,俗称剑麻,英文名Sisal。 剑麻主要分布于热带、亚热带地区。中国是剑麻的主要生产国之一,中国现在的主栽品种为11648号(Agave hybrid NO.11648,简写为 H.11648)。剑麻H.11648是中国从国外引进的杂交种,虽高产但易感斑马纹病。剑麻斑马纹病是危害剑麻的主要病害之一,由烟草疫霉(Phytophthora nicotianae var. parasitica)引起。1961年坦桑尼亚首先发现此病,中国1970年首次在广东省东方红农场出现此病,1973年暴发流行,此后持续流行,造成严重损失。因烟草疫霉对现存的药剂能够很快的产生耐药性,目前生产上正在使用的杀菌剂很难有效防治斑马纹病,因此急需选育剑麻抗病新种质。剑麻一生只开一次花,开花结果后死亡,其营养生长周期长,一般为10 a,有的甚至长达15 a以上,且花期不一致、花粉不易贮藏、种子发芽率低(一般在10%左右)、F1育性差等特点,从而导致近几十年来通过杂交育种、辐射育种等方法虽然也育成了一些品种,但还未超越H.11648。基因工程育种能够打破物种间的界限,将其他物种中优良的基因导入剑麻中对其进行定向改良。
抗坏血酸过氧化物酶(Ascorbate peroxidase, 以下简写为APX)广泛存在于各种植物体中。植物体无论是在正常的生物代谢还是在受到生物胁迫或非生物胁迫时都会产生大量的过氧化物,过氧化物若不及时清除会造成植物细胞膜和叶绿体的损伤,甚至造成植物死亡。抗坏血酸过氧化物酶通过清除植物体中的过氧化物来提高植物对生物和非生物胁迫的抵抗能力。张怡[1]通过突变筛选得到APX基因超表达植株,表明APX基因的超表达能够提高植物抵抗环境胁迫的能力。程林梅等[2]和孙卫红等[3]通过将APX基因转入菊苣和烟草中,结果显示转基因植株的抗逆性提高。孙宏丽[4]通过构建反义载体并转入烟草中,得到的转基因植株抗氧化能力降低。蒋明等[5]通过对青花菜APX基因进行RT-PCR分析,结果表明APX基因的表达受霜霉病菌、水杨酸和NaCl诱导。Sarowar等[6-7]将来自于胡椒叶片的抗坏血酸过氧化物酶基因(ascorbate peroxidase-like 1)导入烟草,极大地提高了植物抵抗烟草疫霉的能力, 并在次年发现番茄中的过氧化物酶基因能够抵抗卵菌型的病原体。
鉴于此,本实验拟通过将胡椒叶片中的APX基因插入Pcambia3300载体并转入剑麻中,从而获得既抗剑麻斑马纹病,又抗除草剂的植株。
1 材料与方法
1.1 材料
Pbi121表达载体、Pcambia3300表达载体和农杆菌EHA105均由中国热带农业科学院生物技术研究所张树珍实验室提供,Puc57-APX由本实验室保存。限制性内切酶为fragment公司产品,DNA聚合酶为NEB公司产品,其他产品均由市售分析纯试剂。
1.2 方法
1.2.1 Pcambia3300-APX表达载体的构建 (1)pbi121-APX的构建:设计引物对5′- GCTCTAGAGCA
CGAGGTCGGTTCTCTCTC-3′和5′-TCGAGCTCCCTC
CAAAGTATGGGTATC-3′(引物中下划线部分表示XbaⅠ和SacⅠ酶切位点),以Puc57-APX载体为模板,PCR扩增获得目的基因APX。上述PCR产物用XbaⅠ和SacⅠ进行双酶切,并利用PCR产物回收试剂盒回收片段。pbi121质粒用XbaⅠ和SacⅠ进行双酶切,电泳后进行胶回收(pbi121回收大片段)。将上述2个片段用T4 DNA连接酶进行连接,热激法转入大肠杆菌中,挑取单克隆进行扩繁,提取质粒进行双酶切验证,挑取阳性克隆送公司测序。
(2)Pcambia3300-35S-APX-nos表达载体的构建:设计引物对5′-ATCCCCGGGCATGGAGTCAAA
GATTCAAATAGAG-3′和5′-CCCAAGCTTCCCGATC
TAGTAACATAGATGACAC-3′(引物中下划线部分表示HindⅢ和SmaⅠ酶切位点),以pbi121-apx载体为模板,PCR扩增获得35S-APX-nos的全长。将上述PCR产物和Pcambia3300分别用HindⅢ和SmaⅠ进行双酶切,用PCR产物回收试剂盒回收35S-APX-nos片段(约2 kb),Pcambia3300回收片段(约8.4 kb),将2个回收片段经T4 DNA连接酶连接,热激法转入大肠杆菌中,挑取单克隆进行扩繁,提取质粒进行双酶切验证,挑取阳性克隆送公司测序。
(3)表达载体转入农杆菌:将重组表达载体Pcambia3300-35S-APX-nos经液氮冻融法转入到农杆菌EHA105中,用含有50 mg/L卡那霉素、50 mg/L利福平和50 mg/L链霉素的YEP平板进行筛选,提取质粒经双酶切验证,显示阳性的菌液经-70 ℃液氮速冻保存,备用。
1.2.2 剑麻的遗传转化 (1)转化菌液的制备:将含有Pcambia3300空载体的农杆菌从-70 ℃液氮速冻中取出涂布于含有抗生素(50 mg/L卡那霉素、50 mg/L利福平和50 mg/L链霉素)YEP平板进行活化,2 d后挑取单菌落接种于含有抗生素(50 mg/L卡那霉素、50 mg/L利福平和50 mg/L链霉素)YEP液体培养基中,经28 ℃、200 r/min振荡培养至OD600为对数期时备用。
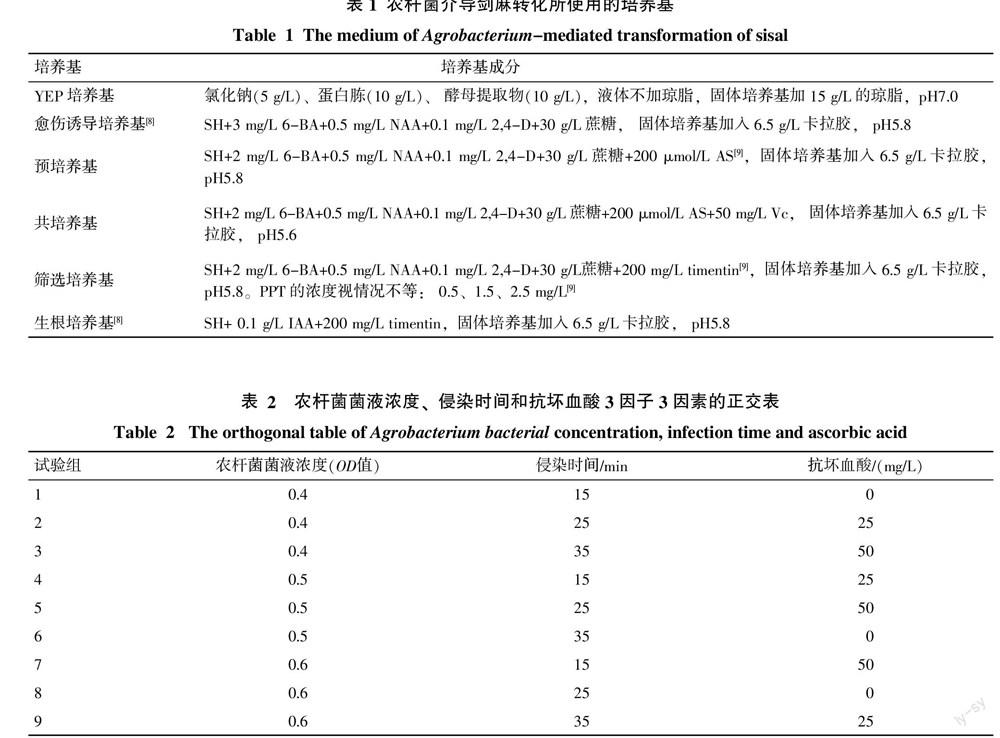
(2)影响剑麻遗传转化的因素:取剑麻组培苗的茎尖,放入剑麻愈伤诱导培养基中诱导生成愈伤。将愈伤切成0.5 cm3大小,预培养3 d(暗培养)后,在农杆菌菌液(菌液OD为0.4)中浸泡15 min。取出外植体用滤纸吸干多余的菌液,置于共培养基中共培养3 d(暗培养)。将转化后的剑麻愈伤组织经无菌水清洗3次,再用含有200 mg/L的timentin的无菌水清洗3次。转入筛选培养基中筛选3轮(每轮15 d),最后统计抗性愈伤率。所有培养基均经过121 ℃高压灭菌20 min,且抗生素通过无菌22 μm滤膜过滤除菌(表1)。
对于转化的影响因素,设计了7组试验:①预培养时间:1、2、3、4 d;②农杆菌菌液浓度、侵染时间和抗坏血酸的影响:设计了3因子3因素的正交试验(表2);③表面活性剂的影响:在感染液中添加0、0.01%、0.1%、1%(V/V)的tween20;④共培养温度:19、22、25、28 ℃;⑤共培养时间:2、3、4、5 d;⑥干燥处理:侵染后直接放入共培养基中,在超净工作台中处理30、60 min后,再放入共培养基中培养;⑦滤纸的使用:在共培养基上加滤纸和不加滤纸2种处理。其它所有剑麻组培过程均在28 ℃,光照强度3,光照时间16 h/d条件下进行。
(3)剑麻的遗传转化。转化菌液的制备:将含有APX基因的农杆菌从-70 ℃中取出,涂布于含有抗生素(50 mg/L卡那霉素、50 mg/L利福平和50 mg/L链霉素)YEP平板进行活化,2 d后挑取单菌落接种于含有抗生素(50 mg/L卡那霉素、50 mg/L利福平和50 mg/L链霉素)YEP液体培养基中,经28 ℃、200 r/min振荡培养至OD600为0.5时备用。再按1.2.2(2)优化的剑麻遗传转化体系,用含有APX基因的农杆菌侵染剑麻愈伤组织100个,得到分化的小苗。
(4)抗性植株的PCR:提取再生植株叶的总DNA并以其作为模板,利用引物1(5′-ATCCCCGGG
CATGGAGTCAAAGATTCAAATAGAG-3′)和引物2(5′-CCCAAGCTTCCCGATCTAGTAACATAGATGAC
AC-3′)进行PCR扩增,PCR程序为:2xPCRmix 12.5 μL,引物1(10 μm)和引物2(10 μm)各位1.0 μL,Template 1.0 μL,ddH2O 9.5 μL,总体积25.0 μL。最后扩增得到的片段大小为1 102 bp。
2 结果与分析
2.1 重组Pcambia3300-35S-APX-nos载体的酶切验证
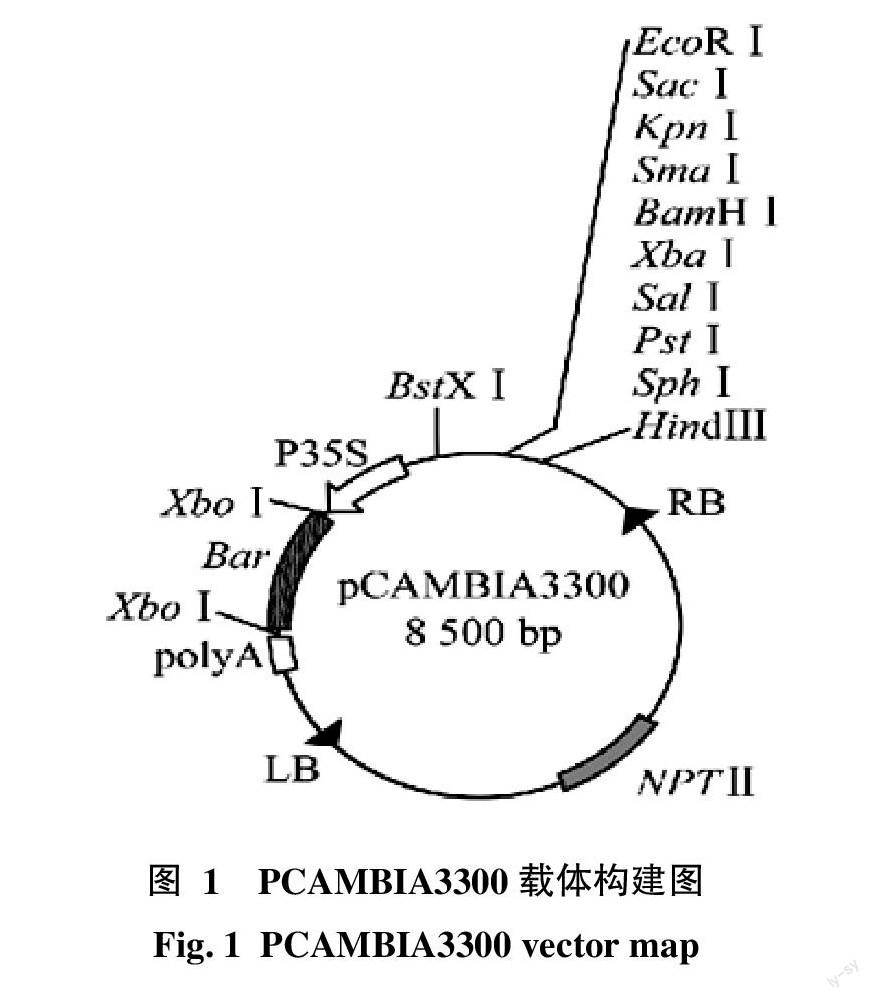
剑麻叶片顶端带刺,田间除草不便;将APX基因插入PCAMBIA3300表达载体(含Bar基因)中(图1),从而得到既抗病又抗除草剂的剑麻植株。
由图2可知,重组pbi121-APX载体经PCR扩增和双酶切验证,结果显示,APX基因已插入到pbi121载体中。由图3可知,重组Pcambia3300-35S-APX-nos载体经PCR扩增和双酶切验证,结果显示,35S-APX-nos片段已插入到Pcambia3300质粒中。
2.2 表达载体转入农杆菌的双酶切验证
提取转化农杆菌的质粒进行双酶切验证,结果见图4,说明该重组表达载体已成功转入到农杆菌EHA105中。
2.3 转化影响因素
2.3.1 预培养时间对转化的影响 由图5可知,预培养2 d时,得到的抗性愈伤率最高。
2.3.2 农杆菌菌液浓度、侵染时间和抗坏血酸对转化的影响 由图6可知,在农杆菌菌液浓度OD值0.5、侵染时间25 min和抗坏血酸50 mg/L时,得到的抗性愈伤率最高。
2.3.3 表面活性剂对转化的影响 由图7可知,当在感染液中加入0.10%的Tween20时,得到的抗性愈伤率最高。
2.3.4 共培养温度对转化的影响 由图8可知,当共培养温度为22 ℃时,抗性愈伤率最高。
2.3.5 共培养时间对转化的影响 由图9可知,当共培养时间为4 d时,得到的抗性愈伤率最高。 2.3.6 干燥处理对转化的影响 由图10可知,当干燥处理为30 min时,得到的抗性愈伤率最高。
2.3.7 滤纸的使用对转化的影响 由图11可知,共培养时,在培养基上加上滤纸可得到较高的抗性愈伤率。
2.4 剑麻的遗传转化 用农杆菌侵染剑麻愈伤100个,结果得到38个抗性愈伤,其转化率为38%;得到抗PPT的小苗51株,经PCR扩增验证,含APX基因的阳性植株有19株,说明APX基因的阳性转化率为37.25%(图12)。
2.5 转基因植株的PCR验证
部分转基因剑麻的PCR验证见图13,结果显示APX基因已转入剑麻中。
3 讨论与结论
已有研究结果表明,外植体进行适当时间的预培养有利于提高外源基因的转化效率[10-12]。共培养是植物转化最关键的时期,T-DNA的转移和整合均在该时期完成[13]。如果共培养时间短,外源基因不能有效的整合到植物中;如果过长,则会因农杆菌的过度生长而导致外植体死亡或后期不能很好的去除农杆菌。农杆菌在侵染外植体时会造成外植体的过敏反应,从而褐化,甚至死亡,在侵染液和共培养基中加入适当浓度的Vc能够有效的降低农杆菌对外植体造成的伤害[14]。在共培养时,在共培养基上加上滤纸能够有效的抑制农杆菌的生长,且有利于后期农杆菌的去除[15-16]。已有研究结果表明,对于剑麻愈伤的遗传转化,外植体预培养3 d、OD600为0.6、侵染10 min时,获得的转化率为23%[9]。本实验在前人的研究基础上,系统的优化了农杆菌介导剑麻遗传转化的条件,从而得到了更高的转化率[9]。
参考文献
[1]张 怡. 水稻OsAPXZ抗坏血酸过氧化物酶基因功能及抗逆性分析[D]. 北京: 中国农业科学院, 2011.
[2] 程林梅,孙 毅, 张丽君. 转抗坏血酸过氧化物酶基因(APX)菊苣抗旱相关生理特性[J]. 西北农业学报, 2013, 22(6): 124-130.
[3] 孙卫红, 陈相燕, 杜 斌,等. 过量表达番茄类囊体膜抗坏血酸过氧化物酶基因(StAPX)提高了烟草种苗的抗氧化能力[J]. 植物生理学报, 2011, 47(6): 613-618.
[4] 孙宏丽. 反义表达基因对植物抗逆能力的影响[D]. 济南: 山东师范大学, 2012.
[5] 蒋 明,张志仙,袁菱婧. 青花菜抗坏血酸过氧化物酶基因BoAPX2的克隆与表达分析[J]. 植物病理学报, 2012, 42(4):374-380.
[6] Sarowar S, Kim E N, Kim Y J, et al. Overexpression of a pepper ascorbate peroxidase-like1 gene in tobacco plants enhances tolerance to oxidative stress and pathogens[J]. Plant Science, 2005, 169(1): 55-63.
[7] Sarowar S, Kim Y J, Kim E N, et al. Constitutive expression of two pathogenesis-related genes in tomato plants enhanced resistance to oomycete pathogen Phytophthora capsici[J]. Plant Science, 2006, 170(1): 7-14.
[8] 杨 峰, 刘巧莲,代真真. 不同基本培养基和外植体对剑麻愈伤组织诱导及分化的影响[J]. 热带作物学报, 2012, 33(3):475-478.
[9] Gao J M, Yang F, Zhang S Q, et al. Expression of a hevein-like gene in transgenic Agave hybrid No.11648 enhances tolerance against zebra stripe disease[J]. Journal of Plant Biotechnology, 2014, 22(1): 1-9.
[10] 吴关庭. 农杆菌介导高羊茅遗传转化体系的建立及CBF耐逆相关基因的导入[D]. 杭州: 浙江大学, 2004.
[11] 刘宏波. 甘蓝型油菜抗病虫基因遗传转化及转基因植株抗性鉴定的研究[D]. 杭州: 浙江大学, 2010.
[12] 朱海生. 草葛乙烯受体反义基因遗传转化的研究[D]. 福州: 福建农林大学, 2008.
[13] 王会强. 根癌农杆菌介导的花青素调节基因Lc-NtAn2转化烟草的研究[D]. 杨凌: 西北农林科技大学, 2013.
[14] 王关林, 方宏筠. 植物基因工程原理与技术[M]. 北京: 科学出版社, 1998.
[15] 陶丽莉. 小麦幼胚农杆菌转化体系优化和HMW-GS基因转化研究[D]. 北京: 中国农业科学院, 2009.
[16] 丁 焱. DFL在甘菊中的转化与表达研究[D]. 北京: 北京林业大学, 2009.

