半夏泻心汤及其拆方对胃电节律失常大鼠胃组织缝隙连接蛋白Cx43表达的影响
李翠等

摘要:目的 探讨半夏泻心汤调节胃运动的配伍规律。方法 选取90只健康SD雄性大鼠,分为正常组10只和模型组80只。复制大鼠胃电节律失常模型,经胃电生理学指标评价后,根据半夏泻心汤的配伍特点,将其拆分为辛开、苦降、甘补、辛开苦降、辛开甘补、苦降甘补组,每组10只。各给药组按相同药物浓度不等体积连续灌胃4周。给药后进行胃电参数分析,采用免疫组化法、RT-PCR检测胃组织Cx43及其mRNA表达。结果 与正常组比较,模型组Cx43及其mRNA表达升高;与模型组比较,各给药组胃电慢波频率变异系数降低,各给药组Cx43及其mRNA表达降低,其中辛开甘补组作用最为显著。结论 半夏泻心汤调节胃运动机制可能与其降低缝隙连接蛋白Cx43及其mRNA表达有关,从而改变紊乱的胃电节律,达到改善胃运动功能的作用。
关键词:半夏泻心汤;Cx43蛋白;缝隙连接;胃运动;大鼠
中图分类号:R285.5 文献标识码:A 文章编号:1005-5304(2015)06-0075-05
胃肠道运动功能紊乱是大多胃肠道疾病的重要临床表现和发病机制,其发病率高。半夏泻心汤出自《伤寒论》,具有降逆止呕、消痞散结的作用。前期研究表明,半夏泻心汤对胃电节律失常大鼠胃壁SCF基因表达水平、胃肌间神经丛c-kit阳性间质细胞(ICC)含量表达均有影响[1]。胃肠神经-ICC-平滑肌细胞(SMC)网络结构和功能的变化对胃肠道动力障碍性疾病有重要的病理生理学意义。在胃肠道中,缝隙连接(GJ)是介导SMC和ICC细胞间电化学信息交流,保证肌肉活动的协调性和同步性的特殊通道。Cx43是构成GJ最重要的连接蛋白,广泛存在于胃肠Cajal与SMC之间。Cx43基因发生突变、数量减少,会影响细胞膜上GJ通道的数量,从而妨碍细胞间信号的传递,导致胃肠道运动功能障碍。本研究以Cx43为切入点,根据半夏泻心汤辛开苦降甘补的配伍特点,按照药味特点与中医病机结合分组的原则,采用析因实验设计研究半夏泻心汤及其拆方对ICC细胞Cx43的影响,进一步揭示半夏泻心汤调节胃运动的分子机制,阐释经方配伍规律。
1 实验材料
1.1 动物
健康4周龄SD雄性大鼠90只,体质量(180±20)g,北京华阜康生物科技股份有限公司,许可证号0309256。所有动物均给予大鼠全价营养颗粒饲料,饲养于北京中医药大学东直门医院屏障动物实验室。
1.2 药物
半夏泻心汤方的药物剂量比例按文献[2]换算。法半夏55.7 g,黄芩、干姜、人参、炙甘草各46.875 g,黄连15.62 g,大枣42 g。根据“法依病机,拆方依法”的研究思路[3],将半夏泻心汤拆分为辛开组(法半夏、干姜)、苦降组(黄芩、黄连)、甘补组(人参、炙甘草、大枣)、辛开苦降组(法半夏、干姜、黄芩、黄连)、辛开甘补组(法半夏、干姜,人参、炙甘草、大枣)及苦降甘补组(黄芩、黄连、人参、炙甘草、大枣)。所有药物均为免煎颗粒,北京康仁堂药业有限公司。
1.3 主要试剂与仪器
4%多聚甲醛,solarbio公司;免疫组化通用试剂盒(鼠/兔)、DAB显色试剂盒,北京中杉金桥生物技术有限公司;一抗Connexin43 Antibody(鼠抗人,单克隆抗体)、二抗goat anti- mouse IgM-HRP,Santa cruz公司;Trizol,Invitrogen公司;氯仿,索莱宝公司;异丙醇,北京益奥明科技有限公司;反转录试剂盒,Promega公司;SYBR Green PCR Master Mix,ABI公司;所有引物均由北京诺赛基因组研究中心有限公司合成。多导生理仪EGG100C(BioPac公司,美国),SPOT software V3.0Ⅱ图像拍摄系统(Diagnostic instruments,美国),LD5-2A离心机(北京京立离心机有限公司),超声匀浆机(Pharmacia Biotech),紫外分光光度仪(Pharmacia,美国),实时荧光定量PCR仪MX3000P(Stratagene,美国)。
2 实验方法
2.1 分组、造模与给药
将大鼠随机分为正常组和模型组。正常组10只,常规饲养。模型组80只,不规则喂养4周,即大鼠每逢单日正常进食、双日禁食,以打乱其正常的饮食节律。自由饮水,水中加入盐酸(每升水加10 mol/L盐酸10 mL),以破坏胃内酸碱环境,制备大鼠胃电节律失常模型[4]。大鼠不规则喂养4周后,参考文献[4]进行胃电生理学评价,分析胃电慢波节律。模型大鼠胃电节律异常,胃动过速、胃动过缓和节律紊乱,与正常组比较有显著差异,提示造模成功。将标记好的80只模型大鼠随机分为模型组、辛开组、苦降组、甘补组、辛开苦降组、辛开甘补组、苦降甘补组、全方组,每组10只。相当于人单位体质量原药材量的10倍,即得大鼠每日喂食用药量。各给药组每日按相同药物浓度不等体积(5 mL/kg)给予相应药液灌胃,每日1次,连续4周。正常组和模型组给予等体积生理盐水灌胃。
2.2 胃电生理学评价
给药4周后,大鼠禁食18 h,腹腔注射3.5%水合氯醛(1 mL/100 g)麻醉,固定后腹部备皮,常规消毒,于剑突下正中切开腹壁1~2 cm,暴露胃窦部,在距幽门0.5 cm处浆膜下埋置一对Ag-AgCl电极,两电极间距3 mm,还原暴露的胃组织,接地电极插入大鼠腿部肌肉处固定。将三股电极连接于多导生理仪上。打开Acqknowledge4.1,胃电横轴时间以1 min为单位,纵轴振幅以2 mV为单位进行胃电记录,每次记录30 min。胃电记录完毕,用2/0缝合线缝合切口,碘伏擦拭。术后大鼠腹腔注射青霉素40万U/(d·只),连续3 d。术后1周取材。胃电记录以每10 min为1个时间段,计算每只大鼠每个时间段的慢波频率以及每只大鼠慢波频率变异系数[4],进行胃电参数分析。
2.3 免疫组织化学法检测胃组织Cx43表达
大鼠禁食18 h后,3.5%水合氯醛(1 mL/100 g)腹腔注射麻醉,背位固定,取出胃组织,生理盐水冲洗干净后,4%多聚甲醛固定。采用SABC免疫组化检测法胃组织Cx43表达,具体步骤按照试剂盒说明书进行。采用SPOT software V3.0Ⅱ图像拍摄系统,将染色后的病理切片在10倍光镜下观察后,在40倍镜下每例标本随机选择肌间神经丛的5个最能反映胃壁全貌的视野,观察Cx43表达分布情况,结果进行半定量分析,检测平均光密度值,计算积分光密度值(IOD)。以细胞质有明确棕色或棕黄色着色而细胞核无着色为阳性表达。
2.4 RT-PCR检测大鼠胃壁Cx43基因表达
取胃组织30 mg,置于冰上,加Trizol匀浆,按照常规操作顺序提取总RNA,紫外分光光度计检测OD260和OD280,计算总RNA的浓度及纯度。取2 μg总RNA,在鸟类成髓细胞瘤反转录酶(AMV)和Oligo(dT)条件下进行反转录,70 ℃×10 min,4 ℃×5 min,42 ℃×30 min,95 ℃×5 min,4 ℃×5 min,获得cDNA。以cDNA为模板进行PCR反应,反应体系为20 μL,含2 μL cDNA,10 μmol/L上下游引物各1 μL,5×SYBR Green PCR Master Mix 10 μL。
根据文献[5]设计引物。Cx43引物序列:上游5'-ACTTCAGCCTCCAAGGAGTTC-3',下游5'-CATGTCTGG GCACCTCTCTTT-3',产物长度80 bp;以GAPDH作为内参照。上游5'-GCTCTCTGCTCCTCC CTGTTCTAGA-3',下游5'-CCGTTCACACCGACCTTCACCAT-3',产物长度95 bp。2条引物扩增效率均为90%~100%。GAPDH、Cx43扩增条件为:95 ℃×5 min预变性;95 ℃×30 s,55 ℃×30 s,72 ℃×30 s,40个循环;95 ℃×1 min,55 ℃×30 s,95 ℃×30 s,1个循环。
每个样品设立3个复孔,取均值。将所得Ct值按照2-ΔΔCt的方法进行均一化处理后进行统计学分析。
3 统计学方法
采用SPSS17.0统计软件进行分析。实验数据用—x±s表示,所有数据剔除随机误差及人为因素导致的过高或过低的测量值,随后进行正态性检验,非正态分布时,采用非参数K个独立样本检验;服从正态分布时,进行方差齐性检验,方差齐时采用方差分析,方差不齐采用非参数检验;各给药组与模型组比较采用Dunnett's T3检验;各给药组之间两两比较采用Tukey's Multiple Comparison Test检验;各给药组之间是否有交互作用采用析因分析。P<0.05表示差异有统计学意义。
4 结果
4.1 半夏泻心汤及其拆方对大鼠胃电慢波频率变异系数的影响
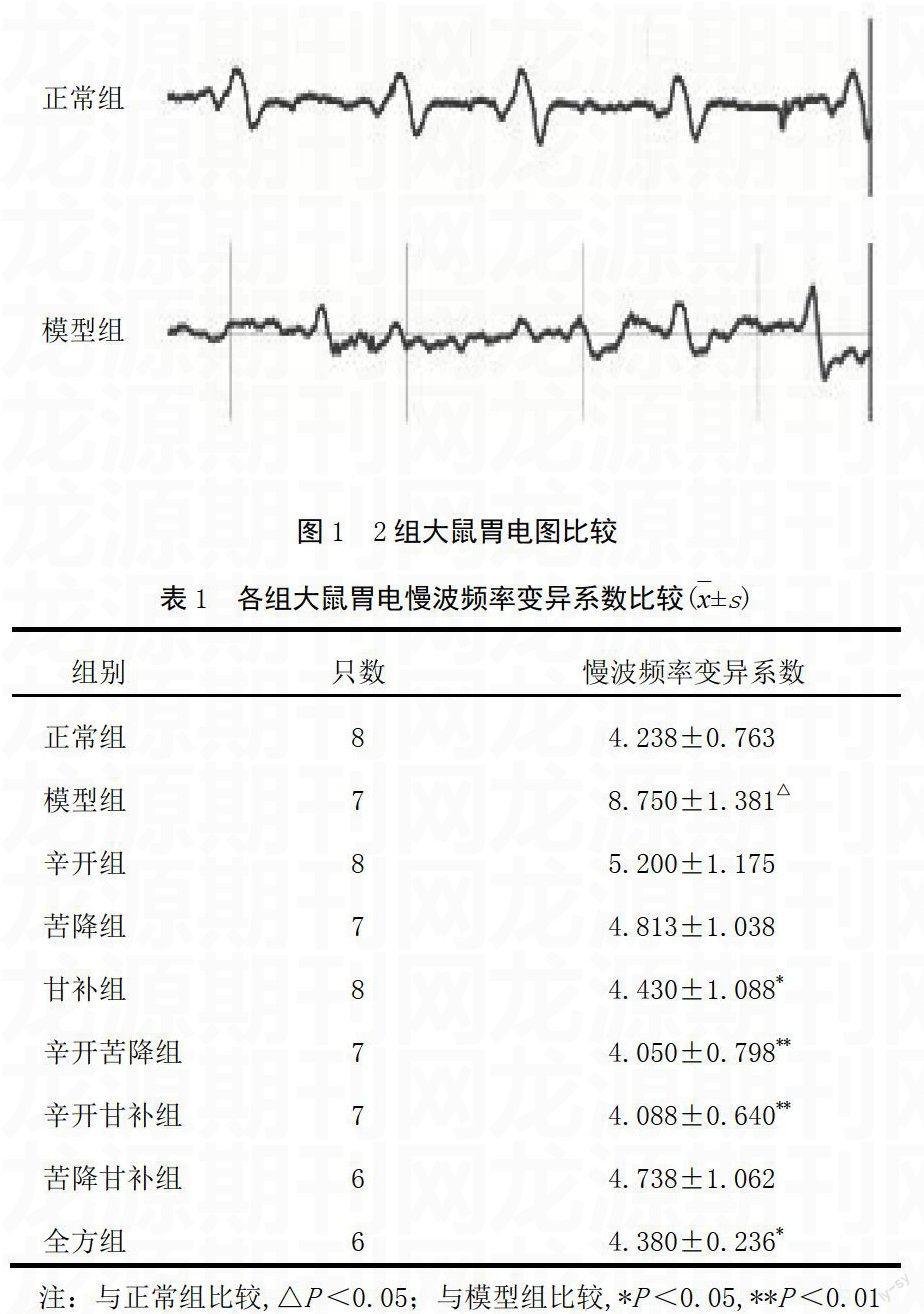
如图1所示,正常组大鼠胃电节律正常,模型组大鼠胃电节律异常,胃动过速或过缓,节律紊乱。模型组大鼠胃电慢波频率变异系数最大,与正常组比较差异有统计学意义(P<0.05),各给药组胃电节律均有不同程度改善,胃电慢波频率变异系数低于模型组,各组慢波频率变异系数为辛开苦降组<辛开甘补组<全方组<甘补组<苦降甘补组<苦降组<辛开组<模型组,但仅全方组、甘补组、辛开苦降组、辛开甘补组与之比较差异有统计学意义(P<0.05,P<0.01),见表1。提示半夏泻心汤及其拆方各组具有不同程度纠正胃电节律失常的作用。
4.2 半夏泻心汤及其拆方对大鼠胃组织Cx43表达的影响
Cx43阳性表达为环形肌层间夹杂的深浅不同的棕黄色着色,Cx43阳性表达水平用IOD表示,IOD值越高其阳性表达水平越高,即Cx43蛋白含量越高。与正常组比较,模型组、各给药组Cx43的棕黄色阳性表达增高,Cx43 IOD值增高,其中模型组肌间神经丛Cx43阳性表达最为密集,且图片显示分布不均匀,并以环形肌之间为多,模型组阳性表达IOD值显著增高(P<0.05)。与模型组比较,各给药组Cx43的棕黄色阳性表达降低,Cx43 IOD值降低。各给药组中,辛开甘补组Cx43表达显著降低,散在分布于肌层间。各组胃组织Cx43阳性表达排序为:辛开甘补组<甘补组<辛开苦降组<辛开组<全方组<苦降甘补组<苦降组<模型组。见表2、图2。
4.3 半夏泻心汤及其拆方对大鼠胃组织Cx43 mRNA表达的影响
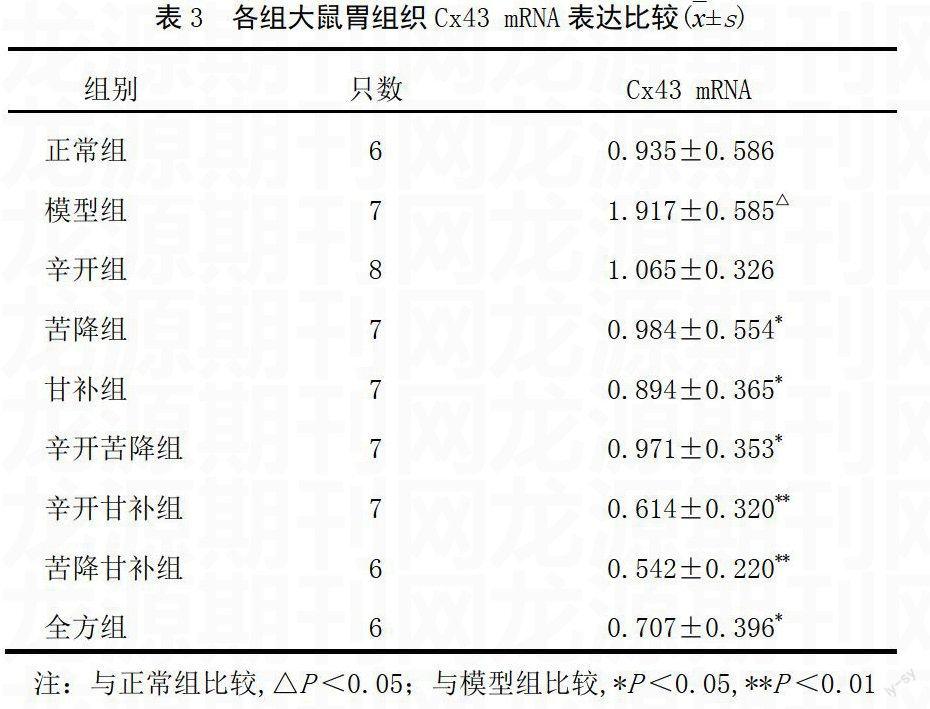
模型组大鼠胃组织Cx43 mRNA表达明显高于正常组(P<0.05);各给药组Cx43 mRNA表达均低于模型组(P<0.001),其中苦降组、甘补组、辛开苦降组、全方组、辛开甘补组、苦降甘补组与之比较,差异有统计学意义(P<0.05,P<0.01)。析因分析结果显示,各给药组间无明显差异,甘补组在全方配伍中起主要作用,各给药组间不存在交互作用。见表3。
5 讨论
胃运动功能障碍可归属于中医“痞证”范畴,半夏泻心汤为治疗痞证的经典方,研究其调节胃运动的分子机制对进一步阐明胃肠道运动功能障碍机制具有重要意义。对胃电节律失常引起的胃运动功能亢进,半夏泻心汤及其拆方是否有调节作用及其相应作用机制,目前尚未见相关文献研究。胃电节律的改变与Cajal间质细胞表达的减少或增加密切相关,胃壁Cajal数量表达是否正常对调节胃运动至关重要。ICC、胃肠神经以及SMC间可形成网络状连接。胃肠神经-ICC-平滑肌网络是胃肠动力的基本功能单位,可以传导电兴奋,介导神经递质的产生和调节,对揭示多种胃肠道功能障碍性疾病的发病机制具有重要作用,这种细胞网络即通过GJ实现。
Cx43是构成GJ最重要的连接蛋白,与胃肠运动有密切关系。修复ICC和促进ICC的再生能够上调Cx43蛋白的表达,增加神经纤维的数目,从而保持胃肠神经-ICC-SMC网络结构的完整,恢复胃肠动力[6]。有研究表明,糖尿病胃轻瘫大鼠胃纵肌层内ICC分布减少,环形肌内Cx43的表达下降,而补充胰岛素可逆转糖尿病大鼠ICC、Cx43病变从而改善胃动力障碍[7],提示Cx43表达增高对胃运动有促进作用。因此,通过探究Cx43在胃肠运动障碍性疾病中的作用机制,对进一步揭示半夏泻心汤治疗胃电节律紊乱的作用机制,探究经方配伍规律意义较大。
本实验结果表明,模型组与正常组比较慢波频率变异系数显著增高,各给药组与模型组比较慢波频率变异系数有不同程度降低,提示半夏泻心汤及其各拆方组具有调节胃电节律的作用。电节律紊乱的模型组其Cx43在胃组织上的分布表达显著高于正常组,且分布不均匀,提示胃电节律紊乱引起的胃动过速可能与Cx43异常增高表达有密切关联。半定量分析结果显示,各给药组均对Cx43表达量有不同程度降低作用,辛开甘补组Cx43阳性表达显著降低。各给药组与模型组比较,Cx43阳性表达均有不同程度的降低,提示各给药组对胃组织缝隙连接Cx43的表达分布均具有不同程度降低作用。
本实验结果还表明,半夏泻心汤及其拆方干预可以影响Cx43 mRNA的表达,各给药组都可以有效降低胃组织Cx43 mRNA的异常增高表达,其中苦降甘补组对Cx43 mRNA的抑制最显著,提示半夏泻心汤组方抑制Cx43 mRNA表达,主要通过苦降药物与甘补药物的协同配伍来实现。相关研究表明,采用苦寒泻下法建立的大鼠脾气虚模型,胃肌层Cx43表达降低[8],也提示苦泻药物对Cx43的表达有抑制作用。综合上述结果,模型组慢波频率变异系数增高,Cx43表达增强,基于Cx43表达增高对胃肠运动有促进作用。因此,我们推测Cx43表达异常增高会诱导胃电节律紊乱引起胃动过速,从而导致胃运动功能亢进。半夏泻心汤通过辛开、苦降、甘补药物协同配伍作用从而降低Cx43的表达。由此我们推测半夏泻心汤方不仅能治疗胃动过缓导致胃运动功能障碍的心下痞证,还能通过抑制Cx43过表达有效抑制胃电节律紊乱引起的胃动过速,从而改善胃运动功能亢进症状,对胃运动功能起双向调节的作用。各拆方组间协同作用机制还有待进一步研究。
参考文献:
[1] 李宇航,王庆国,陈萌,等.半夏泻心汤对胃电节律失常大鼠胃壁SCF基因表达水平的影响[J].中医药学刊,2003,21(11):1825-1826.
[2] 柯雪帆,赵章忠,张玉萍,等.《伤寒论》和《金匮要略》中的药物剂量问题[J].上海中药杂志,1983,20(12):36-38.
[3] 李宇航,王庆国,牛欣,等.半夏泻心汤配伍意义的拆方研究——调节胃分泌作用的实验观察[J].北京中医药大学学报,1999,22(5):49-52.
[4] 李宇航,王庆国,陈萌,等.半夏泻心汤及其拆方对胃电节律失常大鼠胃电慢波频率变异系数的影响[J].中国中西医结合杂志,2006,26(S1):53-55.
[5] Rachdi L, El Ghazi L, Bemex F, et al. Expression of the receptor tyrosine kinase kit in mature β-action and in the pancreas in development[J]. Diabetes,2001,50(9):2021-2028.
[6] 郭璇,谭华梁,王小娟,等.舒胃汤对功能性消化不良大鼠Cx43蛋白的分布及Cajal间质细胞的修复与再生的影响[J].中国中西医结合消化杂志,2014,22(11):652-661.
[7] 吴泉霞,赵劢,谭至柔,等.糖尿病胃轻瘫大鼠胃窦Cajal间质细胞和缝隙连接蛋白43的变化及胰岛素的干预作用[J].世界华人消化杂志,2014, 22(29):4399-4405.
[8] 李冉,齐清会,谢明征,等.香砂六君子汤对脾气虚证大鼠胃Cajal间质细胞、缝隙连接损伤的修复作用研究[J].中国中西医结合杂志,2014, 34(10):1216-1219.
(收稿日期:2015-01-07)
(修回日期:2015-02-05;编辑:华强)

