MnO2空心微球的制备及其对KClO3的催化研究
穆啸天 李军 王硕博

[摘 要] MnO2是实验室KClO3制取氧气常用的催化剂。空心微球具有大比表面、多孔结构,有助于吸附和传质。基于此,在实验中自制MnO2空心微球,利用SEM研究微球的结构,利用热重研究微球对KClO3的催化氧化。
[关键词] 空心微球 催化分解 二氧化锰
[中图分类号] G633.8 [文献标识码] A [文章编号] 1674 6058(2015)20 0094
实验室中常用KClO3的催化分解来制取氧气。若不存在催化剂,氯酸钾在356℃时熔化,在395℃时开始分解,在实验室中想借助于酒精灯很难实现氧气的制备。MnO2是重要的催化剂,但是MnO2是如何催化氯酸钾分解的呢?
本文利用“碳酸锰氧化—盐酸刻蚀法”制备了空心二氧化锰微球,并从理论和实验角度初步研究了空心二氧化锰对氯酸钾的分解。
一、理论分析
过渡金属氧化物做催化剂,d电子数目起到很关键的作用,d电子层为半充满或接近半充满状态时催化能力最强,d电子层为充满(全空)或接近全充满(全空)状态时催化能力最弱。北京理工大学的张凤等通过量子化学进行了计算。锰的价电子构型为3d54s2,3d处于半充满状态,4s为全充满状态,而4p、4d均为全空,有能量较低的空轨道,易形成d2sp3杂化轨道,能够接受电子对形成配位键。另外,由于氧是较活泼的非金属元素,对电子的吸引力较强,使锰原子的电子强烈偏移而处于接近失去的状态形成Mn4+,ClO-3和两个O-2与Mn4+配位,但由于ClO-3体积较大而Mn4+体积较小,由于空间位阻和电子排斥的原因,无法形成稳定的结构,这一络合物极不稳定,导致Cl-O键受极化作用易断。基于上述原因,MnO2的引入促使了中间体的形成,降低了活化能,加快了反应速率。
二、实验部分
1.MnO2空心球的制备
将制备的MnCO3微球用0.016M的K2MnO4氧化10min,离心分离、干燥后在马弗炉中煅烧至803K,主要发生的反应为:MnCO3+1/2O2→MnO2+CO2。
图1是MnO2空心微球的SEM照片,从电镜照片可看出微球具有较好的均匀性,尺寸在4μm左右,通过b图可看到空心结构。
2.MnO2对KClO3的催化研究
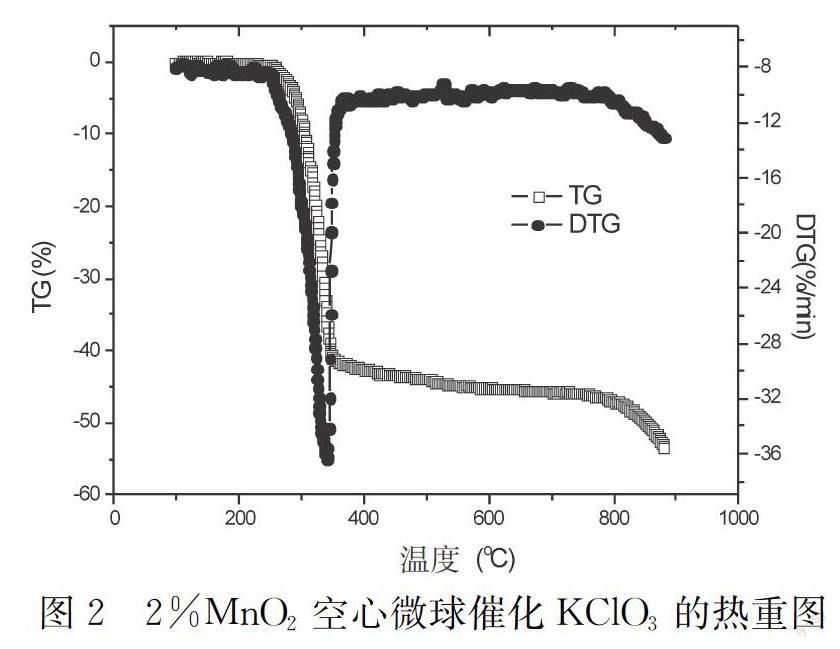
MnCO3分解产生CO2,使产生的MnO2不仅空心且存在空隙。多孔和空心结构增大了催化剂的比表面积并能进行有效的传质。将0.1gKClO3和2%的MnO2空心微球混匀后研磨,分别在TA公司生产的Q50热分析仪上进行热重分析。升温速率10K·min-1,氧气气氛下,流速10mL·min-1。
由以上数据可知,空心MnO2催化的KClO3热分解起始温度为260℃,比纯KClO3的热分解起始温度低135℃,在350℃时TG曲线出现平台,失重约为40%,这和氧在氯酸钾中所占百分含量的理论值39.2%非常接近,而产生失重的原因也只能用放氧来解释。当温度继续升高到800℃以上时,重量减小,主要因为氯化钾的挥发导致。
三、结论
锰作为过渡元素具有较低能量的空的轨道,可以接受ClO-3和两个O-2的配位形成八面体的过渡络合物,从而降低KClO3热分解的活化能。本文通过自制空心微球从理论和实验两个角度对微球的催化进行了探讨,希望能够引导学生深入了解KClO3的分解及MnO2催化机理。
[ 参 考 文 献 ]
[1] 张凤,汪佩兰.氯酸钾热分解反应机理的量子化学研究[J].北京化工大学学报2008,35(6):30-34.
[2] 张杰,唐定国,刘浩文,杨汉民.碳酸锰高温分解制备三氧化二锰研究[J].山东化工,2013,42(4):1-4.
(责任编辑 罗 艳)

