免疫球蛋白亚型在膝骨关节炎患者血清中的变化及相关性分析
阮丽萍等
【摘 要】目的:观察了解膝骨关节炎患者血清免疫球蛋白亚型的变化及其影响因素。方法:选取膝骨关节炎患者60例(膝骨关节炎组)及健康体检者20例(正常对照组),采用酶联免疫吸附法(ELISA)检测膝骨关节炎患者血清IgG1、IgG2、IgG3、IgG4,并与年龄、病程、膝骨关节炎严重程度指数(Lequesne MG)及红细胞沉降率、超敏C-反应蛋白等实验室指标进行相关性分析。结果:①膝骨关节炎患者血清IgG1、IgG2、IgG3水平较正常对照组升高(P < 0.05);②相关性分析示,膝骨关节炎患者免疫球蛋白亚型与病程、年龄无明显相关性;IgG1、IgG3、IgG4与症状量化积分呈正相关(P < 0.05或P < 0.01),IgG1、IgG4与Lequesne MG呈正相关(P < 0.05);IgG1与IgA、IgM呈正相关(P < 0.05),IgG2与超敏C-反应蛋白、IgM呈正相关(P < 0.01或P < 0.05),IgG4与IgM呈正相关(P < 0.01)。结论:免疫球蛋白亚型在膝骨关节炎患者血清中表达升高,免疫球蛋白的表达失调参与了膝骨关节炎发病过程。
【关键词】 骨关节炎,膝;免疫球蛋白亚型;血清;相关性分析
doi:10.3969/j.issn.2095-4174.2015.07.002
Changes of Immunoglobulin Subtypes in Patients with Knee Osteoarthritis and Correlation Analysis
RUAN Li-ping,LIU Jian,WAN Lei,WANG Ya-li,YE Wen-fang
【ABSTRACT】Objective:To observe the changes of immunoglobulin subtypes in patients with knee osteoarthritis and their influence factors.Methods:60 cases of knee osteoarthritis(the knee osteoarthritis group)and 20 healthy persons(the normal control group)were chosen,using Enzyme Linked Immunosorbent Assay(ELISA)to detect IgG1,IgG2,IgG3 and IgG4 and analyze their correlation with age,severe degree index (Lequesne MG),erythrocyte sedimentation rate and supersensitive C-reactive protein.Results:①Compared with the normal control group,levels of IgG1,IgG2 and IgG3 in patients with knee osteoarthritis increased(P < 0.05);
②Correlation analysis showed that the immunoglobulin subtypes in patients with knee osteoarthritis had no significant correlation with the course of disease and age.IgG1,IgG3 and IgG4 were positively correlated with the quantifying score of symptom(P < 0.05 or P < 0.01),and IgG1 and IgG4 was positively correlated with Lequesne MG(P < 0.05);IgG1 was positively correlated with IgA and IgM(P < 0.05) and IgG2 was positively correlated with supersensitive C-reactive protein and IgM(P < 0.01,P < 0.05),and IgG4 was positively correlated with IgM(P < 0.01).Conclusion:The expression of immunoglobulin increased in patients with knee osteoarthritis,and its dysfunction was involved in the pathogenesis.
【Keywords】 osteoarthritis,knee;
immunoglobulin subtypes;serum;correlation analysis
骨关节炎(osteoarthritis,OA)是一种最常见的关节疾病,全球约有3.35亿患者,而中国患者总数已超过1.5亿[1],OA的核心病变是关节软骨退变。在40岁以上人群中,膝骨关节炎(knee osteoarthritis,KOA)总患病率为15.6%[2]。
目前研究认为,OA是力学与生物学因素共同作用的结果,主要涉及的机制是关节软骨、细胞外基质、软骨下骨的合成和降解的紊乱以及全身及局部的免疫反应[3-4]。这个过程涉及到全身及局部的体液免疫和细胞免疫[5-6]。免疫球蛋
白G(IgG)在临床上有一定的价值,其升高与病程和疾病的严重程度有关。既往研究也发现,IgG在OA中有升高的趋势,且与部分炎症指标及抗体存在一定的相关性,表明体液免疫参与了OA的发病过程。本文旨在通过观察OA患者免疫球蛋白亚型的表达以及外周血免疫球蛋白及红细胞沉降率(ESR)等其他炎症指标的表达并进行相关性分析,从而初步探讨免疫球蛋白亚型在OA发病中的
机制。
1 临床资料
1.1 一般资料 选取2014年1月至2014年8月在安徽中医药大学第一附属医院风湿免疫科就诊的
住院KOA患者60例,男18例,女42例;年龄40~75岁,平均(60.26±11.21)岁;病程0.1~30年,
平均(6.70±5.43)年。同时期体检中心的健康体检者20例为正常对照组,男6例,女14例;年龄42~73岁,平均(58.34±13.52)岁。两组在性别、年龄等方面比较,差异无统计学意义(P > 0.05),具有可比性。
1.2 诊断标准 参照2003年中华医学会风湿病学分会起草的《骨关节炎诊疗指南(草案)》诊断
标准[7]。
1.3 纳入标准 ①符合上述诊断标准;②患者均签署知情同意书。
1.4 排除标准 ①合并有造血系统等严重疾病的患者;②合并有类风湿关节炎或其他骨关节系统疾病的患者;③年龄 < 40岁,> 75岁的患者;④妊娠或哺乳期妇女;⑤精神病患者或不能配合治疗的患者;⑥研究者认为其他不宜进行此项临床试验的受试者。
1.5 试验材料 人免疫球蛋白G1(IgG1)、人免疫球蛋白G2(IgG2)、人免疫球蛋白G3(IgG3)、人免疫球蛋白G4(IgG4)(批号:E-13085、E-
13086、E-13087、E-11731)。
1.6 设 备 酶标仪(深圳雷杜生命科学股份有限公司,RT6000);漩涡混合器(其林贝尔仪器制造公司,G-L88B);移液器0.5~10 ?L、200 ?L、100 ?L(eppendorf);排枪50~300 ?L(eppendorf);电热恒温箱(上海三发科学仪器有限公司,DNP-9052BS-Ⅲ);日立7060型全自动生化分析仪。
2 方 法
2.1 采用酶联免疫吸附法(ELISA)检测IgG1、IgG2、IgG3、IgG4 具体流程如下:①向已包被有特异抗体的塑料板凹孔内加50 ?L血清;②加50 ?L生物素标记的第二抗体,室温下孵育1~2 h,
用洗板机洗3次;③加100 ?L链亲合素标记的辣根过氧化物酶,室温下孵育0.5~1 h,用洗板机洗
3次;④加100 ?L终止液,室温下孵育0.5~1 h;
⑤用酶标仪测量光密度,换算为抗原的含量。
2.2 超敏C-反应蛋白(hs-CRP)、ESR测定 hs-CRP采用日立7060型全自动生化分析仪进行测定;ESR采用魏氏法测定。
2.3 KOA严重程度指数(Lequesne MG)[8] 评分分组原则(轻度1~4分、中度5~7分、重度8分以上),分值越高,表示病情越重。
2.4 统计学方法 采用SPSS 17.0软件进行统计分析。计量资料以表示,两组间比较采用独立样本t检验,正态性检验不符合条件资料采用秩和检验,指标间相关性采用Spearman分析。以
P < 0.05为差异有统计学意义。
3 结 果
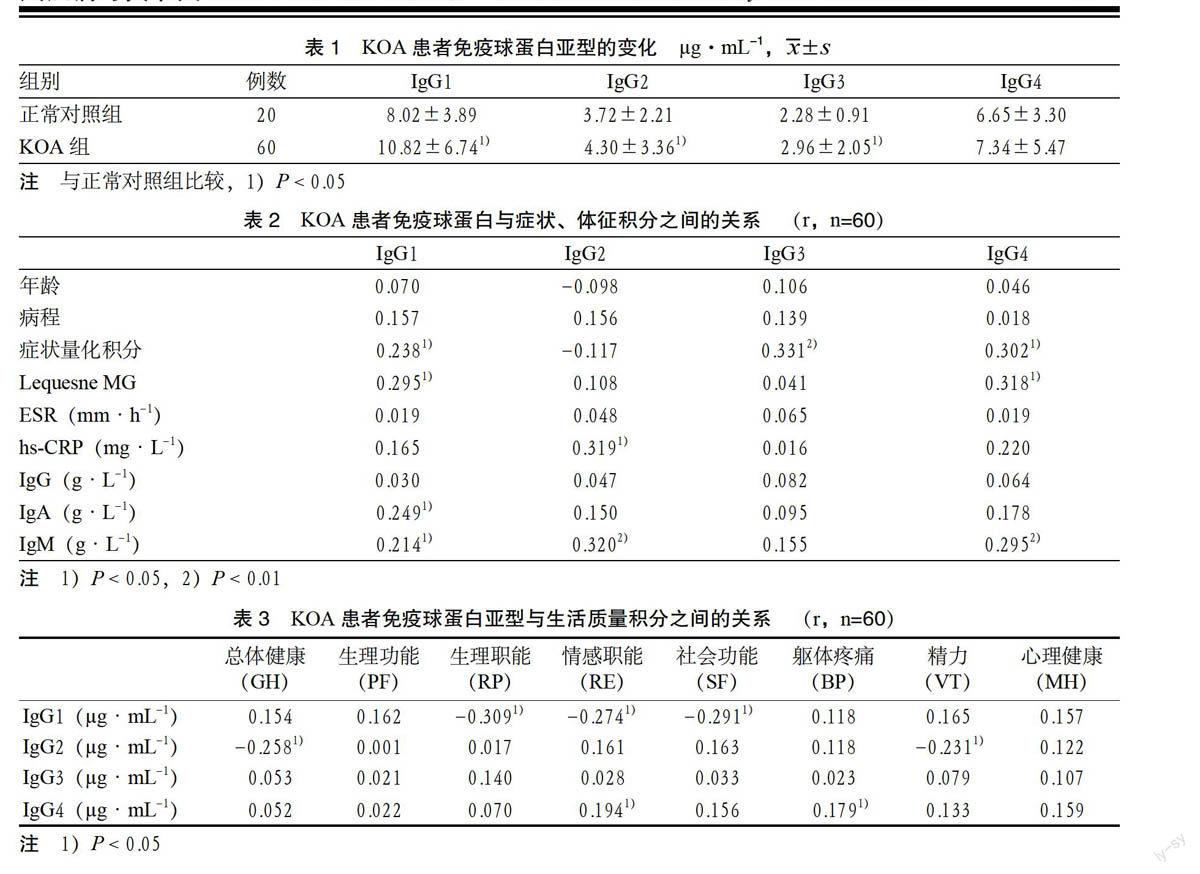
3.1 KOA患者免疫球蛋白亚型的变化 与正常对照组比较,KOA组患者IgG1、IgG2、IgG3水平升高,差异有统计学意义(P < 0.05),IgG4水平亦升高,但差异无统计学意义(P > 0.05)。见表1。
3.2 KOA患者免疫球蛋白亚型与症状体征、积分之间的关系 KOA患者免疫球蛋白亚型与病程、年龄无明显相关性;IgG1、IgG3、IgG4与症状量化积分呈正相关(P < 0.05或P < 0.01),IgG1、IgG4与Lequesne MG呈正相关(P < 0.05),IgG1与IgA、IgM呈正相关(P < 0.05),IgG2与hs-CRP、
IgM呈正相关(P < 0.01或P < 0.05),IgG3与IgA、IgM、IgG、ESR、hs-CRP无明显相关性,IgG4与IgM呈正相关(P < 0.01)。见表2。
3.3 KOA患者免疫球蛋白亚型与生活质量积分之间的关系 相关性分析显示,IgG1与生理职能(RP)、情感职能(RE)、社会功能(SF)呈负相关(P < 0.05),IgG2与总体健康(GH)、精力(VT)负相关(P < 0.05),IgG3与各维度无明显相关性,IgG4与情感职能(RE)、躯体疼痛(BP)呈正相关(P < 0.05)。见表3。
4 讨 论
本研究结果显示,与正常对照组比较,KOA患者血清IgG1、IgG2、IgG3水平升高(P < 0.05),说明在KOA患者中,确实存在着免疫球蛋白的升高,以及体液免疫的亢进。
相关性分析显示,KOA患者免疫球蛋白亚型与病程、年龄无明显相关性。说明免疫球蛋白的升高以及免疫球蛋白亚型的分化与病程、年龄无明显的关系,可能只与疾病的进程以及机体的免疫状态有关。
免疫球蛋白是指具有抗体活性或化学结构与抗体相似的球蛋白[9]。免疫球蛋白的基本结构是四条肤链的对称结构,包括两条相同的重链(heavy chain)及两条相同的轻链(light chain)[10]。一般将人血清中的蛋白分为白蛋白,α1、α2、β、γ球蛋白5种,正常情况下各蛋白均占有一定的比例。在人体出现免疫紊乱时,各球蛋白作为免疫过程的重要参与者比例升高,从而降低了白蛋白含量,而总蛋白水平与IgG、IgA水平呈正相关。根据免疫球蛋白重链C区所含的抗原表位不同,免疫球蛋白分为5类,即IgG、IgA、IgM、IgD、IgE。在风湿性疾病中临床常监测的主要有IgG、IgA、IgM,而其中以IgG的变化较为显著。免疫球蛋白水平是机体体液免疫的重要衡量指标。
IgG是一种糖蛋白,在血清中所占比例最高,IgG的特点是产生迟、维持久。依据其糖链的不同,分为IgG1-4型。而不同的糖链结构对免疫球蛋白的生理作用及特性影响较大。其“双天线”末端都具有半乳糖称为IgG2型,缺失一个称为IgG1型,两个都缺失称为IgG0型。其中IgG0型在类风湿关节炎的致病中研究较多,主要表现为量的增加和对Fc片段结合能力的下降。目前,对于OA免疫球蛋白的研究尚少,而在对免疫球蛋白的相关研究认为,IgG糖链结构的变化使IgG自身成为免疫中的异己成分被识别,与抗体结合形成免疫复合物,沉积于关节滑膜、软骨,刺激活化补体,促发一系列的免疫反应,产生多种细胞因子破坏侵蚀关节软骨,刺激骨质的增生。
本研究中相关分析亦显示,各系免疫球蛋白与不同炎性指标存在不同程度相关。其中hs-CRP是由肝脏合成的一种急性时相反应蛋白,在组织损伤或炎症反应时升高,具有激活补体促进吞噬的作用。通过对OA中B细胞的无性分析发现,这些B细胞的激活是抗原刺激趋使,而浸润B细胞的单克隆及抗原驱动的免疫反应在OA的病理过程中发挥作用[11-12]。同时,针对滑液蛋白骨桥蛋白的升高,通过蛋白质组学的方法,Xiang等[13]发现了一种TPI,一种在OA中特异性较高的抗原抗体;其他还有马OA模型以及狗OA模型中发现的抗体[14]。以上研究表明,针对关节软骨的自身免疫抗体可能是OA发病的关键机制,OA体液免疫的变化可能与关节软骨异常代谢过程中特殊蛋白的代谢暴露有关,其中涉及细胞免疫及体液免疫整个免疫系统的交叉参与。
1985年有日本学者发现了在RA中IgG的Fc区糖链的异常,提出了“糖病理学”的概念。因此在KOA中,也可能涉及免疫球蛋白水平及亚型的异常。本组研究提示,在OA患者中IgG1、IgG2、IgG3的变化较为显著,IgG4无明显变化。在OA的研究中,有关免疫球蛋白变化的研究较少,本组研究为入门探索性研究,对于免疫球蛋白变化的机理及影响尚需进一步深入探讨。
5 参考文献
[1] Liu Y, Wang YF. The economics of osteoarthritis[J].Chin J Osteoporons, 2011, 17(2): 181-184.
[2] Goldring MB,Goldring SR.Osteoarthritis[J].J Cell Physiol,2007,213(3):626-634.
[3] Nicodemus GD,Bryant SJ.The role of hydrogel structure and dynamic loading on chondrocyte gene expression and matrix formation[J].J Biomech,2008,41(7): 1528-1536.
[4] 中华中医药学会.骨性关节炎[J].风湿病与关节炎,
2013,2(2):71-72.
[5] 程园园,刘健,万磊,等.新风胶囊对膝骨关节炎患者B、T淋巴细胞衰减因子及氧化应激的影响[J]. 免疫学杂志,2013,29(5): 416-421.
[6] Shen PC,Wu CL,Jou IM,et al.T helper cells promote disease progression of osteoarthritis by inducing macrophage inflammatory protein-1γ[J].Osteoarthritis Cartilage, 2011,19(6): 728-736.
[7] 中华医学会风湿病学分会.骨关节炎诊治指南
(草案)[J].中华风湿病学杂志,2003,7(11):
702-704.
[8] Lequesne MG,Samsons M.Indices of severity in osteoarthritis for weight bearing joints[J].J Rheumatol Suppl,1991(27):16-18.
[9] 梁晓南.蛋白质组学在骨关节疾病研究中的应用[J].中医矫行外科杂志,2008,16(19):1480-1482.
[10] 陈瑞强,曾春,王昆,等.膝关节骨关节炎患者与正常人群的血清差异表达蛋白[J].中山大学学报:医学科学版,2009,30(3):308-312.
[11] Shiokawa S,Matsumoto N,Nishimura J.Clonal analysis of B cells in the osteoarthritis synovium[J].Ann Rheum Dis,2001,60(8):802-805.
[12] Henley TM,Kovesdi D,Turner M.B-cell responses to B-cell activation factor of the TNF family(BAFF) are impaired in the absence of PI3K delta[J].Eur J Immunol,2008,38(12):3543-3548.
[13] Xiang Y,Sekine T,Nakamura H,et al.Proteomic surveillance of autoimmunity in osteoarthritis:identification of triosephosphate isomerase as an autoantigen in patients with osteoarthritis[J].Arthritis Rheum,2004,50(5):1511-1521.
[14] Saitoh T,Akira S.Regulation of innate immune responses by autophagy-related proteins[J].J Cell Biol,2010,189(6):925-935.
收稿日期:2015-05-11;修回日期:2015-06-14

