辛伐他汀对高脂血症大鼠胸主动脉壁白介素-2、RANTES和趋化因子受体1表达的影响
张哲莹 张 楠 高建芝 王淑秀
(新乡医学院病理教研室,河南 新乡 453003)
高脂血症是动脉粥样硬化(AS)的主要危险因素之一。单核细胞黏附于血管壁并进入内皮下形成泡沫细胞是AS发生的重要事件。单核细胞的迁移主要由趋化因子介导〔1〕。依赖正常T细胞激活表达和分泌的因子RANTES属于CC型趋化因子,对白有趋化和激活作用,多种细胞类型均可分泌该因子,如内皮细胞、平滑肌细胞、活化的 T细胞、巨噬细胞和血小板〔2~4〕。趋化因子的作用均与其相应受体的表达密切相关,其生物活性由靶细胞表面相应的受体介导。CC型趋化因子的受体中,趋化因子受体1(CCR1)和 RANTES的亲和力较高〔5〕。对于高脂血症能否诱导AS病灶平滑肌细胞表达较高水平的RANTES及CCR1,国内外尚无相关报道。白介素-2(IL-2)主要由T细胞产生。IL-2可以增强CC型趋化因子RANTES、MIP-1α及其受体CCR-1的表达,促进炎症的发生〔6〕,但在高脂血症形成AS过程中IL-2是否也起着重要作用还不清楚。本文我们观察AS病灶中IL-2、RANTES和CCR-1的表达情况及辛伐他汀对其表达的影响。
1 材料与方法
1.1 材料与试剂 清洁级健康雄性SD大鼠30只,体重(200±20)g,由河南省实验动物中心提供(合格证号:SC3K豫2005-0001)。IL-2兔抗鼠多克隆抗体(工作浓度1∶200)、RANTES(工作浓度1∶100)兔抗鼠多克隆抗体、CCR-1(工作浓度1∶100)兔抗鼠多克隆抗体、即用型免疫组化试剂盒SA-1022、DAB显色剂均购自武汉博士德生物工程有限公司。其他试剂均为国产分析纯。Trizol RNA提取试剂盒购自美国Promega公司,RT-PCR试剂盒及PCR引物购自上海生工生物工程有限公司。
1.2 实验分组 30只SD大鼠随机分为对照组、高脂饮食组和辛伐他汀组,每组10只。对照组用普通饲料喂养;高脂饮食组用高脂饲料喂养(高脂饲料成分:普通饲料65%,猪油12%,蔗糖5%,奶粉5%,鸡蛋10%,麻油1%,食盐2%)。辛伐他汀组在采用高脂饮食组饲料喂养4 w后,每天以5 mg/kg的辛伐他汀灌胃,并继续给予高脂饮食组饲料。
1.3 HE染色 动物心脏取血后,迅速取其胸主动脉约1 cm立即投入新鲜配置的中性福尔马林固定液中固定24 h。脱水,透明,浸蜡,包埋,并贴上相应组的标签。所有蜡块连续切片(厚度4μm),HE染色后观察主动脉病理形态学变化。
1.4 免疫组织化学染色 按照试剂说明书进行染色。阴性对照组以磷酸盐缓冲液(PBS)代替一抗,其余步骤相同。RANTES和CCR1蛋白表达阳性结果均为细胞质内出现粗细不均的棕黄色或棕褐色颗粒。每张切片在200倍光学显微镜下随机选取3个视野测RANTES、CCR1的平均灰度值。
1.5 RT-PCR检测 应用TRIzol试剂提取血管平滑肌组织总RNA。按照逆转录试剂盒说明进行逆转录和PCR扩增。RANTES引物序列:正链为 5’CATCCCTCACCGTCATC 3’,负链为5’GCTCATCTCCAAATAGTTG 3’,PCR 扩 增 产 物 长 度 为257 bp。CCR1引物序列:正链为5’GGGAGTTCACTCACCATACCTGTAG 3’,负链为 5’GGTCCAGAGGAGGAAGAATAGAAG 3’,PCR扩增产物长度为223 bp。IL-2引物序列:正链为5'TTGCACTGACGCTTGTCCTCCTTGTCAACA 3',负链为 5'CCATCTCCTCAGAAATTCCACCACAGTTGC 3',PCR扩增产物长度为398 bp。内参β-actin引物序列:正链为 5’CTTTTGTGCCTTGATAGTTC3’,负链为 5’GAGTCCTTCTGACCCATAC 3’,PCR 扩增产物长度为265 bp。PCR产物用2.0%琼脂糖凝胶电泳,紫外灯下摄片,用Syngene公司图像分析系统进行图像分析,以各组目的基因与β-actin基因扩增条带积分吸光度值的比值作为各指标mRNA相对表达量。
1.6 统计学处理 采用SPSS12.0统计软件行单因素方差分析及两两比较SNK-q检验。
2 结果
2.1 大鼠血脂浓度 高脂饮食组大鼠血清总胆固醇(TC)、甘油三酯(TG)含量明显高于对照组和辛伐他汀组(P<0.01)。见表1。

表1 各组大鼠血清TC和TG比较(n=10,x±s,mmol/L)
2.2 HE染色显示 对照组胸主动脉内膜光滑,内皮细胞排列整齐。高脂饮食组局部可见大鼠主动脉内膜损伤,内皮细胞坏死脱落,中膜平滑肌细胞排列紊乱,内膜下可见泡沫细胞(图1)。辛伐他汀组介于对照组和高脂饮食组之间。

图1 SD大鼠胸主动脉病理组织学观察(HE,×400)
2.3 大鼠主动脉壁细胞RANTES蛋白表达 RANTES蛋白的阳性表达呈粗细不均匀的棕黄色颗粒,局限于细胞质。RANTES蛋白在高脂饮食组表达较强,显著高于对照组(P<0.01)和辛伐他汀组(P<0.05)(表2,图2)。

表2 各组大鼠胸主动脉壁RANTES、CCR-1和IL-2蛋白表达(平均灰度值,x±s,n=10)
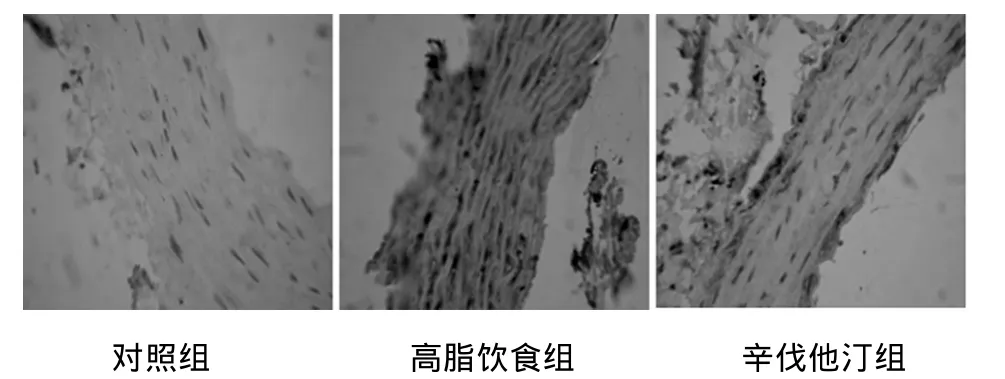
图2 SD大鼠胸主动脉壁RANTES蛋白的表达(SABC,×400)
2.4 大鼠主动脉壁细胞CCR1蛋白表达 CCR1蛋白的阳性表达呈粗细不均的棕黄色颗粒,局限于细胞质。CCR1蛋白在高脂饮食组的表达显著高于正常对照组(P<0.01)和辛伐他汀治疗组(P<0.05)(表2,图3)。
2.5 大鼠主动脉壁细胞IL-2蛋白表达 IL-2蛋白阳性染色为细胞质或细胞膜出现棕黄色颗粒。IL-2蛋白在高脂饮食组的表达显著高于对照组(P<0.01)和辛伐他汀组(P<0.05)(表2,图4)。
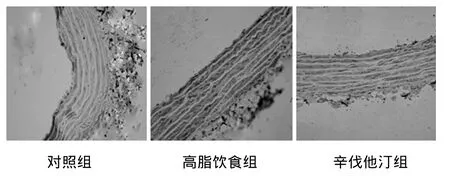
图3 SD大鼠胸主动脉壁CCR-1蛋白的表达(SABC,×400)
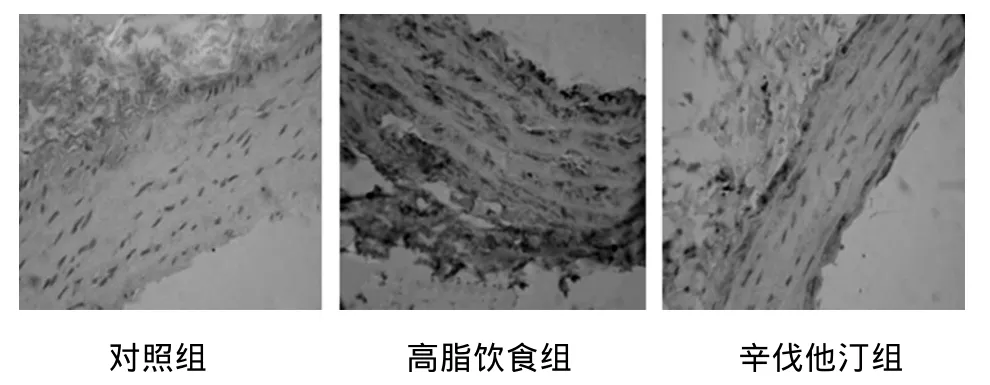
图4 SD大鼠胸主动脉壁IL-2蛋白的表达(SABC,×400)
2.6 大鼠动脉壁中RANTES mRNA表达 RANTESmRNA在高脂饮食组的表达显著高于对照组(P<0.01)和辛伐他汀组(P<0.05)(表3,图5)。
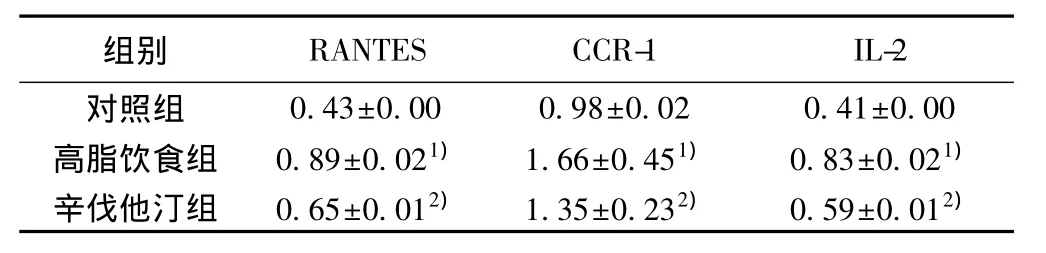
表3 各组大鼠主动脉壁中RANTES、CCR-1和IL-2 mRNA的表达(吸光度值,x±s,n=10)
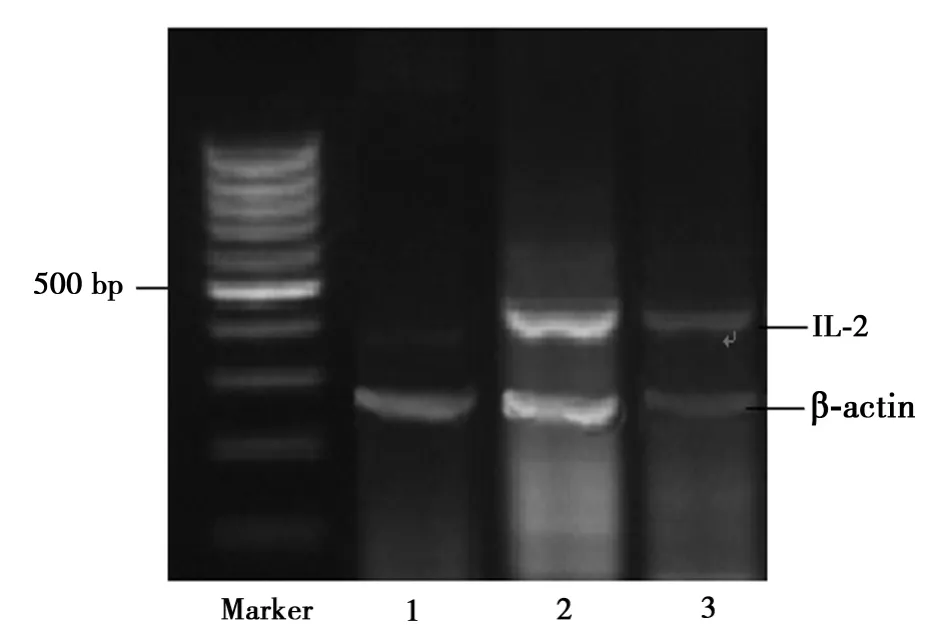
图5 各组大鼠动脉壁IL-2 mRNA表达
2.7 大鼠动脉壁细胞CCR1 mRNA表达 CCR1 mRNA在高脂饮食组的表达显著高于对照组(P<0.01)和辛伐他汀各组组(P<0.05)(表3,图6)。
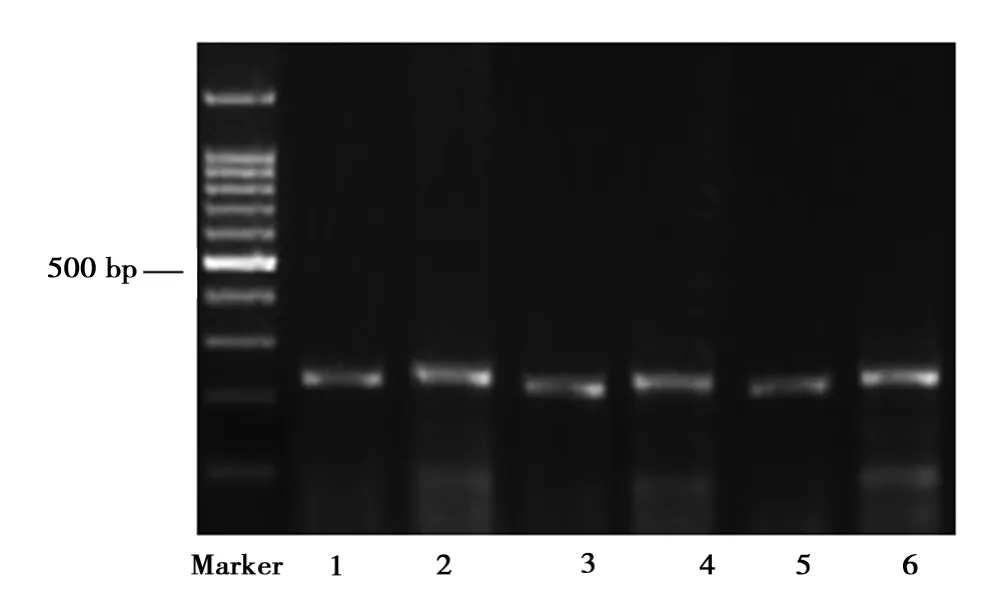
图6 各组大鼠主动脉壁RANTES表达
2.8 大鼠动脉壁细胞IL-2 mRNA表达 IL-2 mRNA在高脂饮食组的表达显著高于对照组(P<0.01)和辛伐他汀组(P<0.05)(表3,图7)。
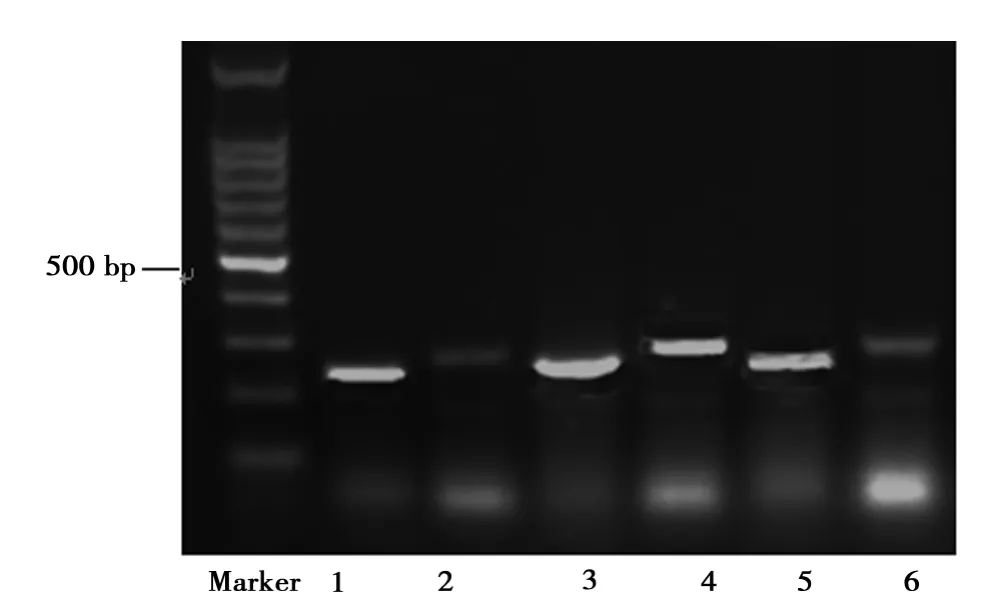
图7 CCR1 RT-PCR产物琼脂糖凝胶电泳
3 讨论
关于AS发病机制,众多发病假说先后被提出,但其确切病因和发病机制迄今尚未完全阐明〔7〕。AS的形成主要是脂质沉积于内膜下引起的一系列病变。因此高脂血症作为AS形成过程中一个重要的、独立的危险因素,越来越受到人们的重视。单核细胞进入内皮下形成泡沫细胞是AS发生的重要事件。因而研究单核细胞迁入内皮下间隙的机制对于阐明AS的发生发展具有十分重要的意义。而在吸引白细胞迁移的过程中主要是趋化因子在起作用。
RANTES属于CC型趋化因子,由正常T细胞表达和分泌,是一种可溶的分子量为8 kD的小分子蛋白质〔8〕,具有多种不同的生物学功能,对多种白细胞有趋化和激活作用。Veillard等〔9〕报道在复制C57BL/6J(LDLR-/-)小鼠高胆固醇血症模型基础上通过免疫组化染色检测到病灶局部巨噬细胞源性泡沫细胞、T淋巴细胞高表达RANTES。这些都表明RANTES在AS形成中可能起着非常重要的作用。而对于高脂血症大鼠病灶局部是否表达RANTES增多尚未见报道。本实验提示高脂血症可以引起大鼠动脉病灶局部表达趋化因子RANTES增多。趋化因子的作用都是与其相应受体的表达密切相关的。Schecter等〔10〕发现AS病变处的平滑肌细胞表达CC型趋化因子受体。国内也有研究表明同型半胱氨酸(Hcy)可诱导培养的单核细胞和大鼠动脉平滑肌细胞CCR1的表达〔11,12〕。本实验说明高脂血症不仅可以引起大鼠动脉壁细胞表达趋化因子RANTES增多,也可以增强其受体CCR1的表达。所以,大鼠动脉壁细胞表达RANTES及CCR1增强,可能是高脂血症引起AS形成的机制之一。IL-2是一种具有广泛生物活性的细胞因子,其主要生物学功能是活化T细胞,促进细胞因子产生;刺激NK细胞增殖,增强NK杀伤活性;促进B细胞增殖和分泌抗体;激活巨噬细胞〔13~15〕。有研究报道IL-2在小鼠阴道白假丝酵母菌病感染模型中增加RANTES的表达,且有报道IL-2可以增强培养的T细胞上 CCR-1的表达,且呈剂量依赖性〔16,17〕。但在高脂血症形成AS过程中IL-2是否也起着重要作用还不清楚。本文通过检测高脂血症SD大鼠主动脉壁细胞IL-2表达情况来观察IL-2在AS形成中的作用。实验结果显示IL-2在动脉壁细胞表达增强,其可能通过进一步诱导RANTES和CCR1表达增多而促使AS形成的,从实验结果看IL-2可能也是高脂血症引起AS形成的原因之一。
辛伐他汀是治疗AS的传统药物,可以抑制内源性胆固醇的合成〔18〕,具有降低血脂的作用,最近又发现辛伐他汀除了调脂作用外还有抗炎、抗氧化、抑制平滑肌增殖的作用〔19~22〕。现已普遍证实辛伐他汀对高脂血脂引起的AS治疗效果是比较好的。本研究表明高脂血症可能通过诱导大鼠胸主动脉血管壁细胞中IL-2、RANTES和CCR-1的表达引起AS的发生,辛伐他汀可以很好地抑制这一过程,为临床患者通过降低IL-2、RANTES和CCR-1的表达来预防AS的发生提供了理论基础。
1 Sheikine Y,Hansson GK.Chemokines and atherosclerosis〔J〕.Ann Med,2004;36(2):98-118.
2 Appay V.RANTES:a versatile and controversial chemokine〔J〕.Trend Immunol,2001;22(2):83-7.
3 Inngjerdingen M,Damaj B,Maghazachi AA,et al.Expression and regulation of chemokine receptors in human natural killer cells〔J〕.Blood,2001;97(2):367-75.
4 Ali S,Kaur J,Patel KD.Intercellular cell adhesion molecule-1,vascular cell adhesion molecule-1,and regulated on activation normal T cell expressed and secreted are expressed by human breast carcinoma cells and support eosinophil adhesion and activation〔J〕.Am J Pathol,2000;157(1):313-21.
5 Ward SG,Westwick J.Chemokines:understanding their role in T-lymphocyte biology〔J〕.Biochem J,1998;333(Pt 3):457-70.
6 Loetscher P,Seitz M,Baggiolini M,et al.Interleukin-2 regulates CC chemokine receptor expression and chemotactic responsiveness in T lymphocytes〔J〕.J Exp Med,1996;184(2):569-77.
7 Kulbertus H,Lancellotti P.Atherosclerosis:a complex disease〔J〕.Rev Med Liege,2012;67(5-6):273-8.
8 李 臻,张远强.β-趋化性细胞因子RANTES的研究进展〔J〕.生理科学进展,2006;37(1):79-82.
9 Veillard NR,Steffen S,Burger F,et al.Differential expression patterns of proinflammatory and antiinflammatory mediators during atherogenesis in mice〔J〕.Arterioscler Thromb Biol,2004;24(12):2339-44.
10 Schecter AD,Calderon TM,Berman AB,et al.Human vascular smooth muscle cellspossess functional CCR5〔J〕.JBiol Chem,2000;275(8):5466-71.
11 刑 伟,邓仲端,倪 娟.同型半胱氨酸对人单核细胞株THP21表达趋化因子受体CCR1 mRNA的影响〔J〕.华中科技大学学报(医学版),2003;32(3):235-8.
12 张哲莹,杨瑞,王淑秀.同型半胱氨酸诱导大鼠主动脉平滑肌细胞依赖正常T细胞激活和分泌的因子、趋化因子受体1的表达和机制探讨〔J〕.新乡医学院学报,2011;28(6):703-7.
13 Boyman O,Sprent J.The role of interleukin-2 during homeostasis and activation of the immune system〔J〕.Nat Rev Immunol,2012;12(3):180-90.
14 Albright JW,Bream JH,Bere EW,et al.Aging of innate immunity:functional comparisons of NK/LAK cells obtained from bulk cultures of young and aged mouse spleen cells in high concentrations of interleukin-2〔J〕.Exp Gerontol,2004;39(1):73-82.
15 Elmslie RE,Dow SW,Ogilvie GK.Interleukins:biological properties and therapeutic potential〔J〕.J Vet Intern Med,1991;5(5):283-93.
16 徐 艳.RANTES与IL-2在小鼠阴道白假丝酵母菌病模型中作用探讨〔D〕.中南大学,2007:1-20.
17 Loetscher P,Seitz M,Baggiolini M,et al.Interleukin-2 regulates CC chemokine receptor expression and chemotactic responsiveness in Tlymphocytes〔J〕.JExp Med,1996;184(2):569-77.
18 Fox KM,Gandhi SK,Ohsfeld RL,et al.Comparison of low-density lipoprotein cholesterol reduction after switching patients on other statins to rosuvastatin or simvastatin in a real-world clinical practice setting〔J〕.Am JManag Care,2007;13(Suppl 10):S270-5.
19 Wilson SH,Best PJ,Edwards WD,et al.Nuclear factor-kappaB immunoreactivity is present in human coronary plaque and enhanced in patients with unstable angina pectoris〔J〕.Atherosclerosis,2002;160(1):147-53.
20 Sen R,Baltimore D.Multiple nuclear factors interact with the immunoglobulin enhancer sequences〔J〕.J Immunol,2006;177(11):7485-96.
21 Shakhov AN,Collart MA,Uassalli P,et al.κB-type enhancers are involved in lipopolysaccharide-mediated transcriptional activation of the tumor necrosis factor a gene in primary macrophages〔J〕.J Exp Med,1990;171(1):35-47.
22 Thanos D,Maniatis T.NF-κB:a lesson in family values〔J〕.Cell,1995;80(4):529-32.

