肾皮、髓质表观弥散系数与慢性肾病滤过功能及病理改变的关系
涂 威 李 成 房向东 龚良庚 曾 磊 卢 玲
(南昌大学第二临床医学院,江西 南昌 330006)
慢性肾脏病(CKD)患者肾脏的病变程度与临床诊断及治疗息息相关。肾活检是评估CKD病变程度的唯一金标准,但其具有创伤性,重复可操作性差。使用具有放射性的二亚乙基三胺五乙酸(99mTc-DTPA)作为造影剂,测定分肾的残余肾功能即分肾肾小球滤过率(SKGFR),不仅空间分辨能力差、不利于清晰地观察到肾脏的病理改变情况,还因其具有放射性而对人体有害。磁共振(MRI)扩散加权成像(DWI)对活体水分子的弥散运动极其敏感,测量活体水分子弥散运动的表观弥散系数(ADC)可以反映肾脏病变组织内部的结构及其成分〔1〕。本研究拟探索DWI在CKD患者肾功能评估中的应用价值。
1 对象与方法
1.1 对象 选择2012年2~12月在我院就诊的CKD患者18例,均符合K/DOQI指南中 CKD的诊断标准〔2〕;其中男8例,女10例,年龄32~55〔平均(41.0±8.6)〕岁,均为双肾弥漫性病变患者,均行肾动态显像检查和肾穿刺活检证实为CKD1期患者。排除有任何一侧或双侧肾萎缩的患者,或者合并其他如肾结石、肾积水、多囊肾等疾病。选择同期在本院体检科体检的正常体检者(正常对照组)20例,男12例,女8例,年龄25~64〔平均(43.6±11.1)〕岁,均无肾脏疾病史,无肾脏疾病相关的临床表现,且无肾毒性药物接触史;反映肾脏功能的相关实验室指标正常,并且行磁共振成像(MRI)常规T1、T2加权扫描提示肾脏正常。
1.2 MRI检查方法 设备:Singa HDxT GE3.0 T磁共振扫描仪购自美国GE公司,采用表面相控线圈并使用呼吸门控。为减少化学位移伪影对ADC值的影响,本文采用空间预饱和技术尽量消除腹部脂肪信号。MRI扫描方法:受试者分别行常规双肾T1WI及T2WI扫描。DWI采用单次激发回波平面(SSEPI)序列,重复时间(TR)6 316 ms,回波时间(TE)63.1 ms,矩阵 96×180,视野(FOV)340 mm×240 mm,励次数(NEX)8 次,b值为800 s/mm2。扫描中心层面定位在肾脏中心层面,层数6层,层厚8 mm。
测量方法:在DWI图上绘制出感兴趣区域(ROI),ROI的选择部位均在肾门中心地带皮、髓质分界清楚的区域,皮质ROI部分用自由线勾画出,同时注意避开T2WI上已确认的如肾囊肿等其他肾脏病变;髓质ROI部分用圆形工具在肾脏的前、中、后部分勾勒3个圆形区域,面积为15~25 mm2,求得3个圆形区域的平均值作为相应部分肾髓质的ADC值。
1.3 滤过功能的测定 在MRI检查前及MRI检查1 w后,采用99mTc-DTPA肾动态显像技术测定病例组的SKGFR。仪器为美国GE公司的Infinia vc Hawkeye4双探头单光子发射计算机断层仪(SPECT),检测时“弹丸”式静脉注射99mTc-DTPA 185 MBq后即刻进行动态采集,计算SKGFR。
1.4 病理检测与肾脏病理损伤程度评定 将病例组肾组织标本采用10%中性甲醛固定,经脱水、石蜡包埋制片(1μm),常规染色,行光镜和免疫荧光镜检查。肾脏病理程度的评分采用Katafuchi肾病评分系统〔3〕:总分0~27分,其中肾小球积分1~12分,肾小管-间质积分0~9分,血管积分0~6分。病理损害积分为三者分值相加之和。
1.5 统计学方法 采用SPSS17.0软件。计量资料以x±s表示,组间比较采用t检验;计数资料比较采用χ2检验。相关性检验采用Pearson直线相关分析法。
2 结果
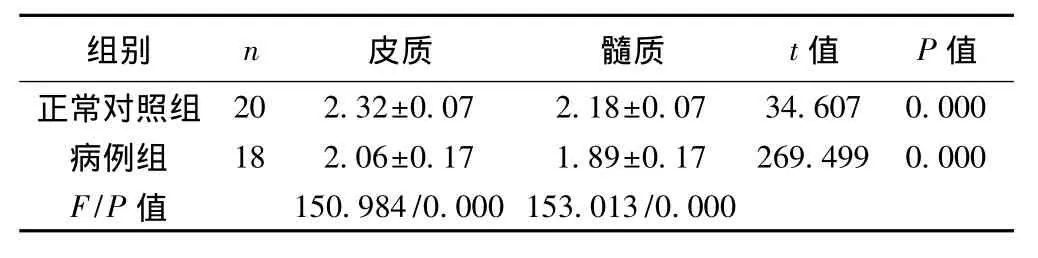
表1 两组肾皮、髓质ADC值的比较(x±s,10-3 mm2/s)
2.1 两组肾皮、髓质ADC值的比较 见表1。两组肾皮质ADC值显著大于肾髓质(P<0.05),病例组肾皮、髓质ADC值均显著小于正常对照组(P<0.05)。
2.2 病例组肾皮、髓质ADC值与SKGFR、病理损害积分的相关性 相关性分析结果显示,病例组的分肾皮、髓质ADC值与分肾SKGFR均呈正相关(r=0.697、0.800,均P<0.05);见图1,图2。病例组右肾皮、髓质ADC值与肾脏病理损害积分均呈负相关性(r=-0.814,-0.800,P<0.01)。见图3,图4。
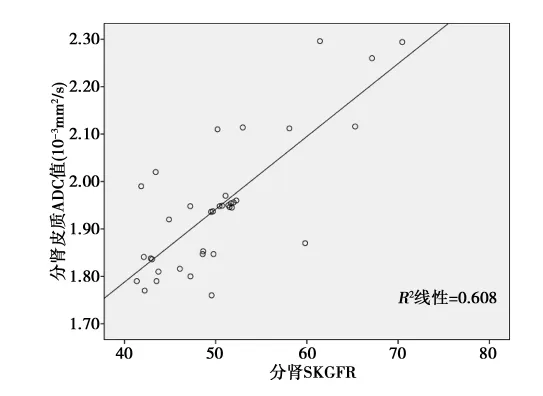
图1 病例组分肾皮质ADC与分肾SKGFR的相关性
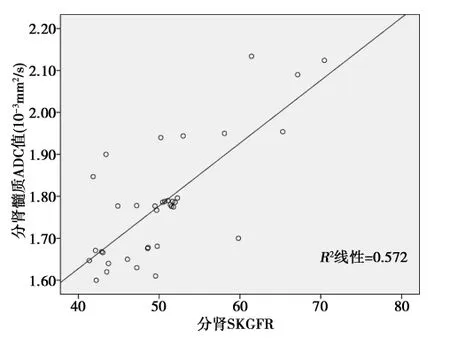
图2 病例组分肾髓质ADC与分肾SKGFR的相关性
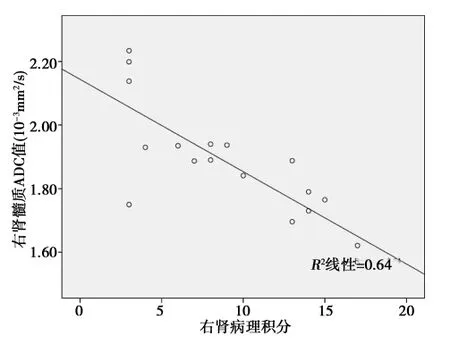
图3 病例组右肾皮质ADC与病理损害积分的相关性
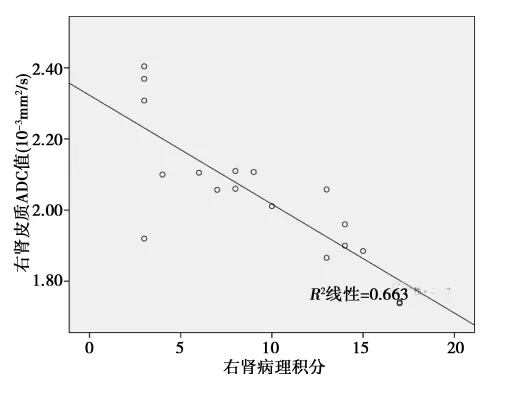
图4 病例组右肾髓质ADC与病理损害积分的相关性
3 讨论
肾脏DWI成像技术能极其敏感地感知水分子的扩散运动,通过对组织内水分子活动自由度的识别来间接反映肾脏组织的结构特点〔4〕。CKD患者的肾脏病理可有多种形式:①不同程度的肾小球硬化,②肾间质炎症,③肾脏纤维化,④肾小管萎缩和增生。肾脏的这些病理改变均能影响肾小球的血流动力学,从而使肾小管和肾间质转运水的功能减弱。这些改变都对水分子的扩散运动产生影响,从而影响ADC值。ADC值由代表DWI的扩散敏感度的b值计算得出,高b值时ADC值主要反映水分子的扩散效应,但降低了图像的信噪比;低b值时DWI降低了扩散的权重,增加了血流灌注的影响〔5〕。3.0 T磁共振扩散成像的b值选取800 s/mm2,具有较好的分辨力,以区分肾脏的皮髓质。
研究〔6,7〕已证实,CKD患者肾脏的ADC值较正常人明显降低,ADC值在肾功能的评估中具有稳定性,表明DWI可用于评价肾脏功能。根据K/DOQI指南对CKD的诊断标准,本研究纳入的患者均处于CKD1期,肾小球滤过率(GFR)及血肌酐处于正常水平,经肾穿刺病理诊断均有不同程度的肾纤维化。本研究结果表明在采用较高b值条件下,ADC值可能早于GFR发现肾脏病理结构的改变,对CKD的早期诊断有一定的临床价值。本研究结果还显示,正常对照组和病例组的皮质ADC值均明显大于髓质,可能与髓质组织循环灌注相对不足有关。
99mTc-DTPA肾动态显像是目前临床测定肾功能的方法之一,同时也是唯一测定分肾功能的检测手段。Goyal等〔4〕研究显示,CKD患者的肾脏ADC值会随着eGFR的降低而减小。Xu等〔8〕也证实了这一点,并且还报道了肾脏ADC值与单侧肾脏的GFR间相关系数高达0.70。我们研究分析发现,CKD患者分肾皮髓质ADC值与相应分肾GFR呈正相关,以髓质ADC值明显,可能是由于在髓质内间质占有的体积比皮质大,而其他研究〔9,10〕则认为,肾间质病变的严重程度与GFR的下降密切相关,并可决定肾脏疾病的发展预后。即使肾小球病变程度严重,如未伴有肾间质病理改变,GFR值不会出现明显降低。因此,滤过功能的下降对髓质ADC值的影响更为显著,髓质ADC值一定程度上能更好地反映肾功能的状态。
目前评价肾脏病变严重程度的金标准是肾穿刺活检术,因其为有创性的检查,反复操作具有一定的风险性,部分病人难以接受,不利于动态监测病情的发展。使用无创检查评价肾脏病理损害程度是临床亟待解决的难题。本课题研究的CKD病理组织中可见不同程度的肾小球硬化,肾小球系膜增生,肾间质单核细胞浸润及灶状纤维化,这些病变均可引起肾脏血流灌注减少,在DWI上表现为肾实质ADC值的降低。Inoue等〔11〕检测37例CKD并且无糖尿病并发症的患者,并且这些患者均行肾穿刺活检术,检测其ADC值发现,肾间质纤维化的程度越重,皮质ADC值越小。李琼等〔12〕的研究结果也得到一致的结论。
综上所述,DWI测量的ADC值是评估CKD患者肾脏功能的有效方法,ADC值对CKD的早期诊断较为敏感,可能早于GFR发现肾脏结构及功能的损害。ADC值与肾脏滤过功能及病理积分之间存在相关性。作为无创性功能成像技术,DWI能够在分子水平反映肾脏的功能状态,为临床评价CKD及其功能变化提供了一种新的方法。
1 Herqet-Rosenthal S.Imaging techniques in the management of chronic kidney disease:current developments and future perspectives〔J〕.Semin Nephrol,2011;31(3):283-90.
2 National kidney Fundation.K/DOQI clinical practice guidelines for chronic Kidney disease:Evaluation,classification,and stratification〔J〕.Am J Kidney Dis,2002;39(2 Suppl1):S1-S266.
3 Katafuchi R,Kiyoshi Y,Oh Y,et al.Glomemlar score as a prognosticator in IgA nephropathy:its usefulness and limitation〔J〕.Clin Nephrol,1998;49(1):1-8.
4 Goyal A,Sharma R,Bhalla AS,et al.Diffusion-weighted MRI in assessment of renal dysfunction〔J〕.Indian J Radiol Imaging,2012;22(3):155-9.
5 Artunc F,Rossi C,Boss A.MRI to assess renal structure and function〔J〕.Curr Opin Nephrol Hypertens,2011;20(6):669-75.
6 Kim S,Naik M,Sigmund E,et al.Diffusion-weighted MR imaging of the kidneys and the urinary tract〔J〕.Magn Reson Imaging Clin N Am,2008;16(4):585-96.
7 徐学勤,林晓珠,陈克敏,等.MR扩散加权成像在慢性肾病肾功能损害方面的价值研究〔J〕.临床放射学杂志,2011;30(9):1330-3.
8 Xu X,Fang W,Ling H,et al.Diffusion-weighted MR imaging of kidneys in patients with chronic kidney disease:initial study〔J〕.Eur Radiol,2010;20(4):978-83.
9 Meckensen-Haen S,Badel R,Grand KE,et al.Correlations between renal cortical interstitial fibrosis,atrophy of proximal tubules and impairment of glomerular filtration rate〔J〕.Clin Nephrol,1981;15(4):167-71.
10 Palm F,Nordquist L.Renal tubulointerstitial hypoxia:cause and consequence of kidney dysfunction〔J〕.Clin Exp Pharmacol Physiol,2011;38(7):474-80.
11 Inoue T,Kozawa E,Okada H,et al.Noninvasive evaluation of kidney hypoxia and fibrosis using magnetic resonance imaging〔J〕.J Am Soc Nephrol,2011;22(8):1429-34.
12 李 琼,张 泉,孙浩然,等.慢性肾脏病的皮髓质ADC值与肾脏功能及病理的相关性研究〔J〕.临床放射学杂志,2012;31(4):515-9.

