猪源枯草芽孢杆菌的分离鉴定及其特性研究
温灿权,陆黎明,戴佳佳,黄梅丹,张立彬,黄志坚
(1.福建农林大学 动物科学学院,福建 福州 350002;2.福建省漳州市大北农农牧科技有限公司,福建 漳州363000;3.福建省动物药物工程实验室,福建 福州 350002)
目前,国内外对益生菌的应用研究备受关注,因为抗生素的弊端日益凸显,使用微生态制剂替代抗生素的效果已经成为一种趋势[1]。目前应用较广的主要有芽孢杆菌制剂、乳酸菌制剂和酵母菌制剂等。在众多微生物添加剂中,乳酸菌制剂是饲料微生物添加剂中应用最为广泛,效果较好的一类[2]。但是乳酸菌的抗逆性较差,容易造成临床使用效果不稳定。
枯草芽孢杆菌由于芽孢的存在,有较强的抗逆性,能够耐受生产、加工、运输、保存过程等中遇到的各种环境仍然可保持较高的活性。它于1989年被美国食品与药物管理局(FDA)批准使用,1999年被我国农业部批准使用,具有改善消化道内环境、促进动物生长、提高动物机体免疫力及产生多种酶类、提高消化酶活性等功能,其在饲料添加剂、污水处理、疫苗载体等各方面已经得到了广泛的应用,显示了巨大的社会效益和生态效益[3-5]。
本研究对分离的菌株进行菌落形态观察、生理生化试验和16S rDNA序列分析来综合鉴定,对其生物学特性进行研究:考察其对于人工胃液、人工肠液、胆盐、高温的耐受情况,产酶情况分析,药物敏感分析及其对于大肠杆菌O18∶K88、O8∶K99和金黄色葡萄球菌的抑制情况,从而得到高生物活性的益生菌菌株,为进一步研制微生态制剂提供优良的益生菌菌种参考。
1 材料与方法
1.1 材料
1.1.1 样品来源 采集自健康猪肠道内容物、新鲜粪便及猪场周边土壤。
1.1.2 主要设备 高压蒸汽灭菌锅、超净工作台、pH计、生化培养箱、恒温水浴锅、台式离心机、光学显微镜、摇床、PCR仪、电泳仪、凝胶成像系统和紫外分光光度计等。
1.1.3 培养基 LB培养基、LB琼脂培养基、明胶培养基、产淀粉酶琼脂培养基、产蛋白酶琼脂培养基、产纤维素酶琼脂培养基、产木聚糖酶琼脂培养基和产脂肪酶琼脂培养基。
1.1.4 试剂和溶液 革兰氏染色试剂盒、芽孢染色试剂盒、细菌微量生化鉴定管、细菌基因组DNA提取试剂盒、16S通用引物、Taq DNA聚合酶等;人工胃液、人工肠液按照药典[6]配得。
1.1.5 指示菌 大肠杆菌O18∶K88、O8∶K99由大北农饲用微生物国家重点实验室提供,金黄色葡萄球菌由福建农林大学动物科学学院微生物实验室提供。
1.2 方法
1.2.1 菌株分离 称取适量样品,加入装有100 mL 0.85%生理盐水、含小玻璃珠的锥形瓶中,振荡均匀,于80℃恒温水浴锅中水浴10 min。取10 mL处理液加入90 mL LB培养基中,于37℃,160 r/min的摇床培养24 h。
取0.5 mL培养液,加入4.5 mL 0.85%灭菌生理盐水的试管中,按1∶10倍比稀释至合适稀释度,取3个合适稀释度的稀释液100μL于LB琼脂培养基上,用涂布棒涂抹均匀,放置20min后,于37℃生化培养箱中倒置培养36~48 h。
1.2.2 菌株纯化 挑取单菌落划线接种于LB琼脂培养基上,于37℃生化培养箱中培养24 h,重复划线接种培养2~3次,可得到纯的菌株,进行染色镜检,将得到的菌株接种于斜面培养基中,4℃保存。
1.2.3 生化鉴定 硝酸盐还原试验、产H2S试验、吲哚试验、明胶液化试验、糖酵解等,参照《伯杰细菌鉴定手册》[7]及《常见细菌系统鉴定手册》[8]鉴别。
1.2.4 16S rDNA序列测定 取1 mL菌液离心获得菌体,采用细菌基因组DNA提取试剂盒提取细菌总DNA,并对其进行16S rDNA序列扩增,所用的引物为16S通用引物:27F(5′-AGAGTTTGATCCTGGCTCAG-3′)和 1694R(5′-GGTTACCTTGTTACGACTT-3′),由生工生物工程(上海)股份有限公司合成。
PCR反应体系为50μL体系:Premix TaqTM(TaKaRa TaqTMVersion 2.0)25μL,引物F 1μL,引物R 1 μL,模板DNA 2 μL,超纯水21 μL。
PCR扩增条件:95℃预变性3 min;95℃变性30 s,55℃退火30 s,72℃延伸1.5 min,共34个循环,72℃后延伸10 min,4℃保存。
PCR产物经10 g/L的琼脂糖凝胶电泳后,检验是否有目标条带,将有目标条带的PCR产物送生工生物工程(上海)股份有限公司进行测序。
1.2.5 系统进化树的构建 将测得的序列使用Chromas 2.22处理,通过DNAMAN 6.0进行拼接后,登陆 GenBank(http://www.ncbi.nlm.nih.gov/),对于菌株 16S rDNA 测序的结果,利用 Blast功能进行序列比对,并选取相似性较高的菌株,用Clustl X软件进行序列比对,使用Mega 5软件采取Neighbor-Joining法构建系统进化树。
1.2.6 耐人工胃液试验 分别取0.5 mL培养菌液,加入4.5 mL的pH 为2.0、3.0、4.0的人工胃液和4.5 mL的灭菌生理盐水中,37℃恒温水浴3 h,10倍比稀释至合适的稀释度,取3个合适稀释度菌液100μL分别涂布于LB琼脂培养基,20 min后倒置,于37℃生化培养箱中培养24 h,进行平板活菌计数,计算存活率。
1.2.7 耐人工肠液试验 分别取0.5 mL培养菌液,加入4.5 mL的人工肠液和灭菌生理盐水中,37℃恒温水浴3 h,取处理液10倍比稀释,处理同1.2.6耐人工胃液试验,计算存活率。
1.2.8 耐胆盐试验 在含有4.5 mL 的0%、0.03%、0.1%、0.2%、0.3%猪胆盐的 LB 培养基中,分别接种0.5 mL的菌液,37℃,160 r/min摇床培养4 h,处理液10倍比稀释,处理同1.2.6耐人工胃液试验,计算存活率。
1.2.9 耐高温试验 分别取5 mL芽孢杆菌菌液,于85,90,95,100℃中水浴0 min、3 min,取处理液0.5 mL加入4.5 mL 0.85%灭菌生理盐水10倍比稀释,处理同1.2.6耐人工胃液试验,计算存活率。
1.2.10 产酶能力测定 采用平板透明圈法。分别在纤维素酶培养基、蛋白酶培养基、淀粉酶培养基、木聚糖酶培养基和脂肪酶培养基上点种分离的芽孢杆菌,每种处理设3个重复,37℃培养24 h,用游标卡尺分别测量透明圈直径(H)和菌落直径(C),计算两者比值(H/C)。
1.2.11 抑菌试验 采用牛津杯法测定其对大肠杆菌O18∶K88、O8∶K99和金黄色葡萄球菌的抑制情况。
设计4个处理:空白对照组(生理盐水)、离心上清液组(4 000 r/min得到上清液)、离心沉淀组(4 000 r/min离心去上清后,生理盐水重悬)和全菌液组,每组3个重复,对应加入200μL待检样品,置于4℃冰箱中2 h后,移入37℃恒温培养箱中培养18 h观察结果。
1.2.12 药敏试验 采用K-B纸片扩散法,根据抑菌圈大小判断分离的菌株对于常见的抗菌药物是否敏感。
2 结果
从漳州市漳浦县散养农户处采集的猪粪中,分离、纯化、筛选、鉴定得到一株各方面性能都较理想的猪源芽孢杆菌,命名为ZZS16-3。
2.1 菌落形态
菌落圆形,表面色暗,乳白色不透明,圆形,表面褶皱(图1);镜检:革兰氏阳性,杆状,染色均匀(图2);芽孢中生,椭圆,孢囊不膨大(图3)。

2.2 菌株ZZS16-3的生化鉴定
菌株ZZS16-3的生化反应结果见表1,根据《伯杰细菌鉴定手册》及《常见细菌系统鉴定手册》,初步鉴定菌株ZZS16-3为枯草芽孢杆菌(Bacillus subtilis)。
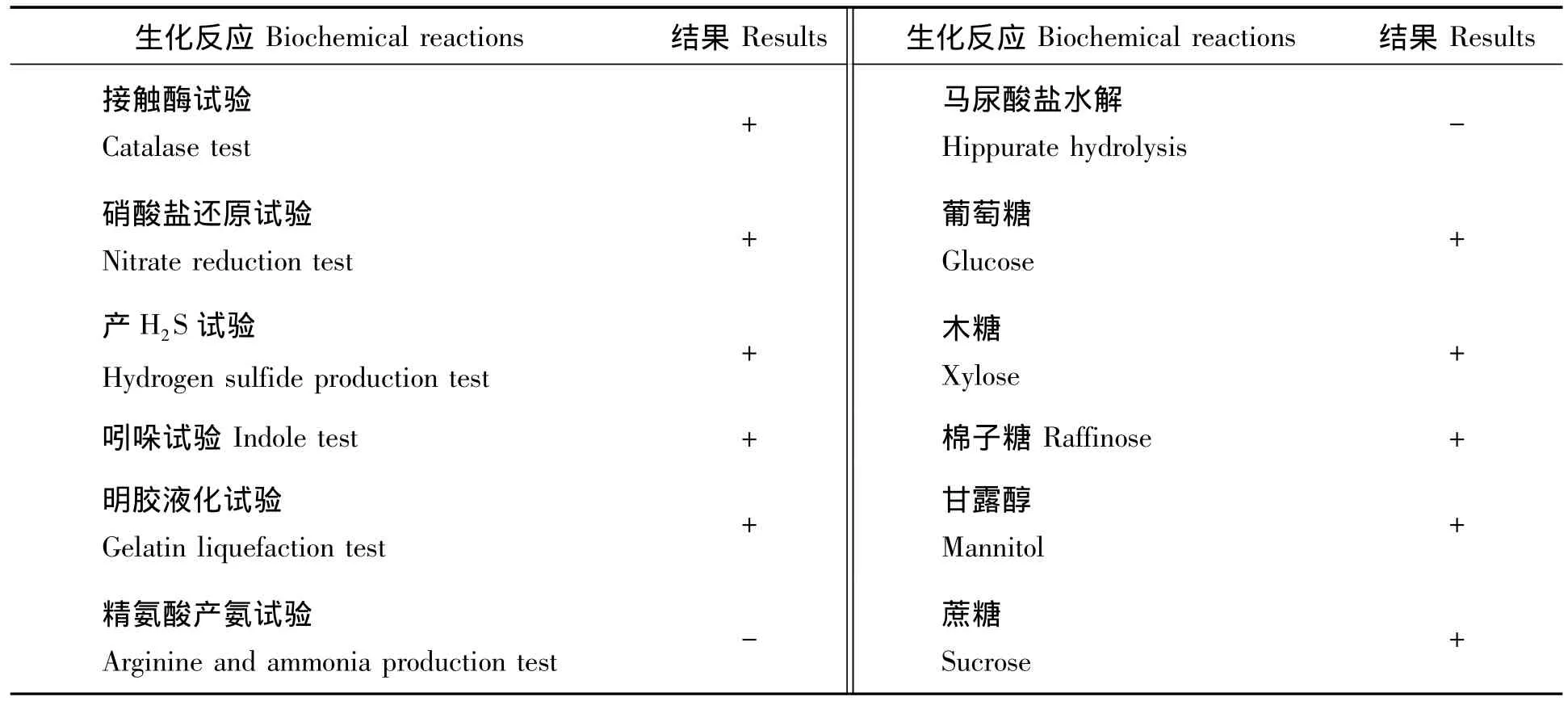
表1 菌株ZZS16-3的生化反应结果Tab.1 Results of Strain ZZS16-3’s biochem ical reactions
2.3 菌株ZZS16-3的16S rDNA序列分析
以27F和1492R为上下游引物,细菌总DNA为模板进行PCR扩增,菌株ZZS16-3的16S rDNA PCR扩增产物经琼脂糖凝胶电泳得到图4,条带在1 000~2 000 bp,约1 500 bp(图4)。
测得的序列使用Chromas 2.22处理,通过DNAMAN 6.0进行拼接后,将菌株ZZS16-3的16S rDNA序列上传至NCBI中进行BLAST同源性比对分析,发现其与Bacillus subtilis的同源性为100%,筛选7条同源性比较近的序列,建立比对模型,用Mega 5采取Neighbor-Joining法构建系统进化树,利用bootstrap生成1000个自展数据集对进化树进行可靠性分析。如图5所示,菌株ZZS16-3与Bacillus subtilis遗传距离最小,亲缘关系最近,判断其为枯草芽孢杆菌。综合菌株ZZS16-3的生理生化特性及16S rDNA序列分析结果,确定该菌株为芽孢杆菌属的枯草芽孢杆菌(Bacillus subtilis)。

图4 菌株ZZS16-3的PCR扩增后电泳结果Fig.4 Strain ZZS16-3’s agarose gel electrophoresis result after PCR amplification
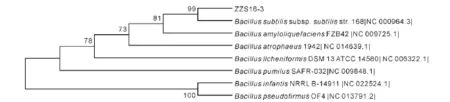
图5 菌株ZZS16-3的系统进化分析Fig.5 Phylogenetic analysis of strain ZZS16-3
2.4 耐人工胃液试验结果
枯草芽孢杆菌ZZS16-3的耐人工胃液试验结果如图6所示,在pH为2.0、3.0、4.0的人工胃液中的存活率分别为65.8%、92.4%、97.4%,随着pH值减小,枯草芽孢杆菌ZZS16-3的存活率下降,但其在pH为2.0的人工胃液中,存活率仍可达到65.8%,说明其对于人工胃液具有较强的耐受性。
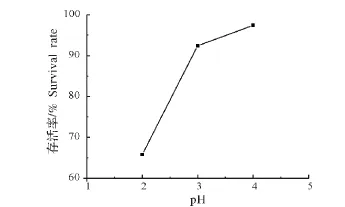
图6 枯草芽孢杆菌ZZS16-3的耐人工胃液试验结果Fig.6 Test results of Bacillus subtilis ZZS16-3’s resistance to artificial gastric juice

图7 枯草芽孢杆菌ZZS16-3的耐胆盐试验结果Fig.7 Test results of Bacillus subtilis ZZS16-3’s resistance to bile salt
2.5 耐人工肠液试验结果
枯草芽孢杆菌ZZS16-3在人工肠液中的存活率为74.7%,说明其可以耐受人工肠液。
2.6 耐胆盐试验结果
枯草芽孢杆菌ZZS16-3的耐胆盐试验结果如图7 所示,在含有0.03%、0.1%、0.2%、0.3%猪胆盐的LB培养基中,其存活率随着胆盐含量升高而降低,在胆盐浓度为0.3%时为51.2%,说明其能够耐受一定浓度胆盐环境。
2.7 耐高温试验结果
枯草芽孢杆菌ZZS16-3的耐高温试验结果如图8所示,随着处理温度的升高,存活率逐渐降低,在温度为85℃处理3 min后,其存活率为58.8%,但在100℃处理3 min后其存活率达到11.2%,可见其能够在一定程度上耐受高温的环境。
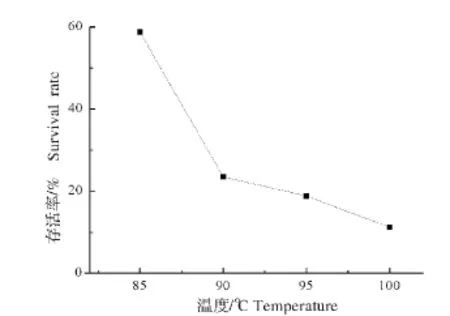
图8 枯草芽孢杆菌ZZS16-3的耐高温试验结果Fig.8 Test results of Bacillus subtilis ZZS16-3’s resistance to high temperature
2.8 产酶试验结果
枯草芽孢杆菌ZZS16-3产酶检测结果见表2,在纤维素酶培养基、蛋白酶培养基、淀粉酶培养基、木聚糖酶培养基和脂肪酶培养基上点种,枯草芽孢杆菌ZZS16-3可产生相应的酶分解利用这些物质来促进生长。

表2 枯草芽孢杆菌ZZS16-3的产酶测定结果Tab.2 Determ ination of Bacillus subtilis ZZS16-3’s enzym e production
2.9 药敏试验
采用K-B纸片扩散法,选取15种常用药物做试验,结果如表3所示,枯草芽孢杆菌ZZS16-3对于多粘菌素B、林可霉素有一定的耐受,链霉素中度敏感,而对于绝大多数的药物是敏感的。
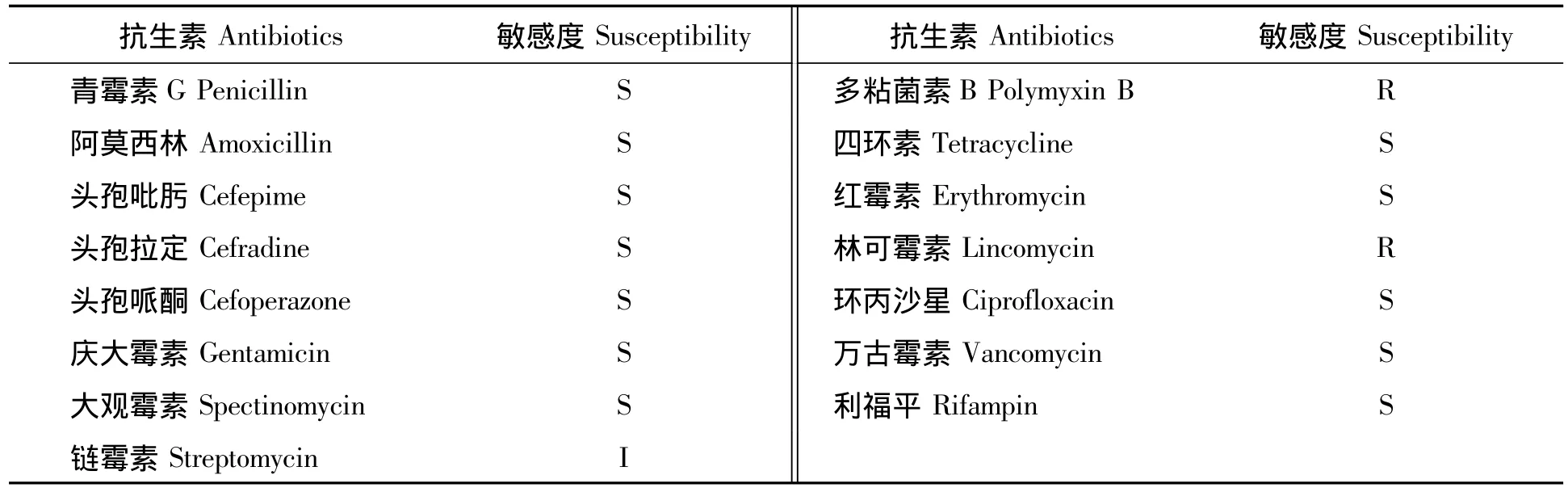
表3 枯草芽孢杆菌ZZS16-3对15种常用药物的敏感试验结果Tab.3 Susceptibility test results of Bacillus subtilis ZZS16-3 to 15 comm only used drugs
2.10 抑菌试验结果
枯草芽孢杆菌ZZS16-3对大肠杆菌O18∶K88、O8∶K99的4个处理都无抑菌圈,对金黄色葡萄球菌则有明显的抑菌效果,在18 h(图9)观察发现离心上清液组和全菌液组的牛津杯周围出现了明显的抑菌圈,而离心沉淀组和空白对照组则无明显抑菌圈;在42 h(图10)观察发现离心沉淀组也出现有明显的抑菌圈,而空白对照组则无抑菌圈;抑菌圈直径如表4所示。
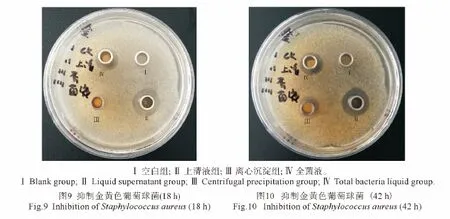

表4 枯草芽孢杆菌ZZS16-3对金黄色葡萄球菌O18∶K 88、O 8∶K 99的抑制结果Tab.4 Inhibition results of Bacillus subtilis ZZS16-3 to Staphylococcus aureus O18∶K 88,O8∶K 99
3 分析与讨论
3.1 菌株鉴定
传统的鉴定方法是从菌落形状、大小、染色结果等方面判断,通过设计一系列的生化实验,来粗略鉴定,具有耗时长、易干扰、误差大等缺点[9]。随着分子生物学的发展,基于16S rRNA具有功能和进化上的同源性以及它们序列进化变异频率缓慢、在整体结构上极端保守,并且16S rRNA分子大小适中,携带有充分的生物信息可用来进行可靠的系统进化分析等特征,建立了通过比较16S rRNA全部核苷酸序列来确定生物分类地位的方法,该方法具有方便、快捷等优点,同时可以从分子的角度来描述不同菌株种内之间的差异,对确定新种有重要的作用[10]。本试验菌株是从猪肠道内容物、粪便、土壤等分离、纯化,经过80℃水浴10 min的筛选、细菌的菌落形态观察、染色镜检、生化试验以及16S rDNA序列分析及同源性比较,综合确定菌株ZZS16-3为枯草芽孢杆菌。
3.2 抗逆性试验
有关研究[11-12]表明,在饲料中添加比例的微生态制剂,其能够产生大量益生菌、寡肽、谷氨酸和未知生长因子等物质,且有较强的蛋白酶、脂肪酶和淀粉酶等多种有效的酶促活性,具有调整肠道微生态平衡,提高动物生长性能,降低料肉比,提高动物机体免疫力,减少疾病的发生等功效。而在生产实际中,微生态制剂的使用会出现效果不稳定的情况,除了宿主动物的年龄、生理状态等影响外,菌种本身的特性是发挥作用效果的关键。
动物胃中pH较低,成年猪胃内pH一般为1~2,断奶仔猪胃的pH变异较大,一般为2.60~5.83,食物通过胃的排空时间为2~6 h[13]。益生菌随着食物进入动物消化道,先到达胃部,进入一个含有胃蛋白酶的酸性环境中,然后到达机体最重要的吸收器官小肠,经受胰蛋白酶、胰脂肪酶等各种消化酶和胆盐的消化作用,只有能在胃肠道中存活并达到一定数量,益生菌才能够有发挥作用的可能。因此,益生菌需要能够耐受胃肠道环境,包括胃酸液、肠液、胆盐等,芽孢杆菌在其生长发育后期,在细胞内形成的一个圆形或椭圆形、厚壁、含水量低、抗逆性强的芽孢休眠体。与营养细胞相比,芽孢对热的抗性高100 000多倍,对紫外线和离子辐射的抗性高100多倍,对脱水、抗菌素及其他化学药品的抗性也较高,可耐受各种不利条件,如干热(150℃干热l h仍有芽孢存活)、湿热、紫外线、强酸、强碱、有机溶剂、极度干燥、真空干燥、氧化剂的氧化作用等[14]。本实验中筛选的枯草芽孢杆菌ZZS16-3在pH值为2.0时的人工胃液中处理3 h后存活率为65.8%,人工肠液中存活率为74.7%,胆盐浓度为0.3%时存活率为51.2%,说明其具有较强的抗逆性。
3.3 产酶试验
枯草芽孢杆菌作为益生菌,除具抵抗肠道逆境条件外,还具有分泌淀粉酶、蛋白酶、纤维素酶和脂肪酶的能力[15]。这些外源性的消化酶,能够在一定程度上帮助降解动植物性饲料中复杂的有机物,促进营养物质的消化吸收,提高饲料利用率。葛永怡等[16]报道的两株枯草芽孢杆菌培养48 h后,产纤维素酶平板的 H/C 值为1.86±0.03和1.95±0.02;孙晓鸣等[17]报道枯草芽孢杆菌产淀粉酶平板上 H/C值为1.729,蛋白酶平板上H/C值为3.01,可产生脂肪酶。本试验采用平板透明圈法,对枯草芽孢杆菌ZZS16-3产淀粉酶、蛋白酶、纤维素酶、脂肪酶和木聚糖酶情况进行分析,这种方法可以初步反映出产酶活力的高低,产酶能力越高,水解圈越大;产酶速度越快,水解圈出现的越早[18]。发现其可产生相应的酶,其中产蛋白酶平板H/C值为2.21±0.19,产淀粉酶平板H/C值为2.86±0.25,产纤维素酶平板H/C值为3.40±0.55,均优于前述报道,表明枯草芽孢杆菌ZZS16-3具有较高的产酶能力。
3.4 药敏试验
枯草芽孢杆菌ZZS16-3对于多粘菌素B、林可霉素有一定的耐受,链霉素中度敏感,而对于绝大多数的药物是敏感的。在使用益生菌时,应避免与其敏感的抗生素同时使用,这也是保证益生菌发挥作用的关键一步[19]。
3.5 抑菌试验
在研制开发微生态制剂时,菌种对致病菌的拮抗作用研究也是评价制剂有效性的重要依据。现阶段微生态学生物拮抗理论认为,益生菌在体内能产生多种物质,如各种生物酶、乳酸、丙酸、过氧化氢和细菌素等物质对病原细菌的抑制作用、占位性作用,以及对营养、氧气的竞争,从而对病原菌具有明显的生物拮抗作用[19]。
在本试验中,枯草芽孢杆菌ZZS16-3对大肠杆菌O18∶K88、O18∶K99的无抑菌圈,对于金黄色葡萄球菌则表现有明显的抑制效果,与王城[20]研究一致,对于大肠杆菌没有抑制作用,而对于金黄色葡萄球菌则有一定的抑制作用;与潘宝海[21]研究不同,其研究发现6株枯草芽孢杆菌对于大肠杆菌有不同的抑制效果,对O18∶K99均有拮抗作用;与窦茂鑫[22]研究不一致,其从粪便中分离的枯草芽孢杆菌对大肠杆菌、沙门氏菌、金黄色葡萄球菌都具有一定的抑菌作用。这可能与菌种特性有关,其抗菌谱不同。
试验18 h观察发现离心上清液组和全菌液组的牛津杯周围出现了明显的抑菌圈,且前者抑菌圈直径明显大于后者,而离心沉淀组和空白对照组则无抑菌圈,表明抗菌物质主要存在于上清液中;试验42 h观察发现离心沉淀组也有明显的抑菌圈出现,但其抑菌圈直径均小于离心上清液组和全菌液组,可能是枯草芽孢杆菌菌体所产生的代谢产物,如细菌素、丙酸、过氧化氢等,有待进一步研究。
4 结论
从采集到的样品中分离、筛选、鉴定得到一株高生物活性的菌株ZZS16-3,经过菌落形态特征、生理生化特性和16S rDNA序列分析综合确定菌株ZZS16-3为枯草芽孢杆菌,其具有较强的抗逆性和潜在的益生性能,为研制微生态制剂提供了优良的菌种。
[1]王亚芳,肖群平,吕慧源,等.猪复合微生态制剂菌株的筛选及对仔猪生产性能的影响[J].中国畜牧杂志,2014,50(4):58-62.
[2]热娜·米吉提,古丽斯玛依·艾拜都拉,苏豫梅,等.新疆饲料乳酸菌的多样性与系统进化分析[J].安徽农业科学,2012,40(6):3253-3257.
[3]白延琴,辛小玲,来有志,等.枯草芽孢杆菌的分离筛选[J].畜牧兽医杂志,2013,32(2):24-31.
[4]温海燕.枯草芽孢杆菌的分离与初步鉴定[J].黑龙江畜牧兽医,2012(5):118-119.
[5]雷爱莹,彭敏,曾地刚,等.枯草芽孢杆菌的分离和净化水质的研究[J].广西农业科学,2005,36(3):248-250.
[6]国家药典委员会.中华人民共和国药典(二部)[M].北京:化学工业出版社,2005:85.
[7]R.E.布坎南.伯杰细菌鉴定手册[M].9 版.北京:科学出版社,1995.
[8]东秀珠,蔡妙英.常见细菌系统鉴定手册[M].北京:科学出版社,2001.
[9]王彬,曹允考,魏亚松,等.鸡肠道枯草芽孢杆菌的分离鉴定及生物特性研究[J].饲料博览,2014(2):1-6.
[10]涂宏钢,李存瑞,巫庆华,等.利用16S rRNA全长序列鉴定植物乳杆菌[J].乳业科学与技术,2004(2):57-60.
[11]许云贺,曹新民,张莉力,等.枯草芽孢杆菌HY4体外益生性能的研究[J].饲料研究,2014(5):4-6.
[12]徐晖,魏培莲.枯草芽孢杆菌微生态制剂的研制[J].氨基酸和生物资源,2008,30(2):56-58.
[13]陈丽仙,吴雅琨,王安如.一株益生芽孢杆菌的分离及理化性质鉴定[J].华北农学报,2011,26:518-521.
[14]唐建中,戴求仲,周旺平.高温处理及试验制粒对两种有益芽孢杆菌的影响[J].饲料博览,2009(4):25-27.
[15]汪海峰,王井亮,王翀,等.一株肠源枯草芽孢杆菌的生长、抗逆和产酶特性分析[J].中国畜牧杂志,2012,48(17):66-69.
[16]葛永怡,史艾宁,李祝,等.畜禽粪污土壤中产纤维素酶细菌的筛选及鉴定[J].山地农业生物学报,2012,31(6):529-523.
[17]孙晓鸣,王萍,黄云飞.几株芽孢杆菌产消化酶分析[J].江西畜牧兽医杂志,2009(2):13-15.
[18]吴敏峰,耿秀蓉,祝小,等.产纤维素酶芽孢杆菌的分离鉴定[J].饲料工业,2006,27(20):21-24.
[19]秦瑶,王苇,郭秉娇,等.2株枯草芽孢杆菌对大肠杆菌和沙门氏菌的体外抑菌试验研究[J].中国畜牧兽医,2014,41(1):207-209.
[20]王城,赵杰,李旋亮,等.枯草芽孢杆菌对禽舍分离致病菌的抑菌作用研究[J].中国农学通报,2010,26(3):23-26.
[21]潘宝海,孙冬岩,孙笑非,等.枯草芽孢杆菌对大肠杆菌生物颉颃作用的研究[J].饲料研究,2014(7):40-41.
[22]窦茂鑫,赵迪,王蕾,等.猪源枯草芽孢杆菌的分离鉴定及生物学特性研究[J].养殖与饲料,2012(4):11-14.

