亚临床甲状腺功能减退对糖尿病合并代谢综合征主要组分及颈动脉硬化的影响
郭晓珍
(东南大学医学院附属江阴医院内分泌科,江苏214400)
许多研究发现亚临床甲状腺功能减退症(subclinical hypothyroidism,SCH)与2型糖尿病(T2DM)关系密切,有7%~17%的T2DM患者合并SCH。SCH患者虽在临床上无明显临床症状或临床症状轻微,但研究发现SCH是动脉粥样硬化的独立危险因素,可增加T2DM患者动脉硬化的程度[1]。同时发现其与代谢综合征(metabolic syndrome,MS)的其他各主要组分也密切相关。SCH对T2DM影响报道较多,但对T2DM合并代谢综合征患者影响国内报道不多。本研究选取2009年5月—2013年11月 T2DM合并代谢综合征患者379例进行甲状腺功能的筛查,比较SCH组与甲状腺功能正常(euthy-roidism,EUT)组患者合并代谢综合征各主要组分的区别,同时观察两组患者颈动脉硬化的情况,报告如下。
1 资料与方法
1.1 一般资料 2型糖尿病患者379例,男211例,女168例,平均年龄60.7岁。根据甲状腺功能分为甲状腺功能正常(EUT)组和亚临床甲状腺功能减退(SCH)组。入选患者SCH组35例,男14例,女21例;EUT组344例,男198例,女146例。根据1999年WHO颁布的T2DM的诊断标准和2004年中华医学会糖尿病分会提出的中国人的MS诊断标准,排除有明确心血管疾病、肝脏疾病、肾脏疾病、恶性肿瘤、妊娠、急性疾病或其他影响甲状腺功能变化的患者。严格遵循患者知情同意原则。SCH组性别与EUT组相比差异有统计学意义(P<0.01),两组的糖尿病病程、年龄、FBG、HbA1c比较差异均无统计学意义(P>0.05),见表 1。
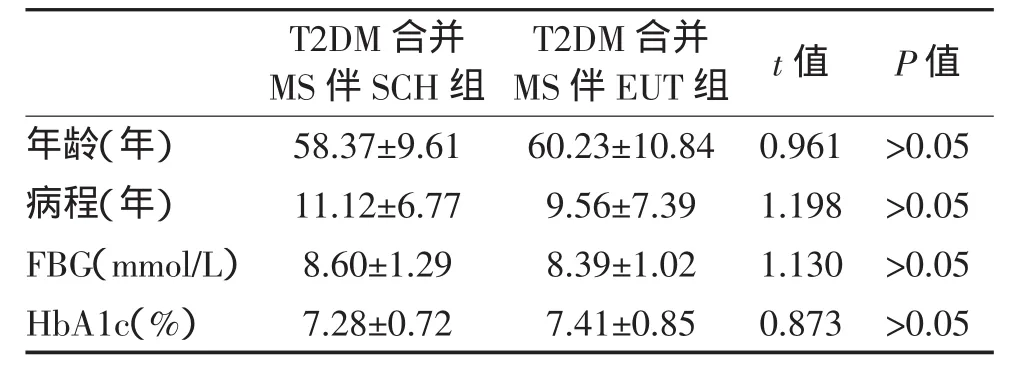
表1 两组一般临床资料比较(x¯±s)
1.2 方法 (1)患者均行身高、体重和血压等测量。计算体质量指数(BMI)=体质量(kg)/身高(m)2。取受检者隔夜禁食10小时后静脉血,采用HITACHI7600全自动生物化学分析仪(日本),测定患者空腹血糖(FBG)、血清总胆固醇(TC)、甘油三酯(TG)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)等指标。采用放射免疫法测定促甲状腺素(TSH)、游离三碘甲腺原氨酸(FT3)、游离甲状腺素(FT4)。采用亲和色谱法测定糖化血红蛋白(HbA1c)。(2)采用 HDI5000 Sono CT型彩色超声诊断仪,探头频率为5~12MHz。以双侧颈动脉内中膜厚度(CIMT)平均值,作为评价颈动脉粥样硬化严重程度的指标。颈动脉正常:血管内膜面光滑,CIMT≤0.8mm,血管内中膜增厚为0.9mm≤CIMT≤1.3mm;斑块的诊断标准为突出于内膜表面或CIMT>1.3mm。
1.3 统计学处理 所有数据均使用SPSS 17.0统计软件处理。计量资料以均数±标准差(x¯±s)表示,两均数比较用t检验;计数资料的组间比较采用χ2检验。P<0.05表示差异有统计学意义。
2 结 果
2.1 两组合并MS组分比较 T2DM合并代谢综合征伴SCH组肥胖和超重、血脂紊乱的发生率明显高于T2DM合并代谢综合征伴EUT组,差异均有统计学意义(P<0.05)。两组患者高血压的发生率比较差异无统计学意义(P>0.05)。两组合并MS主要组分比较见表2。
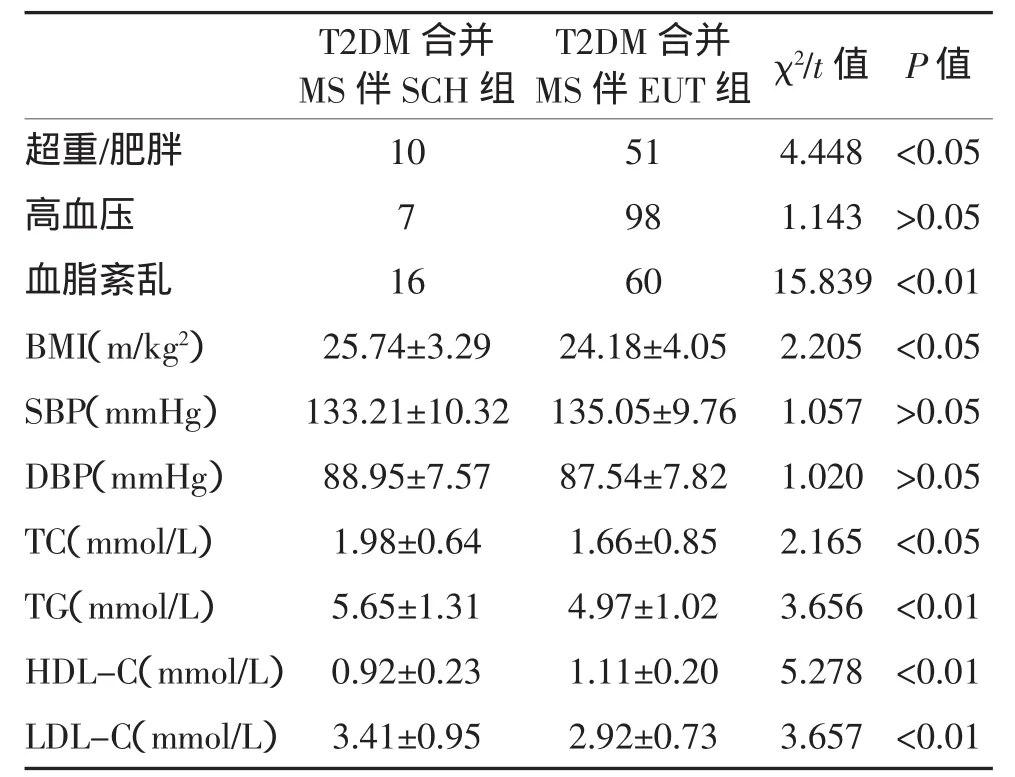
表2 两组合并MS主要组分的比较(例,x¯±s)
2.2 两组颈动脉超声结果比较 T2DM并MS伴SCH组颈动脉内中膜厚度(CIMT)1.08±0.18mm,T2DM并MS伴EUT组颈动脉内中膜厚度(CIMT)0.97±0.13mm,两组比较差异有统计学意义(t=4.583,P<0.01)。T2DM并MS伴SCH组颈动脉斑块数量18个,T2DM并MS伴EUT组颈动脉斑块数量113个,与T2DM合并代谢综合征伴EUT组比较差异有统计学意义(χ2=4.849,P<0.05)。
3 讨 论
近年来随着对T2DM血管并发症研究的深入,人们逐渐认识到T2DM大血管病变的危险因素,T2DM绝不仅是高血糖的疾病,而是大多表现为代谢综合征[2-3]。许樟荣等[4]报告在T2DM人群中代谢综合征患病率高达76.7%。
糖尿病人群中甲状腺功能异常的患病率是非糖尿病人群的2~3倍,同时发现甲状腺功能异常者以甲状腺功能减退为主,尤以SCH最常见[5]。本研究379例T2DM合并代谢综合征患者中,合并SCH35例(9.23%),其中女性明显多于男性,提示女性SCH发病率高于男性。与吴景程等[6]研究结果相比SCH发病率明显偏低,考虑与入选患者的年龄、饮食习惯、遗传背景和入选标准的差异有关。许多关于SCH与血脂关系的研究结果不一致,但大多数对照研究发现TC、LDL-C及TG水平在SCH患者较EUT组人群升高,而HDL-C水平降低。
本研究发现T2DM合并代谢综合征伴SCH组肥胖和超重发生率明显高于EUT组。可能是由于高水平的TSH激活了磷脂酰肌醇3激酶(PI3K)-蛋白激酶B-p70S6激酶途径,并且通过增加磷酸酪氨酸蛋白水平,使磷脂酰肌醇3激酶的调节水平放大4倍,增加了脂肪细胞的存活率[7]。也可能与TSH通过cAMP依赖性蛋白激酶A途径升高白介素-6mRNA水平,增加转录,使脂肪细胞分泌IL-6增加,从而促进体重的增加[8]。
颈动脉硬化病变不仅能引起缺血性脑血管病变,同时也能反映冠状动脉粥样硬化程度及心肌缺血性改变。目前颈动脉高频超声检查已成为研究大血管硬化进展的窗口。本研究将颈动脉超声检查结果中CIMT及颈动脉斑块的数量作为观察SCH对T2DM合并代谢综合征大血管病变影响的主要指标。
研究证实高水平的TSH可通过影响血脂代谢、炎症反应、血流动力学及内皮功能等机制促进T2DM患者动脉粥样硬化的发展,导致大血管病变发生率增加。Monzani等[9]的研究发现颈动脉内中膜厚度在SCH患者中比EUT组明显增高,而且内中膜厚度与年龄、TSH及LDL-C呈正相关。Ochs等[10]关于SCH对心血管事件影响的meta分析认为,SCH是心血管疾病发生的独立危险因素。本研究结果进一步提示T2DM合并代谢综合征伴SCH患者颈动脉内中膜厚度增厚,同时颈动脉斑块的数量增多,均明显高于对照组,表明SCH对T2DM合并代谢综合征患者的颈动脉内中膜厚度的变化和斑块的形成有重要的影响。
[1]刘长江,赵咏桔.亚临床甲状腺功能减退与动脉粥样硬化[J].中国实用内科杂志,2007,27(15):1223-1225.
[2]Kahn CR,Chen L,Cohen SE.Unraveling the mechanism of action of thiazolidinediones[J].JClin Invest,2000,106(11):1305-1307.
[3]Isomaa B,Almgren P,Tuomi T,et al.Cardiovascularmorbidity and mortality associated with themetabolic syndrome[J].Diabetes Care,2001,24(4):683-689.
[4]许樟荣,王玉珍,刘彦君,等.2型糖尿病合并不同数目代谢综合征组分患者的临床表现及对血管病变的影响[J].中国糖尿病杂志,2006,14(4):250-252.
[5]Chubb SA,Davis WA,Inman Z,et al.Prevalence and progression of subclinical hypothyroidism in women with type 2 diabetes:the Fremantle Diabetes Study[J].Clin Endocrinol(Oxf),2005,62(4):480-486.
[6]吴景程,李晓华,彭永德,等.2型糖尿病患者中亚临床甲状腺功能减退症与糖尿病血管并发症关系的研究[J].中华内分泌代谢杂志,2010,26(4):304-306.
[7]Bell A,Gagnon A,Dods P,et al.TSH signaling and cell survival in 3T3-L1 preadipocytes[J].Am JPhysiol Cell Physiol,2002,283(4):C1056-C1064.
[8]Jiang W,Miyamoto T,Kakizawa T,et al.Expression of thyroid hormone receptor alpha in 3T3-L1 adipocytes;triiodothyronine increases the expression of lipogenic enzyme and triglyceride accumulation[J].J Endocrinol,2004,182(2):295-302.
[9]Monzani F,Caraccio N,Kozàkowà M,et al.Effect of levothyroxine replacement on lipid profile and intima-media thickness in subclinical hypothyroidism:a double-blind,placebocontrolled study[J].JClin Endocrinol Metab,2004,89(5):2099-2106.
[10]Ochs N,Auer R,Bauer DC,etal.Meta-analysis:subclinical thyroid dysfunction and the risk for coronary heart disease andmortality[J].Ann Intern Med,2008,148(11):832-845.

