阿托伐他汀对急性心肌梗死大鼠内皮微颗粒及心肌细胞凋亡的影响*
李强,郭壮波,伍光颖,李超霞,钟志勇
(暨南大学医学院第四附属医院,广州市红十字会医院1急诊科,2检验科,广东 广州 510220;3广东省医学动物实验中心,广东 佛山 528248)
阿托伐他汀对急性心肌梗死大鼠内皮微颗粒及心肌细胞凋亡的影响*
李强1△,郭壮波1,伍光颖1,李超霞2,钟志勇3
(暨南大学医学院第四附属医院,广州市红十字会医院1急诊科,2检验科,广东 广州 510220;3广东省医学动物实验中心,广东 佛山 528248)
目的:探讨阿托伐他汀(atorvastatin,AT)对大鼠急性心肌梗死早期内皮微颗粒(endothial microparticles,EMP)及心肌细胞凋亡的影响。方法:将24只雄性SD大鼠随机分为假手术组(sham组)、心肌梗死组(MI组)和阿托伐他汀心肌梗死组(MI+AT组),每组8只。采用冠状动脉结扎制作急性心肌梗死大鼠模型。分别在造模后2 h和24 h采外周血检测肌酸激酶同工酶(creatine kinase-MB,CK-MB)、心肌肌钙蛋白T(cardiac troponin T,cTnT)和EMP,其中循环EMP用流式细胞术检测。通过TUNEL检测心肌细胞凋亡情况。结果:造模后2 h,MI组大鼠的CK-MB表达水平较sham组大鼠显著升高(P<0.05);MI组及MI+AT组大鼠EMP表达水平及心肌细胞凋亡率上升,显著高于sham组(P<0.05)。造模后24 h,MI组大鼠EMP表达水平显著高于sham组(P<0.05);MI+ AT组大鼠CK-MB、cTnT、EMP表达水平及心肌细胞凋亡率较MI组显著降低(P<0.05)。此外,MI组大鼠的CKMB表达水平在造模后24 h较造模后2 h显著升高(P<0.05);MI+AT大鼠CK-MB、cTnT和EMP表达水平在造模后24 h较2 h显著下降(P<0.05)。结论:AT可降低大鼠急性心肌梗死时的EMP水平和心肌细胞凋亡率,提示AT对内皮功能有保护作用。
急性心肌梗死;阿托伐他汀;内皮微颗粒;心肌细胞凋亡
急性心肌梗死(acute myocardial infarction,AMI)是冠状动脉粥样硬化性心脏病极为严重的临床类型之一,是多种因素导致冠状动脉内斑块糜烂及破裂、血栓形成、血管痉挛,使冠状动脉血供急剧减少甚至中断,心肌发生严重而持久的缺血导致的心肌坏死。目前认为血管内皮功能障碍正是动脉粥样硬化发生的中心环节和始动因素。内皮微颗粒(endothelial microparticles,EMP)是内皮细胞激活或凋亡时产生的膜性小囊泡,其水平的升高在包括冠状动脉疾病在内的多种病理状态中可见,并反映内皮功能受损及临床预后不良。他汀类作为抗动脉粥样硬化药物能明显降低冠心病患者心血管事件的发生率,已广泛应用于冠心病患者的二级预防,但其改善冠心病患者预后的机制尚未完全阐明。本研究拟建立大鼠急性心肌梗死模型,通过检测心肌梗死不同时段EMP、肌酸激酶同工酶(creatine kinase-MB,CK-MB)和心肌肌钙蛋白T(cardiac troponin T,cTnT)的动态变化,并统计大鼠心肌缺血后心肌细胞凋亡率,揭示阿托伐他汀(atorvastatin,AT)对大鼠急性心肌梗死时内皮的保护作用。
材料和方法
1 实验动物、试剂和仪器
健康雄性SPF级SD大鼠24只,由广东省医学实验动物中心提供(实验动物使用许可证号为SYXK粤2013-0002)。根据体重随机分为sham组、MI组、MI+AT组,每组8只。
阿托伐他汀钙片(辉瑞爱尔兰药品公司);CKMB试剂盒(武汉华美生物科技);cTnT ELISA Kit (武汉华美生物科技);CD31-PE荧光标记单抗、CD42b-FITC荧光标记单抗(BD)。
7020 型全自动生化分析仪(HITACHI),流式细胞仪(BD)。
2 方法
2.1 实验分组Sham组:大鼠进行开胸与穿线处理,但不结扎阻断冠状动脉左前降支;MI组:在sham组的基础上,结扎冠状动脉左前降支,结扎后不再复通;MI+AT组:在MI组的基础上,给予阿托伐他汀溶液灌胃。
2.2 给药方法造模前1 h进行灌胃给药,根据大鼠体重,灌胃剂量均为10 mg/kg,剂量参考文献选择[1];sham组、MI组大鼠给予等量的0.9%氯化钠溶液;MI+AT组大鼠给予阿托伐他汀溶液。
2.3 心肌梗死模型构建大鼠腹腔注射3%戊巴比妥钠(60 mg/kg)麻醉,剃去颈部和胸部毛发,以75%乙醇擦拭消毒颈部皮肤后作正中切口约1 cm,暴露气管,进行气管插管并连接呼吸机(呼吸机工作条件为呼吸频率70~80次/min,潮气量7~8 mL,呼吸时间比为1∶1)。待大鼠呼吸与呼吸机同步后,测量大鼠心电图基础值。取心电图无异常大鼠,消毒胸部皮肤后,剪开皮肤并钝性分离胸部肌肉直至暴露肋骨,剪开第3、4根肋骨,扩开大鼠胸腔,充分暴露心脏。用眼科镊撕开大鼠心脏心包膜,寻找大鼠左心耳与动脉圆锥,在左心耳与动脉圆锥之间穿入0号线,结扎,以心电图Ⅱ导联检测,有典型缺血心电图改变者判定冠状动脉左前降支成功结扎,可进行下一步缝合或者复通操作。大鼠模型建立完毕后,逐层缝合大鼠肌肉和皮肤,挤出大鼠胸腔空气后撤去呼吸机,归笼单笼饲养。
2.4 标本的采集与处理Sham组以穿线为造模结束时点,MI组、MI+AT组,以复通冠状动脉左前降支为造模结束时点,在造模结束后2 h及24 h,采集大鼠血清与血浆(柠檬酸钠抗凝),于-80℃保存备用,随后解剖取大鼠心脏,以4%中性甲醛固定。
2.5 指标测定依照ELISA Kit说明书检测血清cTnT含量;用全自动生化分析仪检测血清CK-MB含量;用流式细胞术[2]检测血浆EMP含量,样本加抗CD31-PE(按1∶100比例用PBS稀释)和抗CD42b-FITC(按1∶200比例用PBS稀释)各10 μL,然后加入50 μL血浆样本,避光孵育30 min,孵育结束后加入1 000 μL PBS混匀待测,设定上机吸样速度为中速,吸样时间为30 s,上机检测EMP,记录CD31+/ CD42b-为EMP的量。
2.6 TUNEL法检测心肌细胞凋亡大鼠造模后2 h及24 h分别处死,取心脏固定后制备石蜡切片,依照TUNEL细胞凋亡检测试剂盒(Roche)进行操作,DAB染色,光学显微镜下每张切片选取具有代表性的3个视野,使用IPP 6.0软件分别对凋亡细胞(细胞核呈棕色)和正常细胞进行计数,统计不同大鼠心肌细胞的凋亡率。
3 统计学处理
各组数据以均数±标准差(mean±SD)表示,采用SPSS 21.0统计软件进行单因素方差分析。以P<0.05为差异有统计学意义。
结果
1 各组CK-MB的活性比较
造模后2 h,MI组大鼠的CK-MB水平较sham组大鼠显著升高(P<0.05);造模后24 h,MI+AT组CK-MB水平较MI组显著下降(P<0.05);各组间比较,sham组大鼠的CK-MB水平在造模后2 h与造模后24 h比较无显著差异(P>0.05);MI组大鼠的CK-MB水平在造模后24 h较2 h显著升高,差异有统计学意义(P<0.05);MI+AT大鼠的CK-MB水平在造模后24 h较2 h显著下降(P<0.05),见表1。
2 ELISA检测各组大鼠cTnT的水平
造模后2 h,MI组大鼠血清中cTnT的水平和Sham组相近,无显著差异(P>0.05);MI+AT组大鼠的cTnT水平高于MI组,但无显著差异(P>0.05)。造模后24 h,MI组大鼠血清中cTnT的水平高于sham组,但差异无统计学意义(P>0.05);MI +AT组大鼠的cTnT水平低于MI组,差异有统计学意义(P<0.05)。各组间cTnT的水平造模后2 h与造模后24 h的比较,sham组、MI组大鼠的cTnT水平在造模后2 h和造模后24 h比较均无明显变化(P>0.05),MI+AT组大鼠的cTnT水平在造模后24 h较造模后2 h降低,差异有统计学意义(P<0.05),见表1。
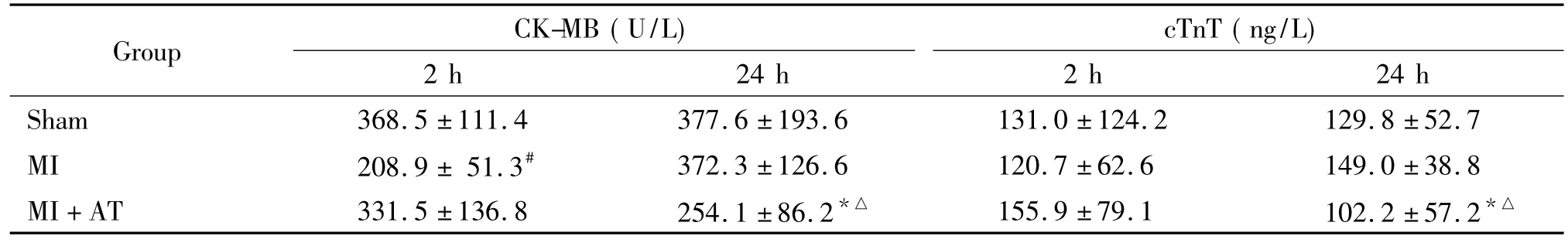
表1 各组大鼠CK-MB和cTnT的表达Table 1.The expression of CK-MB and cTnT in different groups(Mean±SD.n=8)
3 流式细胞术检测各组大鼠EMP水平
造模后2 h,MI组及MI+AT组大鼠的EMP水平上升,显著高于sham组(P<0.05)。造模24 h后,MI组大鼠的EMP水平显著高于sham组(P< 0.05)。各组间比较,造模后24 h,MI+AT组大鼠的EMP水平较MI组显著降低,有统计学差异(P<0.05);MI+AT组大鼠的EMP水平造模后24 h较造模后2 h明显降低(P<0.05),见图1、2及表2。
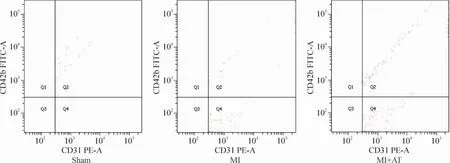
Figure 1.Scatter plot of flow cytometry analysis for EMP at 2 h after modeling in sham group,MI group and MI+AT group.图1 造模后2 h sham组、MI组和MI+AT组EMP的流式细胞图
4 TUNEL检测各组SD大鼠心肌细胞凋亡率
造模后2 h MI组及MI+AT组大鼠的心肌细胞凋亡率分别较sham组显著提高,差异有统计学意义(P<0.05)。造模后24 h,MI+AT组大鼠的心肌细胞凋亡率比MI组显著降低(P<0.05)。各组间比较,MI+AT组大鼠的心肌细胞凋亡率造模后24 h较造模后2 h明显降低(P<0.05),见图3、4及表2。
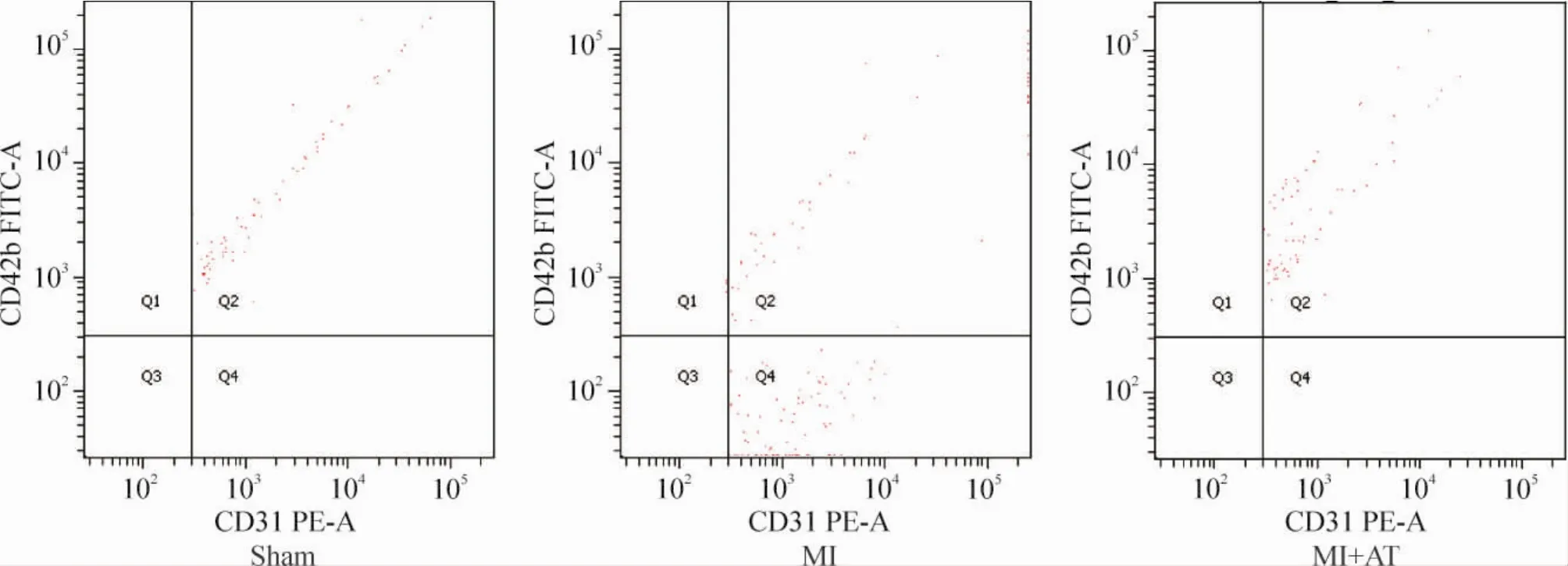
Figure 2.Scatter plot of flow cytometry analysis for EMP at 24 h after modeling in sham group,MI group and MI+AT group.图2 造模后24 h sham组、MI组和MI+AT组的EMP流式细胞术散点图
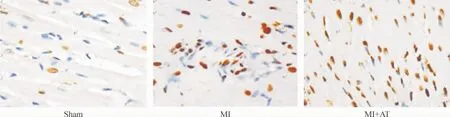
Figure 3.TUNEL staining at 2 h after modeling in sham group,MI group and MI+AT group(×400).图3 造模后2 h sham组、MI组和MI+AT组大鼠心肌的TUNEL染色结果
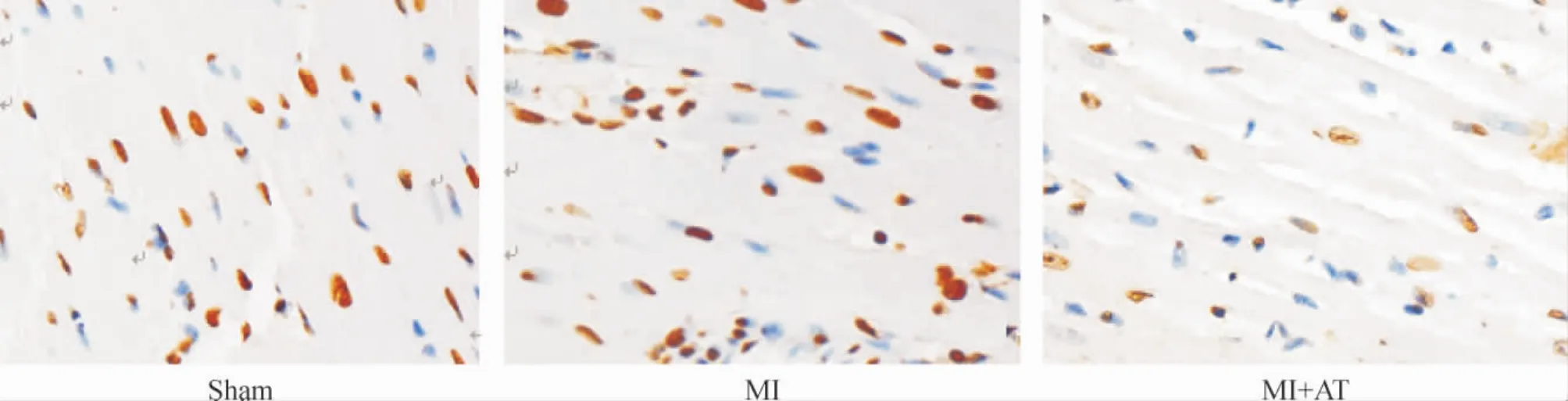
Figure 4.TUNEL staining at 24 h after modeling in sham group,MI group and MI+AT group(×400).图4 造模后24 h sham组、MI组和MI+AT组大鼠心肌的TUNEL染色结果
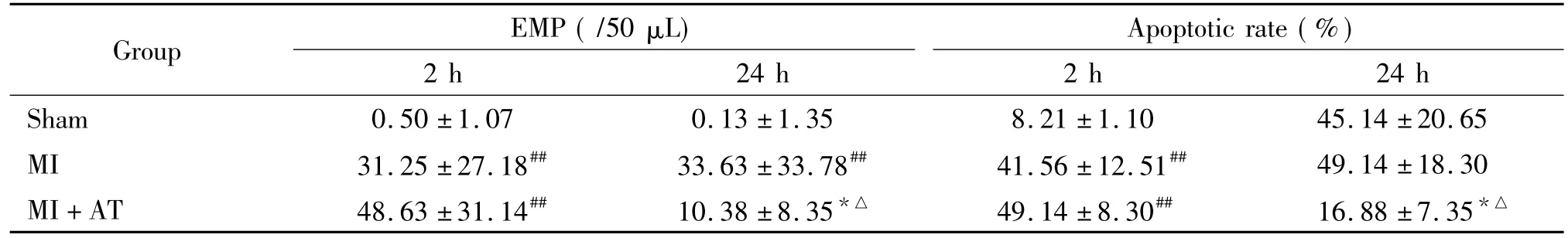
表2 各组大鼠血清中EMP水平和心肌细胞凋亡率的比较Table 2.The expression of EMP and myocardial apoptotic rate in different groups(Mean±SD.n=8)
讨论
EMP是内皮细胞激活或凋亡时释放的一种膜性囊泡。目前普遍认为EMP不仅是存在于循环中的内皮细胞脱落的碎片,而且通过其表面不同蛋白分子与靶细胞相互作用起到信息传递的作用,并参与到许多与循环系统疾病相关的病理生理过程中。近年来研究发现,EMP在急性冠脉综合征患者中显著升高,而内皮功能受损恰恰与EMP升高相关[3-7],表明EMP能直接反映内皮细胞在受到不良因素刺激时生物表型的变化,是敏感、可靠的内皮功能障碍的生化指标[8]。因此稳定细胞膜降低EMP的释放被认为是血管疾病治疗的有效靶点[9]。他汀类药物是指南强烈推荐的调脂药,不仅具有调脂作用,还具有抑制炎症反应和氧化应激、改善血管内皮功能、稳定动脉粥样硬化斑块等多种独立于调脂作用外的“多效性”[10-11]。阿托伐他汀属于他汀类调脂药,是具有较强的羟甲基戊二酰辅酶A还原酶抑制作用的新一代他汀类药物。近年研究发现,阿托伐他汀除具有调脂作用外还通过影响细胞信号转导及细胞增殖,发挥改善内皮功能失调、抑制炎症反应、抗血栓形成、稳定斑块等心血管保护作用[12]。阿托伐他汀还被证实可以通过增强和改善冠状动脉及外周动脉内皮细胞的功能,从而减少梗死面积[13],使缺血心肌组织得到有效再灌注。有关阿托伐他汀的ARMYDARECAPTURE研究[14]证实了他汀类药物为冠心病患者带来的益处。本研究显示造模后2 h,MI组及MI +AT组大鼠的EMP水平上升,显著高于sham组,而造模后24 h,MI+AT组大鼠的EMP水平及心肌细胞凋亡率较MI组则显著降低,减轻EMP介导的内皮损伤过程,提示阿托伐他汀有助于改善内皮功能。
凋亡是一种多基因控制的自身程序性细胞死亡。早期的研究表明,它是心肌梗死早期细胞死亡的主要方式及梗死面积扩大的原因之一,并认为其心肌梗死面积的大小与心肌梗死后心肌细胞凋亡程度有关。Sun等[15]发现缺血后再灌注时间延长能降低心肌梗死面积,这种心脏保护作用可能是通过抗凋亡机制实现的。故如能早期干预,抑制心肌细胞凋亡,有利于改善MI后的心室功能。既往已有研究报道阿托伐他汀可以显著改善心肌梗死后心肌细胞凋亡、心肌重塑及心脏功能,发挥它降脂外的多重作用[16-19]。阿托伐他汀通过抑制MI心肌细胞凋亡,提高左心室射血分数,降低左心室舒张末内径,改善心脏功能。Bäcklund等[16]还发现梗死相关动脉闭塞组患者的心肌细胞凋亡率显著高于梗死相关动脉开通组,梗死相关动脉通畅后显著降低急性MI后晚期的心肌细胞凋亡率,显著改善了MI患者的长期预后。Sun等[15]发现缺血后再灌注时间延长能降低心肌梗死面积,这种心脏保护作用可能是通过抗凋亡机制实现的。本研究显示MI+AT组大鼠的CK-MB、cT-nT表达水平及心肌细胞凋亡率均显著低于MI组,也证实了AT的心血管保护作用。
本研究因条件所限,仅通过检测血浆EMP及心肌细胞凋亡率的变化阐述阿托伐他汀对内皮的保护作用。近来有研究表明,血管内皮细胞的前体内皮祖细胞(endothelial progenitor cells,EPCs)在血管受损的条件下可被诱导归巢至受损血管区域,进而参与血管新生修复[20]。EPCs数量已被作为心血管疾病诊断及预后评价的重要指标[21]。而阿托伐他汀有增加循环系统EPCs数量、促进损伤内皮修复、稳定动脉粥样硬化斑块等功能,如能联合检测血浆EMP及EPCs数量或可进一步证实阿托伐他汀的内皮保护作用,有望成为今后的研究热点。
[1]Tawfik MK,Ghattas MH,Abo-Elmatty DM,et al.Atorvastatin restores the balance between pro-inflammatory and anti-inflammatory mediators in rats with acute myocardial infarction[J].Eur Rev Med Pharmacol Sci,2010,14 (6):499-506.
[2]Lacroix R,Robert S,Poncelet P,et al.Standardization of platelet-derived microparticle enumeration by flow cytometry with calibrated beads:results of the International Society on Thrombosis and Haemostasis SSC Collaborative workshop[J].J Thromb Haemost,2010,8(11):2571-2574.
[3]Bernal-Mizrachi L,Jy W,Jimenez JJ,et al.High levels of circulating endothelial microparticles in patients with acute coronary syndromes[J].Am Heart J,2003,145 (6):962-970.
[4]Jung C,Sörensson P,Saleh N,et al.Circulating endothelial and platelet derived microparticles reflect the size of myocardium at risk in patients with ST-elevation myocar-dial infarction[J].Atherosclerosis,2012,221(1):226-231.
[5]程飞,陶军,冯鉴强,等.内皮微颗粒通过NADPH氧化酶损伤内皮细胞功能[J].南方医科大学学报,2010,30(5):1103-1106.
[6]易铁慈,郑乐民,李建平.微颗粒与急性冠脉综合征[J].中国病理生理杂志,2013,29(7):1332-1338.
[7]Pirro M,Schillaci G,Bagaglia F,et al.Microparticles derived from endothelial progenitor cells in patients at different cardiovascular risk[J].Atherosclerosis,2008,197 (2):757-767.
[8]Inzhutova AI,Larionov AA,Petrova MM,et al.Stabilization of cellular membranes as a target of vascular therapy[J].Kardiologiia,2011,51(4):52-55.
[9]张艳丛,张永进.阿托伐他汀的临床应用及研究进展[J].医学综述,2012,18(16):2616-2618.
[10]Sadowitz B,Maier KG,Gahtan V.Basic science review: Statin therapy——Part I:the pleiotropic effects of statins in cardiovascular disease[J].Vasc Endovascular Surg,2010,44(4):241-251.
[11]Swenne CA.Beyond lipid lowering:pleiotropic effects of statins in heart failure[J].Neth Heart J,2013,21(9): 406-407.
[12]Curtis AM,Zhang L,Medenilla E,et al.Relationship of microparticles to progenitor cells as a measure of vascular health in a diabetic population[J].Cytometry B Clin Cytom,2010,78(5):329-337.
[13]Landmesser U,Engberding N,Bahlmann FH,et al.Statin-induced improvement of endothelial progenitor cell mobilization,myocardial neovascularization,left ventricular function,and survival after experimental myocardial infarction requires endothelial nitric oxide synthase[J].Circulation,2004,110(14):1933-1939.
[14]Di Sciascio G,Patti G,Pasceri V,et al.Efficacy of atorvastatin reload in patients on chronic statin therapy undergoing percutaneous coronary intervention:results of the ARMYDA-RECAPTURE(atorvastatin for reduction of myocardial damage during angioplasty)randomized trial[J].J Am Coll Cardiol,2009,54(6):558-565.
[15]Sun H,Guo T,Liu L,et al.Ischemic postconditioning inhibits apoptosis after acute myocardial infarction in pigs[J].Heart Surg Forum,2010,13(5):305-310.
[16]Bäcklund T,Palojoki E,Saraste A,et al.Sustained cardiomyocyte apoptosis and left ventricular remodelling after myocardial infarction in experimental diabetes[J].Diabetologia,2004,47(2):325-330.
[17]GuoY,He J,Wu J,et al.Locally overexpressing hepatocyte growth factor prevents post-ischemic heart failure by inhibition of apoptosis via calcineurin-mediated pathway and angiogenesis[J].Arch Med Res,2008,39(2): 179-188.
[18]严广东,李自成,李健豪.阿托伐他汀对糖尿病大鼠急性心肌梗死后心功能及HGF/c-Met信号通路的影响[J].中国病理生理杂志,2014,30(4):658-663.
[19]Baldi A,Abbate A,Bussani R,et al.Apoptosis and postinfarction left ventricular remodeling[J].J Mol Cell Cardiol,2002,34:(2)165-174.
[20]周芝兰,王林静,刘革修,等.红景天苷对内皮祖细胞功能及其PI3K/Akt通路的影响[J].中国病理生理杂志,2014,30(7):1192-1195.
[21]Matsue Y,Suzuki M,Nagahori W,et al.Endothelial dysfunction measured by peripheral arterial tonometry predicts prognosis in patients with heart failure with preserved ejection fraction[J].Int J Cardiol,2013,168(1):36-40.
Effects of atorvastatin on release of endothelial microparticles and myocardial apoptosis in rats with acute myocardial infarction
LI Qiang1,GUO Zhuang-bo1,WU Guang-ying1,LI Chao-xia2,ZHONG Zhi-yong3
(1Department of Emergency,2Clinical Laboratory,Guangzhou Red Cross Hospital,the Fourth Affiliated Hospital,School of Medicine,Jinan University,Guangzhou 510220,China;3Medical Laboratory Animal Center of Guangdong Province,Foshan 528248,China.E-mail:wliqiang@163.com)
AIM:To investigate the effect of atorvastatin(AT)on the release of endothelial microparticles (EMP)and myocardial apoptosis in the rats with myocardial infarction.METHODS:SD male rats(n=24)were randomly divided into 3 groups:sham operation(sham)group,myocardial infarction(MI)group and MI+AT group.The rat model of acute myocardial infarction was prepared by coronary artery ligation.At 2 h and 24 h after modeling,the peripheral blood was collected to detect creatine kinase-MB(CK-MB)and cardiac troponin T(cTnT).The circulating levels of EMP were measured by flow cytometry.The myocardial apoptosis was detected by terminal deoxynucleotidyl transferasemediated dUTP nick end labeling(TUNEL)assay.RESULTS:At 2 h after modeling,the level of CK-MB was significantly increased in MI group compared with sham group,and the level of EMP and the myocardial apoptotic rate were significantly increased in MI group and MI+AT group compared with sham group.At 24 h after modeling,the level of EMP was significantly increased in MI group compared with sham group.The levels of CK-MB,cTnT,EMP and the myocardial apoptotic rate were significantly decreased in MI+AT group compared with MI group.Moreover,the level of CK-MB in MI group was significantly increased at 24 h compared with that at 2 h after modeling.The levels of CK-MB,cTnT and EMP were significantly decreased in MI+AT group at 24 h compared with those at 2 h after modeling.CONCLUSION:Ator-vastatin may reduce the level of EMP and the myocardial apoptotic rate in the rats with acute myocardial infarction,indicating that atorvastatin plays a role in protecting endothelium.
Acute myocardial infarction;Atorvastatin;Endothelial microparticles;Cardiomyocyte apoptosis
R542.2+1;R363
A
10.3969/j.issn.1000-4718.2015.02.030
1000-4718(2015)02-359-06
2014-12-03
2014-12-16
广东省科技计划(No.2012B061700016)
△通讯作者Tel:020-34403518;E-mail:wliqiang@163.com

