不同灌注速度及方法对大鼠膀胱容量、压力及神经传入电活动测定的影响*
赖焕玲,梁志健,吴清和,黄萍,操红缨
(广州中医药大学,广东 广州 510006)
·实验技术·
不同灌注速度及方法对大鼠膀胱容量、压力及神经传入电活动测定的影响*
赖焕玲,梁志健,吴清和,黄萍,操红缨△
(广州中医药大学,广东 广州 510006)
目的:探讨不同灌注速度及方法对大鼠膀胱容量、压力及神经传入电活动测定的影响。方法:SD雌性大鼠随机分为2组,分别选用尿道插管法及膀胱顶造瘘法,以50、100、200和400 μL/min的速度进行灌注,以尿动力仪观察灌注过程中膀胱容量及压力的变化,以多通道生理记录仪检测灌注过程中膀胱神经传入电活动的变化。结果:采用插管法进行灌注测得最大放电频率,其随速度的升高呈上升趋势;膀胱漏尿点压(BLPP)和最大膀胱排尿压(MVP)随着灌注速度的升高而增大;各灌注速度下膀胱最大容量(MBC)无显著变化。造瘘法以各速度测得最大放电频率均无显著变化;其MBC随速度升高呈下降趋势,且在200及400 μL/min灌注时显著降低;其BLPP及MVP无明显变化。2种方法相比,放电频率基线值无显著差异,以100、200和400 μL/min进行灌注时造瘘法测得的膀胱最大放电频率均低于插管法;以不同速度灌注,造瘘法测得的MBC均比插管法小;而以50和100 μL/min进行灌注时,造瘘法测得的压力比插管法高。结论:插管法以不同速度进行灌注并未对膀胱容量造成明显变化,但其膀胱压力及神经放电频率随速度升高,使用此法应根据研究目的选择灌注速度;采用造瘘法在200及400 μL/ min的灌注速度时,膀胱容量明显减少,故采用该法时建议以<200 μL/min的速度进行灌注。
灌注速度;尿道插管术;膀胱顶造瘘;膀胱容量;膀胱压力
膀胱的主要生理功能是储尿与排尿。正常的膀胱感觉功能是实现膀胱储尿和排尿生理过程的基础,且该过程有赖于神经系统、膀胱逼尿肌和尿道括约的协调。膀胱感觉功能实际上是大脑皮层对来自下尿路传入神经冲动的主观感知和整合[1],主要对下尿路牵张所引起的膨胀、温度、痛觉和伤害性刺激产生主观感知。排尿欲是非自主控尿转向自主控尿的标志。膀胱的机械敏感性所表现出的静态和动态的变化以及在绝对水平上对刺激和尿液形成的反应依赖于逼尿肌在低速膨胀过程中的适应性变化。膀胱膨胀(充盈)速度可以严重影响膀胱测压的测定结果[2]。国际尿控协会规定,人体采用慢速充盈既速度低于10 mL/min作为生理性充盈。Shea等[3]的研究曾采用生理盐水以100 μL/min的速度模拟生理性充盈进行大鼠膀胱灌注。膀胱内灌注药物[4]已经是一种治疗膀胱相关疾病的手段,适宜的灌注速度及灌注方法不仅能正确反映实验结果且能为膀胱相关疾病的治疗服务,因此,本实验根据国内外研究设计了4个速度:50、100、200和400 μL/min,并采用目前国内外常用的尿动力学[5]膀胱测压方法——插管法[6-7]及造瘘法[8]进行灌注,观察灌注过程中膀胱容量、压力及膀胱传入电活动的变化,拟初步探讨灌注的不同速度及方法对膀胱功能的影响,为获得适宜的灌注速度及灌注方法提供依据。
材料和方法
1 动物、主要药品与仪器
SPF级SD大鼠,雌性,200~220 g,由广州中医药大学实验动物中心提供,许可证号为SCXK(粤) 2013-0020,合格证号为440005900000600,饲养在温度(24±2)℃、湿度50%~70%的条件下,采用12 h昼夜间断照明。动物实验设施许可证号为SYXK (粤)2013-0085,使用证明号为00058727。
氯化钠(天津市大茂化学试剂厂);乌拉坦(国药集团化学试剂有限公司);BL420E型多通道生理信号采集处理系统(成都泰盟科技仪器有限公司);Laborie UDS-94型尿动力学检查仪(Laborie);WZ-50C6型微量注射泵(浙江史密斯医学仪器有限公司);测压导管(测压导管为测压接头连接3F硬膜外麻醉导管改造而成)。
2 方法
2.1 动物分组20只雌性SD大鼠随机分为2组:造瘘法组采取导管经膀胱顶造瘘导入膀胱的方法进行灌注;插管法组采取导管沿尿道导入膀胱的方法进行灌注。每组10只,2组动物均以50、100、200和400 μL/min的速度分别进行灌注。
2.2 盆神经分离[3,8]大鼠以25%乌拉坦(1.0 g/ kg)全麻后,打开腹腔,轻轻推开腹腔肠道暴露后腹膜和盆腔腹膜。玻璃分针划开后腹膜,沿盆神经节向中枢端分离盆神经(盆神经直径约0.3 mm,长10~15 mm)。将肠道及一侧子宫轻推至另一侧后,可在髂血管分叉下方和膀胱后方形成一个类似三角形的凹陷空间,滴加37℃温石油浸泡盆神经,保温防干,同时便于将盆神经悬挂于电极而不与周围组织接触。分离好的大鼠盆神经悬挂于双钩铂丝电极,参考电极连接于皮肤。通过加热兔台将大鼠肛温控制在37℃左右。
2.3 膀胱容量、压力及神经放电记录打开BL420E型多通道生理信号采集处理系统,设置好实验模式及测量参数后,连接电极。用螺旋调节器调整记录电极与盆神经的接触位置,观察盆神经放电波形,以信噪比高、基线稳定、干扰少为效果佳。记录盆神经传入放电前,用眼科弯镊夹断盆神经中枢端,减少中枢端传入电活动的影响[6]。
2.3.1 插管法沿尿道口缓缓导入3F导管。3F导管通过T型转换接头连接膀胱测压管和灌注管,测压管连接尿动力仪压力传感器,灌注管连接微量灌注泵。排空膀胱,待盆神经自发传入放电恢复至基线水平,再按不同速度由低到高进行灌注(每次灌注前需待神经放电恢复至基线水平),记录灌注时间、膀胱压力及神经传入电活动情况,具体方法如下:体内置零,灌注前记录盆神经自发传入放电基线开启微量注射泵向膀胱内灌注生理盐水,此过程中注意观察尿道外口有无液体溢出。液体溢出时记录的膀胱压即为膀胱漏尿点压(bladder leak point pressures,BLPP);同时停止灌注,观察膀胱压力曲线,记录其峰值,即为最大膀胱排尿压(maximum voiding pressure,MVP);记录此过程中膀胱神经传入电活动,即盆神经放电,包括基线值及最大放电频率,直至排尿过程完成后停止。计算膀胱最大容量(maximum bladder capacity,MBC),MBC=灌注时间×灌注速度。
2.3.2 造瘘法于膀胱顶切开一小口,插入3F导管,2-0丝线结扎。此过程中注意切勿夹持膀胱以免对膀胱壁造成损伤。导管连接T型转换接头,其余操作与插管法一致。
2.4 参数设置模式(生物电),采样频率(10 kHz),扫描速度(2 s/div),灵敏度(20 μV),时间常数(0.001 s),高频滤波(3 kHz),50 kHz陷波(打开)。
2.5 放电频率分析用BL420E多通道生理信号采集处理系统,以1∶1信噪比为阈值分析;记录60 s内的基线平均放电频率作为基线值(baseline),充盈过程中放电频率最大值(10 s内平均值)作为最大放电频率(maximum firing frequency)。首先确认盆神经的定位及功能是否正常,对膀胱进行缓慢灌注(30 μL/min)充盈,可诱发盆神经传入放电频率进行性增强,表明盆神经无明显损伤,放电活动正常。
3 统计学处理
计量资料用均数±标准差(mean±SD)表示,采用SPSS 17.0统计软件进行完全随机设计的单因素方差分析(One-way ANOVA);以P<0.05为差异有统计学意义。
结果
1 膀胱传入电活动变化
研究结果显示,2种方法比较,虽然造瘘法以50 μL/min的速度灌注时最大放电频率及膀胱容量均比插管法低,但未显示出显著差异,而其它速度灌注时与插管法比较,各指标比较差异均有统计学意义(表1),因此本研究以最低速度50 μL/min模拟生理性充盈速度,作为对照。
采用插管法以100 μL/min进行灌注,动物排尿过程中最大放电频率与采用50 μL/min进行灌注时无显著变化,而采用200 μL/min及400 μL/min进行灌注时,其最大放电频率显著升高(P<0.05)。采用造瘘法以100、200和400 μL/min进行灌注,其最大放电频率与采用50 μL/min进行灌注时均无显著变化。2种方法相比,其基线值无显著差异,但采用造瘘法以100、200和400 μL/min进行灌注,其最大放电频率与插管法相比,均显著下降(P<0.05),见表1。
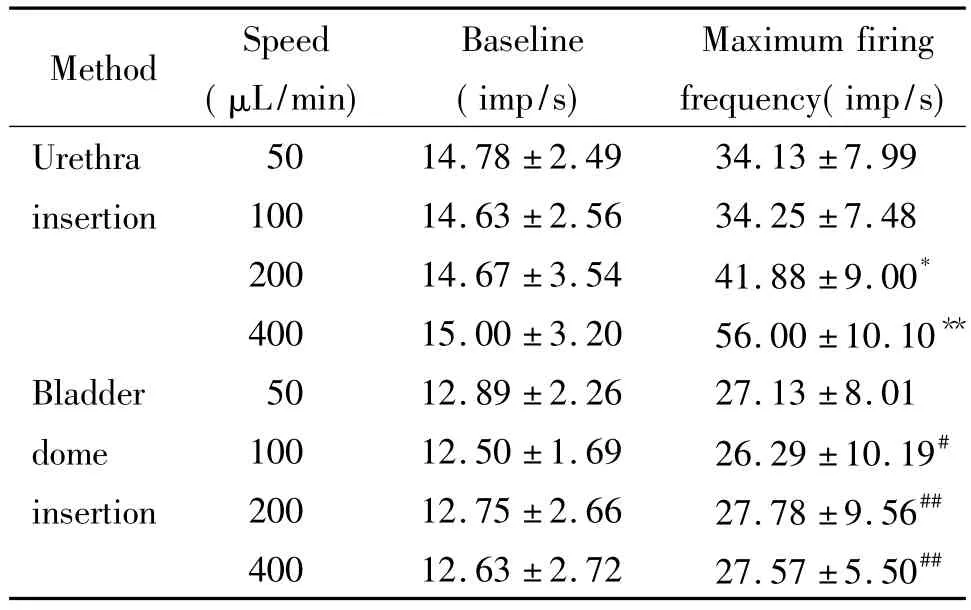
表1 不同灌注速度及方法对盆神经放电的影响Table 1.The effects of different speeds and ways of instillation on pelvic nerve firing(Mean±SD.n=10)
2 膀胱容量、压力变化
采用插管法以不同速度进行灌注,其膀胱最大容量比较稳定,无显著变化;膀胱压力(BLPP及MVP)随着灌注速度的升高而增大,其中以100、200和400 μL/min进行灌注组比50 μL/min灌注组均高(P<0.01)。采用造瘘法随灌注速度增加,其MBC呈下降趋势,其中以400 μL/min灌注组MBC比50 μL/min灌注组少(P<0.05);膀胱压力(BLPP及MVP)在不同灌注速度间无明显变化。2种方法比较,造瘘法不同灌注速度测得的MBC均比插管法小(P<0.05),但在50和100 μL/min灌注组,造瘘法测得的压力比插管法高(P<0.05),见表2。
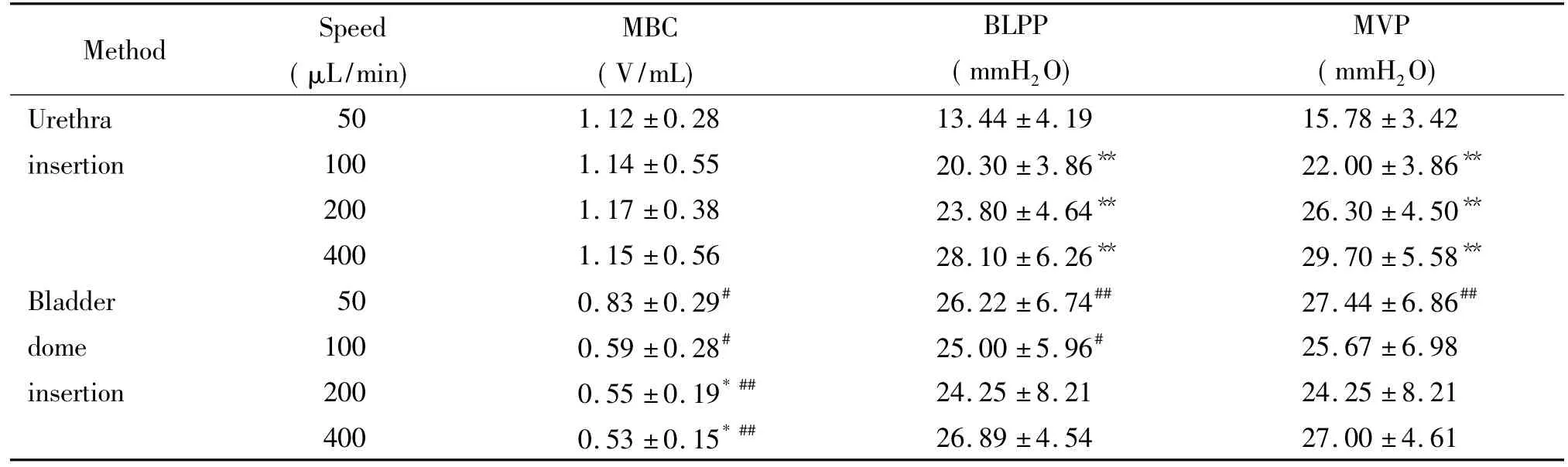
表2 不同灌注速度及方法对膀胱容量、压力的影响Table 2.The effects of different speeds and ways of instillation on bladder volume and pressure(Mean±SD.n=10)
3 插管法和造瘘法在不同速度下盆神经放电及膀胱压力图的变化
2种方法的不同速度灌注生理盐水,所记录的神经放电频率变化均呈现出的反应模式为:放电频率先于压力达到峰值,而后压力达到峰值时,放电频率趋于平台或下降[3]。从图1、2中的尿动力曲线图可见,采用插管法以不同速度进行灌注,储尿期逼尿肌收缩峰比造瘘法要少,可能因为完整的膀胱壁结构有助于降低逼尿肌对容量刺激产生的不稳定收缩,防止排尿提前。
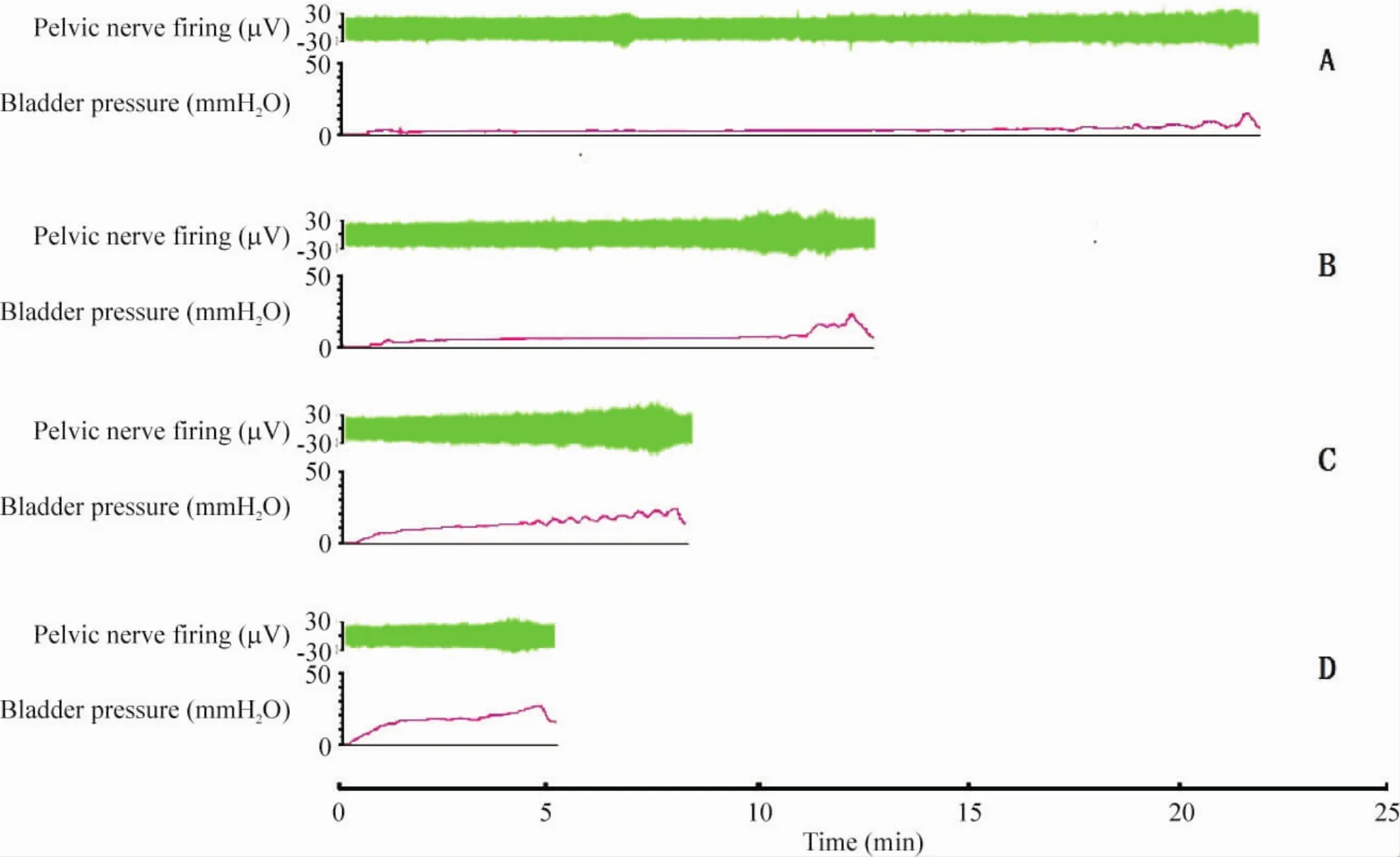
Figure 1.The diagram of pelvic nerve firing and bladder pressure with urethra insertion.A:speed at 50 μL/min;B:speed at 100 μL/min;C:speed at 200 μL/min;D:speed at 400 μL/min.图1 插管法不同速度盆神经放电及膀胱压力示意图
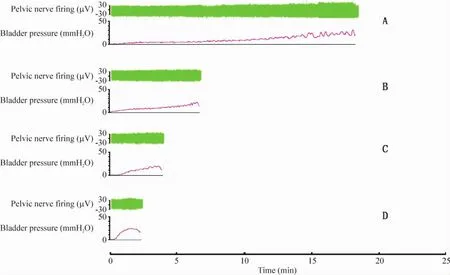
Figure 2.The diagram of pelvic nerve firing and bladder pressure with bladder dome insertion.A:speed at 50 μL/min;B:speed at 100 μL/min;C:speed at 200 μL/min;D:speed at 400 μL/min.图2 造瘘法不同速度盆神经放电及膀胱压力示意图
讨论
膀胱由复杂且分布广泛的神经支配。交感神经和副交感神经传出纤维分别通过下腹神经和盆腔内脏神经传至膀胱和尿道[2]。在膀胱测压充盈膀胱过程中,可能存在3种明显的感觉[9]:充盈初感、初排尿欲、强烈排尿欲。充盈初感可能只有在人为膀胱充盈时才被发觉,此感觉很弱,不恒定,可能依赖于皮层对其感受的波动。与排尿欲相关的冲动走行于盆神经内,排尿欲望来自于膀胱壁的牵张。而逼尿肌的收缩在储尿排尿过程中也并非一成不变的[10]:在充盈过程中,逼尿肌的收缩表现为肌源性及自发性,发生在逼尿肌细胞或小单元;而排尿过程中,逼尿肌呈整体协调性收缩,以排空膀胱。膀胱充盈越快,膀胱顺应性越低,逼尿肌不稳定收缩发生率越高,有效膀胱容量越小,越容易产生赝象[2]。Daly等[11]研究结果也显示高速灌注对逼尿肌形成的刺激,可能使其产生不稳定收缩或排尿提前。本研究以50 μL/min的速度作为参照,结果显示,插管法不同速度对膀胱容量未造成明显影响,而逐渐升高的充盈速率使得盆神经放电及膀胱内压的升高,与国外研究结果相符[11]。而采用造瘘法的动物,其膀胱容量随着速度的增加呈下降趋势,且在200及400 μL/min的速度显示出显著差异;其膀胱压力及神经传入电活动在各速度间无明显变化。可能由于造瘘手术使得神经体细胞沉默单元的机械刺激感受器及化学刺激感受器受损所致[3]。
Birder等[12]采用动物在麻醉状态下进行实验,显示出C纤维对造瘘膀胱膨胀虽无明显的反应,但认为感觉传入电活动的小幅度降低可能是由C纤维引起的,其机制尚未明确。Yoshimura等[13]研究表明,膀胱的感觉神经传入纤维包含有髓鞘的Aδ纤维和无髓鞘的C纤维。在鼠膀胱已证实Aδ纤维仅对膀胱充盈产生反应,表现为容量受体特性,对膀胱黏膜的牵张敏感。C纤维相对Aδ纤维具有高机械性阈值特征[14]。Szallasi等[15]研究发现无髓鞘感觉神经纤维(C纤维)存在多种活性成分,其中包括降钙素基因相关肽(calcitoningene-relatedpeptide,CGRP)、P物质、血管活性肠肽、Y物质、ATP以及乙酰胆碱等。虽然Gabella等[16]发现膀胱顶黏膜没有传入轴突,但造瘘带来的痛觉和伤害可能会激活C纤维致使逼尿肌对容量敏感性增加,提前收缩以完成排尿过程减少膀胱负荷,此机制仍需进一步研究;另一方面由于造瘘破坏了膀胱肌丛(myovesical plexus)的完整性可能导致兴奋的过度传入或抑制不足引起膀胱自主性活动过度增强[17]。
生理性水平的膨胀不会对膀胱容量造成影响,但如果灌注速率超出了正常膀胱尿液形成的速率水平,便会形成非生理性的伤害。病理性的改变如因疾病改变了逼尿肌对容量的适应性或因逼尿肌过度敏感,会使其在较小的尿液容量水平时产生收缩[11]。结合实验结果及已有研究,插管法以不同速度进行灌注并未对膀胱容量造成明显变化,但其膀胱内压及神经放电频率随速度升高,使用此法应根据研究目的选择灌注速度;而造瘘法以50和100 μL/min速度进行灌注对膀胱传入电活动、容量及膀胱内压无统计学差异,200及400 μL/min的灌注速度使膀胱容量明显下降,可见该速度已经造成了非生理性刺激,使用此法进行研究应选用低于200 μL/min的速度进行灌注。
[1]方强,宋波.膀胱感觉功能的形成机制及检测方法研究进展[J].临床泌尿外科杂志,2006,21(8): 638-640.
[2]郭应禄,杨勇.尿失禁[M].第1版.济南:山东科学技术出版社,2003.
[3]Shea VK,Cai R,Crepps B,et al.Sensory fibers of the pelvic nerve innervating the rat’s urinary bladder[J].J Neurophysiol,2000,84(4):1924-1933.
[4]李云飞,丁国富,蔡志强等.豚鼠糖尿病性膀胱病逼尿肌中c-kit mRNA和蛋白的表达变化及意义[J].中国病理生理杂志,2010,26(2):345-348.
[5]车宪平,韩瑞发,肖劲逐,等.冬凌草甲素和冬凌草多糖膀胱灌注治疗C57BL/6小鼠膀胱肿瘤的疗效及机制[J].中国病理生理杂志,2010,26(7):1410-1412,1415.
[6]赖焕玲,邱琼华,陈洁君,等.缩泉丸提取部位的尿动力学研究[J].广州中医药大学学报,2014,31(1): 85-89.
[7]邝兆进,操红缨,吴清和,等.两种不同膀胱测压方法对不同年龄大鼠尿动力测定的影响[J].中国药理学通报,2012,28(4):581-585.
[8]唐伟,宋波,周占松,等.树酯毒素对前列腺炎大鼠盆神经传入放电的影响[J].重庆医学,2007,36 (10):940-941.
[9]Wyndaele JJ.The normal pattern of perception of bladder filling during cystometry studied in 38 young healthy volunteers[J].J Urol,1998,160(2):479-481.
[10]Andersson KE,Arner A.Urinary bladder contraction and relaxation:physiology and pathophysiology[J].Physiol Rev,2004,84(3):935-986.
[11]Daly D,Rong W,Chess-Williams R,et al.Bladder afferent sensitivity in wild-type and TRPV1 knockout mice[J].J Physiol,2007,583(2):663-674.
[12]Birder LA,Nakamura Y,Kiss S,et al.Altered urinary bladder function in mice lacking the vanilloid receptor TRPV1[J].Nat Neurosci,2002,5(9):856-860.
[13]Yoshimura N.Lower urinary tract symptoms(LUTS)and bladder afferent activity[J].Neurourol Urodyn,2007,26 (6 Suppl):908-913.
[14]Ito T,Sakakibara R,Yamamoto T,et al.Urinary dysfunction and autonomic control in amyloid neuropathy[J].Clin Auton Res,2006,16(1):66-71.
[15]Szallasi A,Gunthorpe MJ.Peripheral TRPV1 receptors as targets for drug development:new molecules and mechanisms[J].Curr Pharm Des,2008,14(1):32-41.
[16]Gabella G,Davis C.Distribution of afferent axons in the bladder of rats[J].J Neurocytol,1998,27(3): 141-155.
[17]Drake MJ,Mills IW,Gillespie JI.Model of peripheral autonomous modules and a myovesical plexus in normal and overactive bladder function[J].Lancet,2001,358 (9279): 401-403.
Effects of different speeds and ways of instillation on bladder volume,pressure and pelvic nerve firing
LAI Huan-ling,LIANG Zhi-jian,WU Qing-he,HUANG Ping,CAO Hong-ying
(
Guangzhou University of Chinese Medicine,Guangzhou 510006,China.E-mail:hycao@gzucm.edu.cn)
AIM:To investigate the changes of bladder volume,pressures and pelvic nerve firing induce by different speeds and ways of instillation.METHODS:Female SD rats(n=20)were randomly divided into 2 groups.The rats in group A was performed using 3-F polyethylene tubing inserted into the bladder through the urethra.The rats in group B were performed using 3-F tubing inserted into the dome of the bladder and secured by silk suture.The rats in both groups were infused with saline into the bladder at different speeds of 50,100,200 and 400 μL/min.The changes of bladder volume and pressure were recorded by urodynamic measuring devices.The changes of pelvic nerve firing during instillation were recorded by multi-channel physiologic recorder.RESULTS:In group A,the maximum firing frequency,bladder leak point pressure(BLPP)and maximum voiding pressure(MVP)were increased with the increase in the instillation speed.No significant difference of the maximum bladder capacity(MBC)at different speeds was observed.In group B,the maximum firing frequency had no significant difference at different speeds.MBC was decreased with the increase in the instillation speed,and exhibited significant decrease at 200 and 400 μL/min.No significant difference of BLPP and MVP at different speeds was observed.Compared with group A,the maximum firing frequency and MBC in group B significantly decreased at different speeds.However,BLPP and MVP in group B were higher than those in group A at the speeds of 50 and 100 μL/min.CONCLUSION:Different instillation speeds with the method of group A will not change the bladder volume but influence the pelvic nerve firing,so the process of method A may take various speeds according to different aims.However,process of method B at the speed of over 200 μL/min may not be good to MBC,thus instillation under 200 μL/min is re-commended.
Instillation speed;Urethral catheterization;Bladder dome insertion;Bladder capacity;Bladder pressure
R33-33
A
10.3969/j.issn.1000-4718.2015.02.034
1000-4718(2015)02-379-06
2014-09-28
2014-10-29
国家自然科学基金资助项目(No.81202982)
△通讯作者Tel:020-39358086;E-mail:hycao@gzucm.edu.cn

