醒脑静注射液对全脑缺血再灌注大鼠血脑屏障ZO-1表达的影响*
钟志越,李 炳,刘 明,李宏治,梁晓俊,申 捷(复旦大学附属金山医院化学伤害救治中心ICU,上海201508)
醒脑静注射液对全脑缺血再灌注大鼠血脑屏障ZO-1表达的影响*
钟志越,李炳,刘明,李宏治,梁晓俊,申捷△
(复旦大学附属金山医院化学伤害救治中心ICU,上海201508)
[摘要]目的:探讨醒脑静( XNJ)注射液对大鼠全脑缺血再灌注后血脑屏障通透性及紧密连接蛋白1( ZO-1)表达的影响。方法:采用改良Pulsinelli四血管闭塞法建立大鼠全脑缺血再灌注模型。将雄性Wistar大鼠随机分为4组,即假手术组、全脑缺血再灌注模型组、溶剂对照组和XNJ组。每组均在缺血再灌注后24 h、48 h和72 h处理。用干湿重法测定脑组织中水含量,分光光度计法检测脑组织伊文思蓝( EB)含量,Western blot检测大脑皮层的ZO-1蛋白含量。结果:缺血再灌注后24 h,模型组、溶剂对照组和XNJ组的脑组织含水量均显著高于假手术组( P<0.05),但在缺血再灌注后48 h和72 h,模型组和溶剂对照组脑组织含水量显著高于XNJ组和假手术组( P<0.05)。缺血再灌注后24 h,模型组、溶剂对照组和XNJ组大鼠脑组织内EB含量均高于假手术组( P<0.05),缺血再灌注后48 h和72 h,假手术组和XNJ组的EB含量显著低于模型组和溶剂对照组( P<0.05)。缺血再灌注后24 h,模型组、溶剂对照组和XNJ组大鼠脑皮层中的ZO-1蛋白表达水平显著低于假手术组( P<0.05),同样缺血再灌注后48 h和72 h,假手术组和XNJ组皮层中ZO-1蛋白含量显著高于模型组和溶剂对照组( P<0.05)。结论:在缺血再灌注后的48 h和72 h,醒脑静注射液对血脑屏障具有保护作用,可能与醒脑静注射液上调ZO-1蛋白的表达有关。
[关键词]醒脑静注射液;缺血再灌注;血脑屏障;紧密连接蛋白1
脑缺血再灌注往往造成一系列严重的病理生理性损伤。脑缺血后的脑水肿[1-2]包括细胞毒性( cytotoxic)和血管源性( vasogenic) 2种,前者在缺血期间已启动,属细胞内水肿,在再灌注后可继续加重。当缺血达到一定时限,脑血管内皮细胞损伤,血脑屏障( blood-brain barrier,BBB)受损,脑毛细血管通过性增加,血浆蛋白与水分外溢,细胞外液增加,造成间质性脑水肿,即谓血管源性脑水肿。因此脑缺血再灌注后所导致的血脑屏障的破坏以及通透性的增大是导致脑水肿及脑损伤的重要环节[3]。目前在临床上应对脑缺血再灌注损伤,有效控制脑水肿,减少血脑屏障的渗漏,是治疗成功的关键。醒脑静( Xingnaojing,XNJ)是在安宫牛黄丸的基础上精制而成的一种注射液,主要配方为麝香、郁金、冰片、栀子,具有清热解毒,凉血活血,开窍醒脑之效,对于脑缺血再灌注损伤有很好的疗效[4],但对其治疗机制并未进行深入研究。本研究的目的就是从脑缺血再灌注损伤后的脑水肿入手,探讨醒脑静对血脑屏障的影响,尤其是对血脑屏障紧密连接的主要构成成分紧密连接蛋白1( zonula occludens-1,ZO-1)表达的影响。
材料和方法
1材料
1.1实验动物与分组健康成年雄性Wistar大鼠216只,体重200~250 g,由上海斯莱克实验动物有限公司提供。随机分为4组,每组54只:即假手术组( sham group) ;全脑缺血再灌注模型组( model group) ;全脑缺血再灌注+溶剂对照组( solvent group) ;全脑缺血再灌注+醒脑静干预组( XNJ group)。每组又分3个时点即再灌注后24 h、48 h和72 h进行处理,每个观察点18只,分别进行脑组织中水含量测定、伊文思蓝( Evans blue,EB)染色及ZO-1蛋白检测。
1.2主要试剂与设备醒脑静注射液(无锡济民可信山禾药业股份有限公司) ; EB购自Sigma; ZO-1 I 抗( Abcam) ; Epoch酶标仪( BioTek)。
2方法
2.1大鼠全脑缺血再灌注模型的制备采用改良Pulsinelli四血管闭塞法[5]。10%水合氯醛麻醉,大鼠固定于操作台,颈后备皮、消毒,于第1颈椎水平作1~2 cm的纵形切口,分离筋膜、肌肉,暴露第1颈椎翼突孔,电凝双侧椎动脉造成椎动脉永久性闭塞,消毒缝合切口。翻转大鼠仰卧位固定,于颈前正中作切口,分离双侧颈总动脉,穿线打一活结埋于皮下备用,消毒缝合。24 h后不行麻醉固定,用无损伤微动脉夹夹闭双侧颈总动脉持续10 min,造成大鼠全脑缺血。出现瞳孔散大、翻正反射消失立即撤去动脉夹恢复脑血流,消毒缝合切口。
2.2给药模型完成后立即腹腔注射醒脑静注射液10 mL·k g-1·d-1( XNJ组) ;而solvent组于模型完成后立即腹腔注射同等量的生理盐水; model组不给予干预; sham组完成切口,分离但不结扎和凝闭血管。
2.3干湿重法测定脑组织中水含量[6]各组大鼠麻醉后,立即断头取脑,经电子天平精确称重后,放入110℃恒温干燥箱烘烤24 h至恒重( 2次称重差别<0.2 mg)后,用同一电子天平再精确称干脑组织重量,并按照Eliot干湿重法计算脑组织含水量,以百分率表示。脑含水量( %) = (湿重-干重) /湿重×100%。
2.4伊文思蓝染色检测血脑屏障通透性参照文献[7]的方法进行,从大鼠尾静脉注入2%的EB溶液( 5 mL/kg体重),5 h后麻醉左心室灌注生理盐水300 mL,取脑,做2 mm厚冠状切片,并用电子天平分别精确称其湿重后,置于二甲基甲酰胺溶液,37℃水浴48 h取出,5 000 r/min离心取上清液,并再次离心取200 μL上清液加入酶标板中,酶标仪用波长632 nm测定吸光度。称取EB 4 mg,加生理盐水至总容积25 mL,取0.3 mL加入5.7 mL二甲基甲酰胺中混匀作为第1管;倍比稀释得浓度依次为8 mg/L、4 mg/L、2 mg/L、1 mg/L、0.5 mg/L和0.25 mg/L。37℃水浴孵育48 h后比色(λ= 632 nm)测定吸光度,制作出标准曲线。
2.5Western blot检测ZO-1蛋白含量各组大鼠麻醉取脑后,取皮层脑组织匀浆后提取总蛋白,测浓度后,进行SDS-PAGE,然后转膜,经兔抗鼠I抗孵育后,加II抗孵育,化学发光后压片曝光,SYNGENE生物图像系统拍照及数据处理。
3统计学处理
实验数据以均数±标准误( mean±SEM)表示,应用SPSS 13.0软件进行统计,采用单因素方差分析( one-way ANOVA)和随机区组的t检验,以P<0.05为差异有统计学意义。
结果
1 各组大鼠在缺血再灌注后24 h、48 h和72 h脑组织中的含水量
结果如表1所示,缺血再灌注后24 h,模型组、溶剂对照组和XNJ组的脑组织含水量均高于假手术组( P<0.05)。缺血再灌注后48 h和72 h,模型组和溶剂对照组的脑组织含水量开始显著高于假手术组和XNJ组( P<0.05)。

表1 缺血再灌注后24 h、48 h和72 h各组大鼠脑组织中含水量的变化Table 1.The change of water content 24 h,48 h and 72 h after ischemia-reperfusion in brain tissue of rats( %.Mean ±SEM.n =6)
2 EB染色及EB含量测定
EB在正常情况下与血浆白蛋白结合不能着色;当脑缺血再灌注损伤后由于BBB破坏,通透性增加,EB会通过血管壁进入脑组织而着色,因此EB可作为示踪剂对BBB破坏进行定量评价。实验结果显示模型组、溶剂对照组和XNJ组均有EB的渗漏,说明均有血脑屏障的破坏。在缺血再灌注后24 h,模型组、溶剂对照组和XNJ组大鼠脑组织内EB含量均显著高于假手术组( P<0.05)。缺血再灌注后48 h和72 h,模型组和溶剂对照组的脑组织内EB含量显著高于假手术组和XNJ组( P<0.05),且XNJ组又显著高于假手术组( P<0.05),见图1。
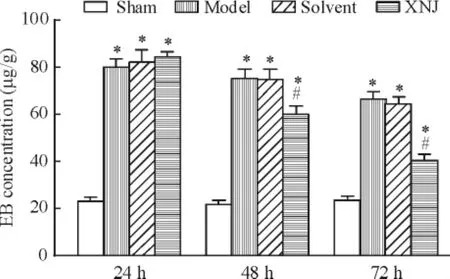
Figure 1.Change of EB 24 h,48 h and 72 h after ischemiareperfusion in brain tissue of rats.Mean±SEM.n = 6.*P<0. 05 vs sham group;#P<0.05 vs model group.图1 缺血再灌注后24 h、48 h和72 h各组大鼠脑组织中EB含量的变化
3 缺血再灌注后24 h、48 h和72 h各组大鼠皮层中ZO-1的表达情况
缺血再灌注后24 h,模型组、溶剂对照组和XNJ组大鼠脑皮层中的ZO-1蛋白表达水平显著低于假手术组( P<0.05)。缺血再灌注后48 h和72 h,模型组和溶剂对照组皮层中的ZO-1蛋白表达水平仍比较低,但XNJ组的ZO-1蛋白表达逐渐升高。经统计学比较,缺血再灌注后48 h和72 h,模型组和溶剂对照组皮层中的ZO-1蛋白表达水平显著低于假手术组和XNJ组( P<0.05),但XNJ组又显著低于假手术组( P<0.05),见图2。
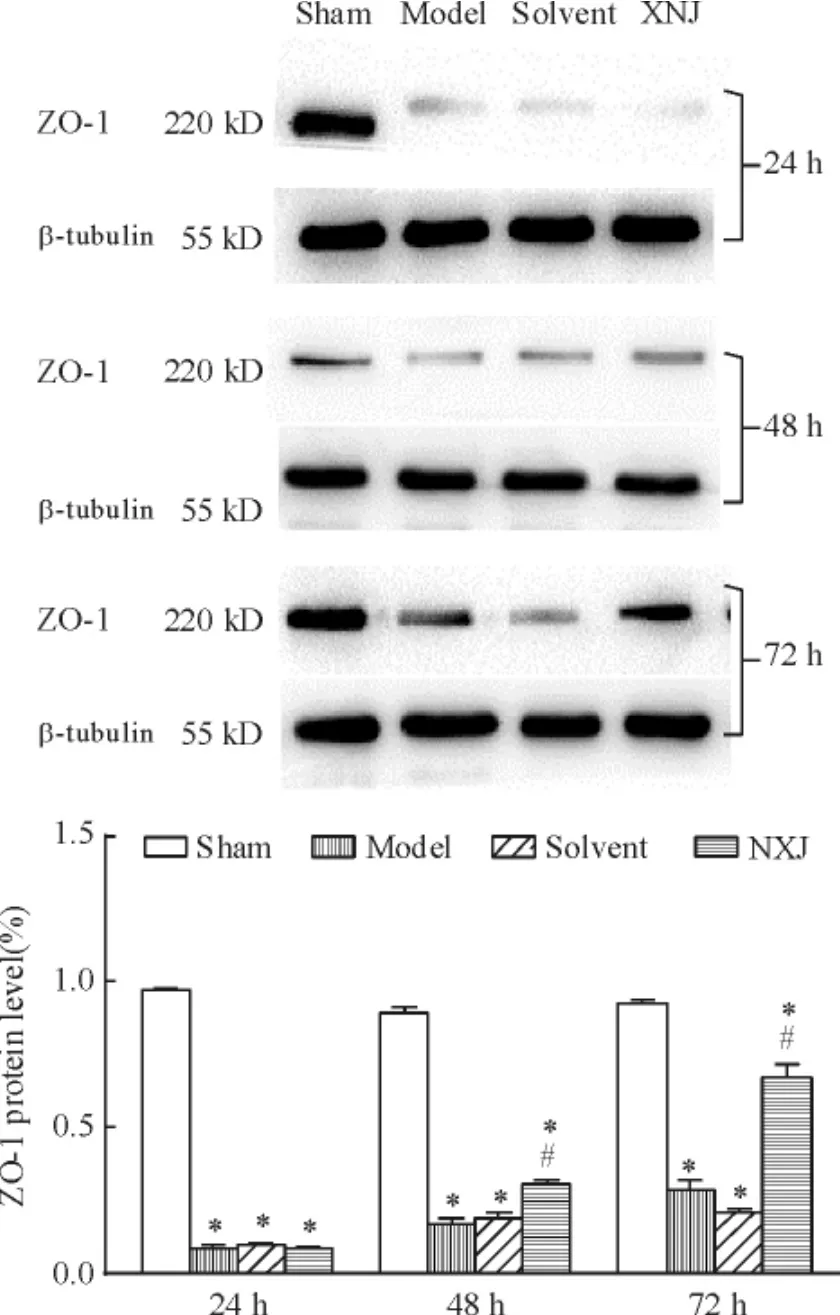
Figure 2.Change of ZO-1 24 h,48 h and 72 h after ischemiareperfusion in brain cortex of rats.Mean±SEM.n = 6.*P<0. 05 vs sham group;#P<0.05 vs model group.图2 缺血再灌注后24 h、48 h和72 h各组大鼠脑皮层中ZO-1蛋白表达的变化
讨论
血脑屏障[8]是主要由脑微血管内皮细胞( brain microvascular endothelial cell,BMEC)、细胞间紧密连接( tight junction,TJ)、连续的基底膜和基底外侧的星形胶质细胞终足等结构构成,并保持中枢神经系统内环境的相对稳定。脑缺血再灌注可导致血脑屏障破坏,通透性增加,炎性因子及有害物质进入脑组织,引起脑水肿形成,从而加重脑损伤。脑缺血发生的时候,伊文思蓝出现在缺血区,表明BBB通透性增加;脑组织相对含水量可用于估计大鼠脑水肿的程度。张红波等[9]通过腹腔注射醒脑静小剂量组( 3. 33 mL/kg)、中剂量组( 6.66 mL/kg)、大剂量组( 10 mL/kg)初步观察发现,醒脑静注射液对脑组织的保护作用存在较明显的量效关系。本实验采用腹腔注射醒脑静注射液10 mL·kg-1·d-1,结果显示:大鼠全脑缺血再灌注后24 h,模型组、溶剂对照组和XNJ组的脑组织含水量均显著高于假手术组,但在缺血再灌注后48 h和72 h,模型组和溶剂对照组的脑组织含水量显著高于XNJ组和假手术组。缺血再灌注后24 h,模型组、溶剂对照组和XNJ组大鼠脑组织内伊文思蓝( EB)含量均高于假手术组,缺血再灌注后48 h和72 h,假手术组和XNJ组的EB含量显著低于模型组和溶剂对照组。提示全脑缺血再灌后出现脑水肿和血脑屏障的通透性增加,醒脑静有稳定血脑屏障通透性、减轻脑水肿的作用。
血脑屏障的物质转运一般有2种途径:跨细胞途径和细胞旁途径。细胞间紧密连接是BBB最主要的物质结构基础,它能够封闭内皮细胞顶部的细胞间隙,阻止细胞外的大分子物质经细胞间隙进入组织内,是细胞间的通透屏障,通过细胞旁路径调控水、离子和大分子物质的跨膜转运。血脑屏障细胞旁途径是主要通过调节ZO-1、occludin和claudin-5等紧密连接相关蛋白和黏附连接蛋白等结构,开放紧密连接,增加血脑屏障的通透性[10]。Preston等[11]通过计算BBB对大分子示踪剂和水分子示踪剂通透性的转运常数发现,大鼠短暂性脑缺血再灌注后BBB通透性的增加主要是由TJ开放导致,而并非是胞饮转运增强。ZO-1是紧密连接的重要结构蛋白,不仅表达于紧密连接,也表达于黏附连接,对紧密连接的形成和定位都有重要作用,研究表明ZO-1的缺失会导致紧密连接结构的破坏,其水平的高低与BBB的开放、关闭关系密切[8],实验通过Western blot检测ZO-1蛋白的表达显示,缺血再灌注后24 h,模型组、溶剂对照组和XNJ组大鼠脑皮层中的ZO-1蛋白表达水平显著低于假手术组,同样缺血再灌注后48 h和72 h,假手术组和XNJ组皮层中的ZO-1蛋白含量显著高于模型组和溶剂对照组。提示全脑缺血再灌后ZO-1蛋白表达水平下降,醒脑静能使表达降低的ZO-1蛋白显著上调,起到了保护BBB的作用,这可能是醒脑静注射液发挥对脑缺血再灌注后BBB保护作用的机制之一。醒脑静射液对其它紧密连接相关蛋白是否有影响待进一步研究。
醒脑静注射液是临床常用的中成药急救药品,该药具有醒脑开窍、清热凉血、行气活血和解热止痛等功效[12],静脉给药后可通过血脑屏障直接作用于中枢神经系统,具有兴奋中枢、解热、镇痛、抑菌、抗炎、保肝的药效。本实验表明,醒脑静能上调ZO-1蛋白的表达,稳定血脑屏障通透性,减轻脑水肿。
[参考文献]
[1]王耀明,莫雪安,童萼塘,等.脑缺血再灌注后大鼠血脑屏障通透性的荧光定量分析[J].中国病理生理杂志,2002,18( 8) : 1020-1022.
[2]Kiening KL,van Landeghem FK,Schreiber S,et al.Decreased hemispheric aquaporin-4 is linked to evolving brain edema following controlled cortical impact injury in rats[J].Neurosci Lett,2002,324( 2) : 105-108.
[3]Liu Y,Wang D,Wang H,et al.The protective effect of HET0016 on brain edema and blood-brain barrier dysfunction after cerebral ischemia/reperfusion[J].Brain Res,2014,1544: 45-53.
[4]李芳君,谢少玲.醒脑静注射液对大鼠脑缺血-再灌注损伤的保护作用[J].中药材,2011,34( 7) : 1111-1113.
[5]Pulsinelli WA,Brierley JB.A new model of bilateral hemispheric ischemia in the unanesthetized rat[J].Stroke,1979,10( 3) : 267-272.
[6]Ren C,Gao M,Dornbos D,et al.Remote ischemic postconditioning reduced brain damage in experimental ischemia/reperfusion injury[J].Neurol Res,2011,33( 5) : 514-519.
[7]Huang P,Zhou CM,Qin-Hu,et al.Cerebralcare Granuleattenuates blood-brain barrier disruption after middle cerebral artery occlusion in rats[J].Exp Neurol,2012,237( 2) : 453-463.
[8]Mark KS,Davis TP.Cerebral microvascular changes in permeability and tight junctions induced by hypoxia-reoxygenation[J].Am J Physiol Heart Circ Physiol,2002,282 ( 4) : H1485-H1494.
[9]张红波,代建,张宾辉.醒脑静注射液对脑缺血再灌注氧化损伤的实验研究[J].浙江中医药大学学报,2006,30( 3) : 233-237.
[10]Abbott NJ,Patabendige AA,Dolman DE,et al.Structure and function of the blood-brain barrier[J].Neurobiol Dis,2010,37( 1) : 13-25.
[11]Preston E,Foster DO.Evidence for pore-like opening of blood-brain barrier following forebrain ischemia in rats [J].Brain Res,1997,761( 1) : 4-10.
[12]张路晗,向金莲,程睿,等.醒脑静注射液的药效学研究[J].华西药学杂志,2001,16( 6) : 429-431.
Effects of Xingnaojing injection on expression of ZO-1 in blood-brain barrier after global ischemia-reperfusion
ZHONG Zhi-yue,LI Bing,LIU Ming,LI Hong-zhi,LIANG Xiao-jun,SHEN Jie
( Intensive Care Unit,Chemical Injury Treatment Center,Jinshan Hospital,Fudan University,Shanghai 201508,China.E-mail: j1999sh@163.com)
[ABSTRACT]AIM: To investigate the effect of Xingnaojing ( XNJ) injection on the permeability of blood-brain barrier ( BBB) and zonula occludens-1 ( ZO-1) protein expression after global ischemia-reperfusion in rats.METHODS: Improved Pulsinelli four-vessel occlusion method was adopted to establish the global ischemia-reperfusion model in the rats.Male Wistar rats were randomly divided into sham group,model group,solvent group and XNJ group.The observations were conducted at the time points of 24 h,48 h and 72 h after ischemia reperfusion.The water content of the brain tissues was determined by dry-wet weight method,while the Evans blue ( EB) content of brain tissue was detected by spectrophotometry.The protein levels of ZO-1 in the cerebral cortex were analyzed by Western blot.RESULTS: The water contents in the brain tissues in model group,solvent group and XNJ group were significantly higher than those in sham group ( P<0.05) 24 h after ischemia reperfusion.However,the brain water contents in model group and solvent group were significantly higher than those in XNJ group and sham group ( P<0.05) 48 h and 72 h after ischemia reperfusion.The EB contents in the brain tissues in model group,solvent group and XNJ group were entirely higher than that in sham group 24 h after ischemia reperfusion ( P<0.05).The EB contents in sham group and XNJ group were significantly lower than those in model group and solvent group 48 h and 72 h after ischemia reperfusion ( P<0.05).The protein expression of ZO-1 in the rat cerebral cortex in model group,solvent group and XNJ group was significantly lower than that in sham group 24 h after ischemia-reperfusion ( P<0.05).Similarly,48 h and 72 h after ischemia reperfusion,ZO-1 protein level in the cortex in sham group and XNJ group was significantly higher than that in model group and solvent group ( P<0.05).CONCLU-book=1321,ebook=177SION: At 48 h and 72 h after global ischemia-reperfusion,Xingnaojing injection play a protective role in blood-brain barrier and this role may be associated with the increase in ZO-1 protein expression by Xingnaojing injection.
[KEY WORDS]Xingnaojing injection; Ischemia-reperfusion; Blood-brain barrier; Zonula occludens-1 protein
通讯作者△Tel: 021-34189990; E-mail: j1999sh@163.com
*[基金项目]上海市卫生局中医药科研基金资助项目( No.2012J018B)
[收稿日期]2014-10-14[修回日期]2015-04-24
[文章编号]1000-4718( 2015)07-1320-04
[中图分类号]R363. 2
[文献标志码]A
doi:10.3969/j.issn.1000-4718.2015.07.030

