盐胁迫对狼尾蕨体细胞耐盐突变体生长和生理生化特性的影响
梁丽建,叶晓青,邓衍明,贾新平,孙晓波
(1.江苏省农业科学院 园艺研究所,江苏 南京 210014;2.江苏省农业科学院 农业生物技术研究所,江苏 南京210014)
土壤盐渍化是当今农业生产上的重要危害之一,它不仅严重的影响了作物产量,也在一定程度上制约了农业的可持续发展。目前,全世界约有22.1%的农业用地正遭受到盐害[1],我国约有盐渍土2 700万hm2[2],并随着生态环境的恶化、盲目过量的施用化肥和不合理地开发利用,土壤盐渍化在进一步扩大。利用体细胞筛选技术培育、选育耐盐植物品种是开发利用盐碱地的一种有效方法。近年来,通过体细胞突变筛选技术已筛选获得水稻、番茄、甘薯等多种植物的耐盐变异体[3-5]。然而,利用体细胞突变筛选技术获得的耐盐突变体在抗性、产量、育性等方面也存在不协调的问题[6],因此,通过对耐盐突变体材料形态和生理生化功能上差别的鉴定,可为判断耐盐突变体提供一些依据。
狼尾蕨(Davallia bullata)作为水龙骨目骨碎补科多年生匍匐草本蕨类植物,具有极高的观赏价值。筛选具有高耐盐特性的狼尾蕨品种对改善盐碱地绿化景观、利用和治理盐碱地具有十分重要的意义。本实验室前期以狼尾蕨无菌苗叶片为外植体,通过体细胞耐盐筛选获得了NY-4、NY-5和NY-6 3个突变体再生株系,并认为0.6%的NaCl为适宜的突变体筛选浓度[7]。本研究在已有研究的基础上,以3个耐盐突变体的一年生植株为材料,以野生型为对照,比较了它们经胁迫后的生长情况和生理生化特性,为开展狼尾蕨突变体再生植株的耐盐性鉴定和耐盐育种研究提供参考。
1 材料与方法
1.1 实验材料
本实验室前期分别以0.4%、0.5%和0.6%的NaCl作为筛选剂,通过体细胞耐盐筛选获得了NY-4、NY-5和NY-6 3个狼尾蕨再生株系。再生植株经过移栽培养1年后形成具有根状茎的小植株,将该小植株放置温室培养6个月后用于实验。实验以3种筛选植株和野生型植株(WT)的新鲜叶片为材料,叶片采自江苏省农业科学院农业生物技术所试验苗圃地,取样后迅速放入液氮中冷冻,然后置-80℃冰箱保存备用。
1.2 试验设计
试验在江苏省农业科学院农业生物技术所实验室进行。2012年12月选取生长良好、大小、长势基本一致的WT、NY-4、NY-5和NY-6一年生植株种于花盆中,花盆直径为10 cm,高10 cm,每盆2株,共72株。盆土为泥炭土和珍珠岩的混合物(V(泥炭土)∶V(珍珠岩)=3∶1),温室中培养6个月后用1%NaCl胁迫处理,在处理0 d和20 d各浇NaCl溶液一次,每次每盆施加100 mL,花盆下垫塑料托盘,渗出液浇回花盆中,防止盐分流失。NaCl胁迫期间,定期定量浇水,在胁迫处理0,20,40 d时对植株的形态外观进行观测并取样。
1.3 测定项目与方法
在胁迫处理0,20,40 d时对植株的形态进行观察,记录植株的生长和盐害情况,计算植株的存活率和盐害指数。

盐害分级参照孙海菁等[8]的标准,具体为:0级:未受害;1级:叶片出现少量卷曲;2级:叶片出现黄化,部分叶尖或叶缘焦萎或轻度落叶;3级:部分叶片焦萎或出现严重落叶;4级:叶片全部脱落,植株死亡。
叶绿素含量测定采用乙醇浸提法[9];丙二醛(MDA)含量测定采用硫代巴比妥酸法[10];脯氨酸含量测定采用茚三酮显色法[10];可溶性蛋白的测定采用考马斯亮蓝G-250法[10];SOD活性的测定采用氮蓝四唑法[10]。测定均重复3次。
1.4 数据分析
试验数据采用SPSS16.0和Microsoft Excel进行统计分析。
2 结果与分析
2.1 NaCl胁迫下4种材料的存活率和盐害指数
由表1可知,随着NaCl胁迫时间的延长,4种材料的存活率均呈下降趋势,盐害指数呈现增加的趋势。盐胁迫20 d时,4种材料均未有植株死亡,叶片伤害不大,仅有少量叶片泛黄脱落。在胁迫延长至40 d时,4种材料均有部分植株死亡。3种突变体中NY-5和NY-6表现出了较好的耐盐性,植株存活率分别为61.11%和69.14%,均高于 WT 的 55.55%;盐害指数分别为 79.16%和 69.54%,均低于 WT 的81.94%;NY-4则耐盐性最差,植株存活率较低,半数植株死亡,盐害指数也最高为83.33%。
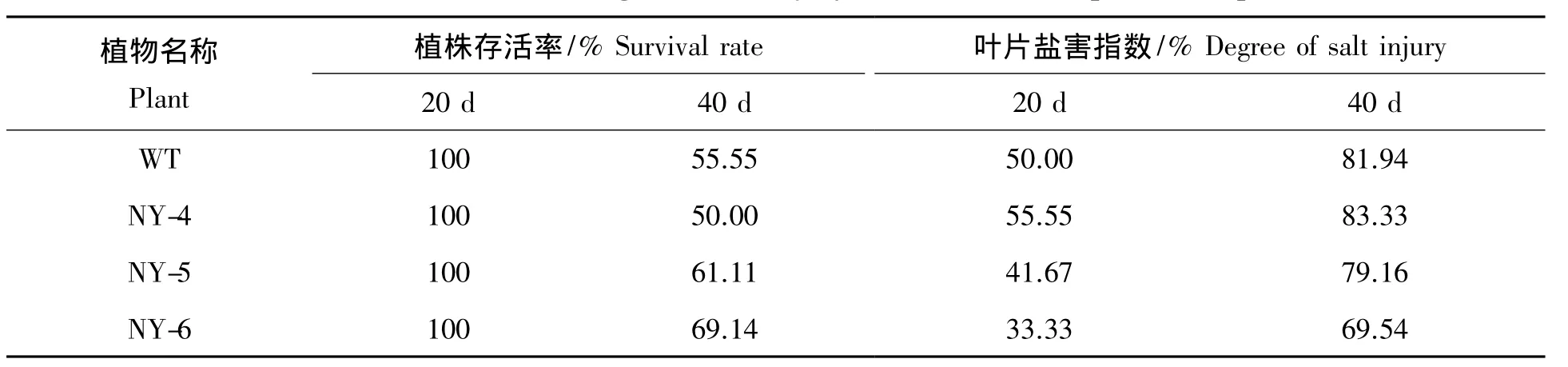
表1 盐胁迫下供试植株的存活率和盐害指数Tab.1 Survival rate and degree of salt injury in salt stress of experimental plant
2.2 NaCl胁迫对叶片叶绿素含量的影响
由图1可以看出,未经胁迫处理时,NY-5的Chl a、Chl b和Chl(a+b)含量显著(P<0.05)低于其它3种材料;胁迫处理期间,4种植物叶片Chl a、Chl b和Chl(a+b)含量均随着盐胁迫时间的延长而减少。盐胁迫处理20 d时,与0 d时相比,WT和NY-4的Chl a含量均显著性(P<0.05)降低,分别降为0 d的60.44%和71.11%,而NY-5和NY-6的Chl a含量则无显著性变化;WT、NY-4与NY-6的Chl b和Chl(a+b)含量均显著性(P<0.05)降低,降低幅度由大到小均为WT>NY-4>NY-6,而NY-5的Chl b和Chl(a+b)含量则无显著性变化。当胁迫延长至40 d时,与0 d相比,4种材料的Chl a、Chl b和Chl(a+b)含量均显著性(P<0.05)降低,其中 Chl a含量下降幅度由大到小为 WT>NY-6>NY-4>NY-5,分别为 0 d 的 42.34%、48.33%、51.14%和 51.86%;Chl b 含量下降幅度由大到小为 NY-5>WT>NY-6>NY-4,分别为 0 d 的 51.1%、56.7%、65.13%和 69.12%;Chl(a+b)下降幅度由大到小依次为 NY-5>NY-4>WT>NY-6,分别为 0 d 的44.87%、53.1%、53.15%和 55.37%;
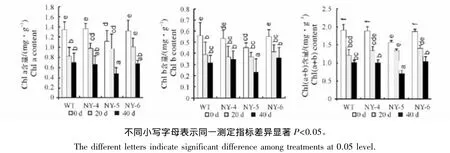
图1 盐胁迫对4种狼尾蕨叶片叶绿素含量的影响Fig.1 Effect of salt stress on the blade chlorophyll content of four kinds of Davallia bullata
2.3 NaCl胁迫叶片脯氨酸、可溶性蛋白含量的影响
由图2可以看出,未经胁迫处理时,4种材料的脯氨酸含量差异不显著(P>0.05);胁迫处理期间,随胁迫时间的延长,WT叶片脯氨酸含量呈持续增加趋势,3种突变体中NY-4、NY-5的变化趋势与WT一致,而NY-6则呈现先升高后降低的趋势。在胁迫20 d时,脯氨酸含量增加幅度由大到小依次为WT、NY-4、NY-5、NY-6,分别为 0 d 的 1.433、1.188、1.12 和 1.034 倍;当胁迫延长至 40 d 时,脯氨酸含量增加幅度由大到小依次为 NY-4、NY-5、WT、NY-6,分别为 0 d 的 2.061、1.972、1.973 和 0.786 倍。
未经胁迫处理时,4种材料的可溶性蛋白含量差异不显著(P>0.05);胁迫处理期间,随盐胁迫时间的延长,WT叶片可溶性蛋白含量呈现逐渐增加的趋势,3种突变体呈现先降低后增高的趋势。至胁迫处理40 d时,WT叶片可溶性蛋白含量显著(P<0.05)高于0 d,为0 d的1.549倍。3种突变体中NY-6叶片可溶性蛋白含量显著(P<0.05)低于0 d,为0 d的88.09%,NY-4、NY-5与0 d相比无显著性变化。
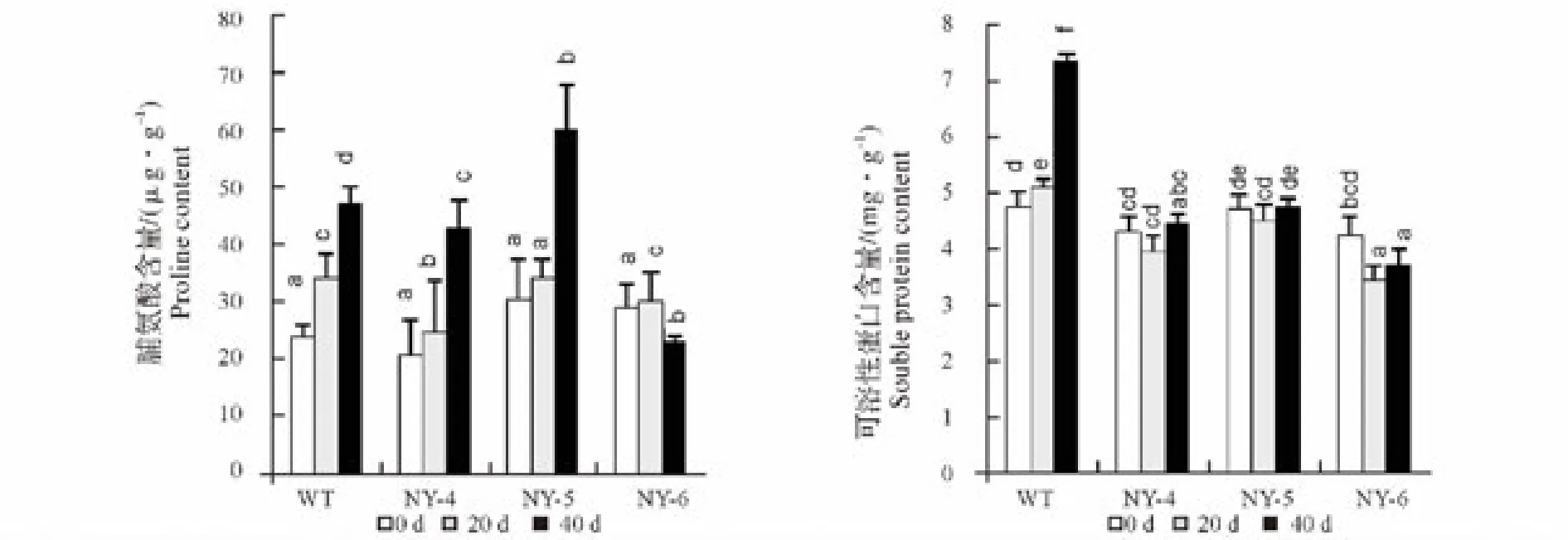
图2 盐胁迫对4种狼尾蕨叶片脯氨酸和可溶性蛋白含量的影响Fig.2 Effect of salt stress on the blade proline and souble protein content of four kinds of Davallia bullata
2.4 NaCl胁迫对叶片丙二醛含量的影响
由图3可以看出,在未受盐胁迫时,3种突变体的MDA含量均显著(P<0.05)高于WT;在胁迫处理20天后,各材料叶片MDA含量均得到提高,其中3种突变体的增加幅度均小于WT,MDA增加幅度由大到小依次为 WT、NY-4、NY-6、NY-5,分别为0 d 的1.44、1.23、1.1 和1.07 倍;当胁迫延长至40 d 时,WT的MDA含量虽有所下降,但仍高于其0 d时的含量。3种突变体中NY-5的MDA含量有所升高,NY-4和NY-6则均降低,且均显著(P<0.05)低于0 d时含量。
2.5 叶片SOD 含量
由图3可以看出,在没有盐胁迫时,3种突变体的SOD含量均显著(P<0.05)高于WT;在胁迫处理20 d时,4种材料叶片SOD含量均得到提高,增加幅度由大到小依次为WT、NY-4、NY-6、NY-5,分别为0 d时的 1.8、1.25、1.12 和 1.06 倍;当胁迫延长至 40 d 时,WT 的 SOD 含量持续升高,3 种突变体材料则均显著(P<0.05)降低,降低幅度由大到小依次为 NY-6>NY-5>NY-4。
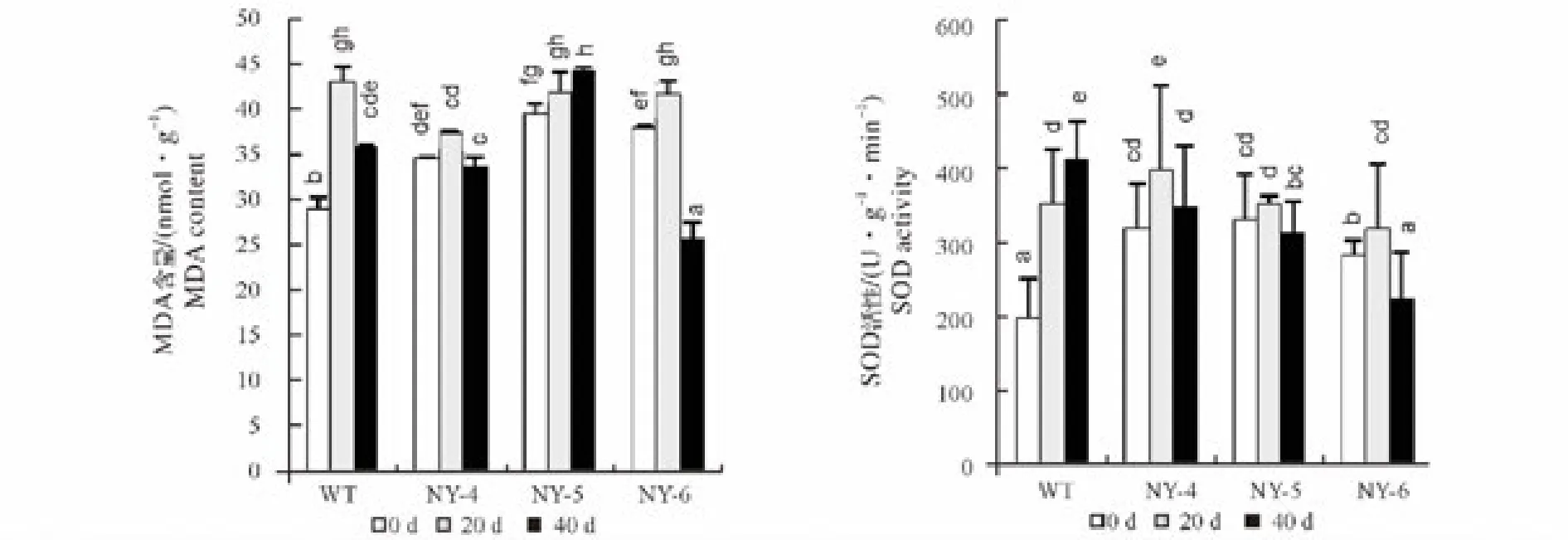
图3 盐胁迫对4种狼尾蕨叶片MDA含量和SOD活性的影响Fig.3 Effect of salt stress on the blade MDA content and SOD activity of four kinds of Davallia bullata
2.6 4种材料生长、生理指标相关性分析
4种材料生长、生理指标测定值相关分析表明(表2):盐胁迫下4种材料的生长与生理指标间均有一定的相关性,但不同指标间的相关程度不同。其中,在植株存活率和盐害指数这两个生长指标中,植株存活率与Chl a、Chl b和Chl(a+b)呈极显著(P<0.01)正相关,与与脯氨酸含量呈显著(P<0.05)负相关;盐害指数与Chl a、Chl b和Chl(a+b)呈极显著(P<0.01)负相关,与脯氨酸含量呈显著(P<0.05)正相关。
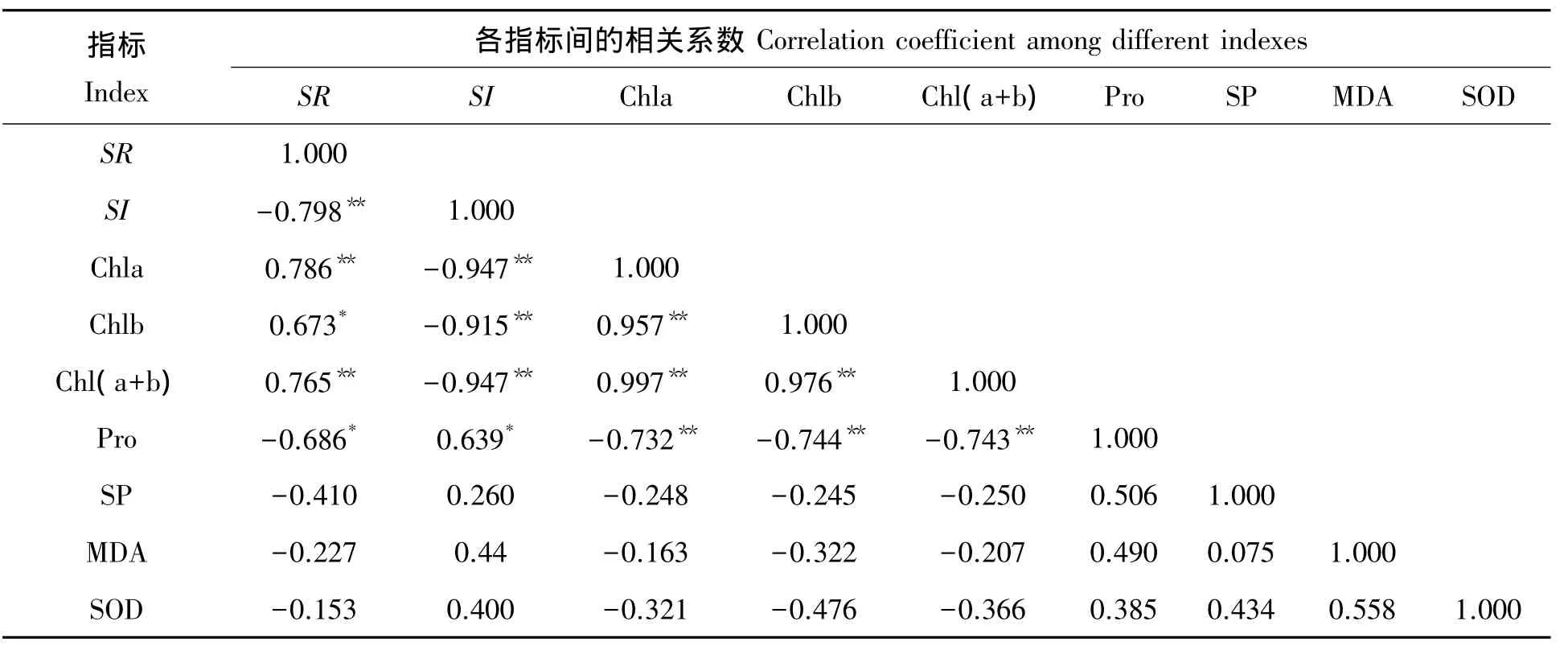
表2 盐胁迫下4种材料生长、生理各指标间的相关系数Tab.2 Correlation coefficient among different indexes of growth and physiology of four kinds of materials under salt stress
3 讨论
盐胁迫会对植物造成伤害,改变植物的形态和解剖学结构,引起植物的生理代谢发生紊乱,导致植物生长发育受到不同程度的抑制,甚至造成植物死亡。叶片是植物重要的功能器官,也是在胁迫下响应最明显的器官之一,多数植物受盐害后叶尖、叶缘及至整张叶片出现枯焦、黄化、脱落、失水萎蔫等症状。在盐胁迫下对植株的存活率和叶片盐害指数进行测定是植物耐盐性鉴定最直接的方法[11]。耐盐性较强的种类,其存活率随着盐害的加剧变化幅度较小,且其盐害指数较低;而耐盐性较弱的种类,其存活率随着盐害的加剧变化幅度增大,且其盐害指数较高[8]。本试验中,随着盐胁迫时间的延长,4种供试材料的盐害症状逐渐加剧,叶片相继出现不同程度的枯黄、萎蔫和脱落等。在胁迫20 d时,4种材料均未有植株死亡,植株叶片呈现轻度盐害症状,仅有少量叶片泛黄脱落,观赏价值未受到较大影响;当胁迫延长至40 d时,4种材料均有部分植株死亡,植株叶片呈现重度盐害症状,大量叶片泛黄、萎蔫和脱落;3种突变体中NY-6表现出了较好的耐盐性,存活率变化幅度和盐害指数均低于其它3种材料,耐盐性明显高于其它3种材料;而NY-4在4种材料中耐盐性最差,存活率变化幅度和盐害指数均高于WT。
叶绿素是植物耐盐性的重要生理指标之一,盐胁迫不仅会使叶绿素酶活性增强,加速叶绿素分解,还会影响叶绿素合成酶的活性,抑制叶绿素合成,最终导致植物叶片叶绿素含量降低,引起植株光和能力下降[12]。在盐胁迫下,植株叶绿素含量降低的程度和幅度反映了其对盐胁迫的敏感性[13]。本试验中,在未经胁迫处理时,NY-4和NY-6叶片中Chl a、Chl b和Chl(a+b)含量与WT均无显著性差异,而NY-5叶片中Chl a、Chl b和Chl(a+b)含量则均显著(P<0.05)低于WT。这可能是由于NY-5的叶绿体结构有别于WT,致使其叶绿素含量明显的不同于其它材料,具体原因还有待于进一步研究。在盐胁迫初期,4种材料的Chl a、Chl b和Chl(a+b)均降低,且降低幅度由大到小依次为WT、NY-4、NY-6、NY-5,这一结果表明WT较突变体对盐更为敏感,在胁迫初期叶绿素就开始大量分解。当胁迫延长至40 d时,仅NY-6叶片中的Chl a、Chl b和Chl(a+b)降幅均小于WT,说明NY-6具有一定的耐盐性。NY-6的光合作用会有所增强以适应高盐环境,使其降低幅度较小,但随着盐胁迫的加剧,其细胞内产生大量的活性氧破坏叶绿素的合成,使其整体表现为叶绿素含量降低,这与张景云等[14]在对黄瓜不同耐盐品种叶绿素含量的研究中的结果相似。
脯氨酸和可溶性蛋白是植物体内重要的渗透调节物质,逆境条件下,植物可通过渗透调节作用减轻伤害[15]。目前对于逆境条件脯氨酸积累的研究尚无一致意见。从脯氨酸在逆境条件下的积累来看,它既可能是适应性,又可能是细胞结构和功能受损伤的表现[16]。可溶性蛋白与调节植物细胞的渗透势有关,高含量的可溶性蛋白可帮助维持植物细胞较低的渗透势以抵抗逆境带来的胁迫[17]。本试验中,未经胁迫处理时,4种材料的脯氨酸和可溶性蛋白含量差异不显著(P>0.05),说明突变体材料的脯氨酸和可溶性蛋白含量与野生型本身差异不大,孔凡岩等[18]在对百喜草体细胞耐盐突变体的耐盐性研究中也得到相似结果;在盐胁迫20 d时,4种材料的脯氨酸含量均得到提高,增加幅度由大到小为WT、NY-4、NY-5、NY-6;当胁迫延长至40天时,除NY-6略有降低外,其余3种材料的脯氨酸含量均增长为对照的2倍左右。这一结果可能更为支持脯氨酸积累是植物受损伤的表现。在胁迫初期,4种材料均受到不同程度的盐害,使其细胞结构和功能受损,引起脯氨酸含量升高,当胁迫加剧时,植物受损加剧,脯氨酸含量继续升高达到一个峰值。而NY-6具有一定的耐盐性,植株受到的伤害较小,脯氨酸含量维持在较低水平。宗会等[19]在对水稻的研究中也发现抗逆性较强的水稻品种脯氨酸积累较少,而抗逆性弱的水稻品种脯氨酸积累较多。盐胁迫下,WT的可溶性蛋白持续升高,变化幅度较大,3种突变体材料的可溶性蛋白含量呈先降低后升高,但变化幅度较小,这可能是突变体材料具有一定的耐盐性,对盐的敏感性不高,可溶性蛋白变化不大。
MDA作为膜脂过氧化作用的最终产物,是判定膜质过氧化作用的重要指标,它通过与膜结构上的蛋白质和酶结合使其失去活性,会破坏膜结构,是细胞毒性物质[20]。本试验中,未进行胁迫处理时,3种耐盐突变体的MDA含量均高于对照,这与肖雯等[21]报道的情况相一致,可能是因为可遗传的抗盐植物(包括盐诱耐盐品系)受制于各自遗传性控制,能够在高盐环境长期胁迫下维持所形成的独特的生理代谢机制所致,甚至在较为平稳的低盐胁迫或者没有盐胁迫下也表现出来,即保持较高的MDA含量。在胁迫20 d时,各材料叶片MDA含量均得到提高,增加幅度由大到小依次为WT、NY-4、NY-6、NY-5,这表明盐胁迫时发生了膜质过氧化作用。3种突变体的增加幅度均小于WT,说明突变体材料膜质受损程度要低于WT,具有一定的耐盐性;在胁迫40d后,除NY-5含量持续升高,其它3种材料MDA含量出现降低,这可能是由于加剧的盐害造成细胞生化平衡系统的紊乱[22]。
在正常情况下,植物体内的自由基的产生和清除处于动态平衡状态。在盐胁迫下,其体内的活性氧平衡遭到破坏,自由基积累,引起植物氧化损伤。SOD是植物酶促防御系统的重要保护酶,具有清除活性氧自由基的作用,因此,SOD活性的高低以及在逆境中的变化趋势在一定程度上可反映植物抗逆性的强弱[23]。本试验中,未进行胁迫处理时,3种突变体的SOD含量均显著(P<0.05)高于WT,这可能与MDA情况相类似,是因为可遗传的抗盐植物在维持其独特的生理代谢机制。3种突变体材料随着盐胁迫时间的延长SOD含量均呈现先上升后降低的趋势,且达到最大值的时间明显的短于WT,表明在一定盐胁迫内突变体材料可通过较短的时间提高SOD含量来减缓盐害。
相关性分析结果表明:植株存活率和盐害指数两个最直接鉴定植株耐盐性指标与7个生理指标都呈现一定的相关性,尤其是叶绿素和脯氨酸含量的贡献较大,说明不同狼尾蕨植株耐盐能力受光合作用和脯氨酸合成能力的影响较大。其中,植株的耐盐性与叶绿素呈显著正相关,与脯氨酸呈现显著负相关。在胁迫处理期间,NY-6叶绿素下降幅度与脯氨酸增加幅度均最小,故其耐盐能力强于其它3种材料。然而,由于各指标所提供的信息发生重叠,故直接利用这些指标中的单一指标进行耐盐能力评价可能会有一定的片面性。
本实验证实了以NaCl作为选择剂,通过体细胞突变的方法确实可以获得耐盐性得到提高的狼尾蕨突变体,且不同的突变体耐盐能力不同。植物的耐盐性是多基因控制的复合遗传性状,植物的耐盐机理涉及到从植株到器官、组织、生理生化直至分子的各个水平[24]。本实验虽然从形态及生理角度对3种突变体植株的耐盐性差异进行了研究,但为全面、系统的揭示突变体的耐盐机理,尚需从器官、组织以及分子水平对其进行更深入的解析。
[1]Min H L,Eun J C,Seung G W,et al.Divergences in morphological changes and antioxidant responses in salt-tolerant and saltsensitive rice seedlings after salt stress[J].Plant Physiology and Biochemistry,2013,70(9):325-335.
[2]董志刚,程智慧.番茄品种资源芽苗期和幼苗期的耐盐性及耐盐指标评价[J].生态学报,2009,29(3):1348-1355.
[3]冯桂苓,谢兆印.水稻成熟胚愈伤组织耐盐变异体的筛选[J].天津农业科学,1996,2(2):6-8.
[4]张建华,陈火英,庄天明.番茄耐盐体细胞变异体的离体筛选[J].西北植物学报,2002,22(2):257-262.
[5]李爱贤,程智慧,张国裕.甘薯耐旱、耐盐突变体的离体筛选[J].农业生物技术学报,2002,10(1):15-19.
[6]程钰红,赵瑞雪,董宽虎.牧草耐盐突变体筛选的研究进展[J].草业科学,2008,25(11):28-35.
[7]叶晓青,佘建明,贾新平等.狼尾蕨体细胞耐盐突变体筛选技术[J].江苏农业学报,2013,29(6):1266-1270.
[8]孙海菁,王树凤,陈益泰.盐胁迫对6个树种的生长及生理指标的影响[J].林业科学研究,2009,22(3):315-324.
[9]王学奎.植物生理生化实验原理和技术[M].北京:高等教育出版社,2006:134-136,280-281,190-192.
[10]Deng Y M,Shao Q S,Li C C,et al.Differential responses of double petal and multi petal jasmine to shading:II.Morphology,anatomy and physiology[J].Scientia Horticulturae,2012,144:19-28.
[11]Munns R.Comparative physiology of salt and water stress[J].Plant Cell and Environment,2002,25(2):239-250.
[12]Rao G G,Rao G R.Pigment composition and chlorophyllase activity in pigment pea and Gingelley under NaCl salinity[J].Indian Journal Experimental Biology,1986,19:768-770.
[13]夏阳,孙明高,李国雷等.盐胁迫对四园林绿化树种叶片中叶绿素含量动态变化的影响[J].山东农业大学学报,2005,36(1):30-34.
[14]张景云,吴凤芝.盐胁迫对黄瓜不同耐盐品种叶绿素含量和叶绿体超微结构的影响[J].中国蔬菜,2009,(10):13-16.
[15]王娟,李德全.逆境条件下植物体内渗透调节物质的积累与活性氧代谢[J].植物学通报,2001,18(4):459-465.
[16]汤章城.逆境条件下植物脯氨酸的累积及其可能的意义[J].植物生理学通讯,1984,(1):51-54.
[17]毛桂莲,许兴.枸杞耐盐突变体的筛选及生理生化分析[J].西北植物学报,2005,25(2):275-280.
[18]孔凡岩.百喜草体细胞耐盐突变体筛选及其生理生化特性研究[D].合肥:安徽农业大学,2010.
[19]宗会,刘娥娥,郭振飞等.干旱、盐胁迫下LaCl3和CPZ对稻苗脯氨酸积累的影响[J].作物学报,2001,27(2):173-177.
[20]张永峰,殷波.混合盐碱胁迫对苗期紫花苜蓿抗氧化酶活性及丙二醛含量的影响[J].草业学报,2009,18(1):46-50.
[21]肖雯,贾恢先,蒲陆梅.几种盐生植物抗盐生理指标的研究[J].西北植物学报,2000,20(5):818-825.
[22]王罗霞,赵志光,王锁民.一氧化氮对水分胁迫下小麦叶片活性氧代谢及膜脂过氧化的影响[J].草业学报,2006,15(4):104-108.
[23]张永清,刘凤兰,贾蕊,等.La(NO3)3浸种对盐碱胁迫下红小豆幼苗生长和抗氧化酶活性的影响[J].生态与农村环境学报,2009,25(4):12-18.
[24]徐鲜钧,沈宝川,祁建民.植物耐盐性及其生理生化指标的研究进展[J].亚热带农业研究,2007,3(4):275-280.

