荔枝核皂苷和荔枝核黄酮对HepG2细胞胰岛素抵抗作用研究
肖志军,郭洁文,徐 峰(.上海市奉贤区中心医院药剂科,上海 0400;.广州市中医医院,广州 5030)
・论著・
荔枝核皂苷和荔枝核黄酮对HepG2细胞胰岛素抵抗作用研究
肖志军1,郭洁文2,徐 峰1(1.上海市奉贤区中心医院药剂科,上海 201400;2.广州市中医医院,广州 510130)
目的探讨荔枝核皂苷、荔枝核黄酮对胰岛素抵抗HepG2细胞糖代谢的影响。方法采用高浓度胰岛素培养基诱导HepG2细胞形成胰岛素抵抗模型,葡萄糖氧化酶法测定对照组、荔枝核皂苷组、荔枝核黄酮组、罗格列酮组细胞培养上清液中的葡萄糖含量,观察荔枝核皂苷、荔枝核黄酮对HepG2细胞胰岛素抵抗的作用。结果HepG2细胞在10-6mol/L的胰岛素中作用24 h,细胞对胰岛素的抵抗作用最为明显。以此条件构建胰岛素抵抗细胞模型,对该模型给予荔枝核皂苷、荔枝核黄酮干预后,细胞培养上清液中葡葡糖含量未能显著降低。结论本研究提示荔枝核皂苷、荔枝核黄酮不能有效改善胰岛素抵抗。
荔枝核皂苷;荔枝核黄酮;胰岛素抵抗;HepG2细胞
胰岛素抵抗(insulin resistance,IR)是指胰岛素敏感组织如肝、脂肪、骨骼肌等受胰岛素介导的葡萄糖摄取和利用能力减弱的一种病理和生理状态[1]。IR是高血压、2型糖尿病和脂肪肝、肥胖等代谢性疾病并发和相互联系的病理学基础。中药具有多成分、多作用靶点的优势,可能通过不同的途径和环节来改善IR[2]。因此,寻找、研究改善IR的中药日益被重视。
荔枝核为无患子科植物荔枝(Litchi chinensis Soon.)的干燥成熟种子,其活性成分主要有总皂苷、黄酮、多糖、多酚等。本课题组前期研究表明[3-7],荔枝核水提取物对高糖、高脂饮食加低剂量链脲霉素诱导的T2DM-IR动物模型,荔枝核总皂苷对高糖、高脂饮食诱导高脂血症-IR-脂肪肝与地塞米松致IR两种动物模型均有显著的降糖、调脂和改善IR作用。
因此,为深入研究荔枝核改善IR的作用机制,本实验拟采用超生理浓度的胰岛素刺激人肝癌细胞HepG2,建立具有IR特点的细胞模型,进一步观察在细胞形成IR的情况下,荔枝核提取物皂苷和黄酮能否有效改善IR细胞模型的葡萄糖利用和摄取。
1 材料与方法
1.1 细胞株 HepG2细胞株购自中科院上海细胞库。
1.2 药品与试剂 荔枝核皂苷和荔枝核黄酮由中国热带农业科学院农产品加工研究所林丽静博士分离并提供样品。DMEM培养基(Gibco公司),胎牛血清(Biochrom公司),0.25%胰蛋白酶、PBS缓冲液、青霉素-链霉素混合液(Hyclone公司),胰岛素、罗格列酮标准品、MTT、DMSO(Sigma公司),葡萄糖测定试剂盒(北京普利莱基因技术有限公司)。
1.3 主要仪器 CO2细胞培养箱(美国Thermo Scientific公司),超净工作台(上海新苗医疗器械制造有限公司),酶标仪(美国Biotek公司),倒置显微镜(德国Leica公司),高速离心机(德国Eppendorf公司)。
1.4 方法
1.4.1 细胞培养 人肝癌细胞HepG2在添加10%胎牛血清和1%青霉素-链霉素混合液的DMEM高糖培养基中,于37℃、5%CO2条件下连续培养。HepG2细胞为贴壁细胞,当细胞长满瓶底后,弃培养基,用PBS缓冲液洗2次,0.25%胰蛋白酶消化后,按1∶3比例进行传代培养,取对数生长期的细胞用于实验。
1.4.2 HepG2胰岛素抵抗细胞模型的建立 参考文献[8]方法并加以改进。将处于对数生长期的细胞消化后,用含2%胎牛血清的高糖DMEM培养基调整细胞密度为1×106/L,接入96孔细胞培养板中继续培养,分为对照组和模型组。待细胞贴壁长至80%后,模型组加入新配制的含胰岛素浓度为10-5、10-6、10-7、10-8mol/L的培养基,对照组加入正常培养基,于37℃、5%CO2培养箱中孵育36 h后,用葡萄糖氧化酶法测定细胞培养上清液中葡萄糖含量。计算对照组与不同胰岛素浓度组细胞的葡萄糖含量消耗差值,选择葡萄糖消耗差值最大,即达到胰岛素抵抗最高状态的胰岛素作用浓度为胰岛素最佳浓度。
确定胰岛素最佳浓度后,重复上述方法,模型组加入新鲜配制的含有胰岛素最佳浓度的培养基,分别培养12、24、36和48 h,对照组加入正常培养基。计算对照组和模型组细胞的葡萄糖消耗量差值。选择葡萄糖消耗量差值最大,即达到胰岛素抵抗最高状态的胰岛素作用时间为胰岛素作用的最佳时间。通过分别确定最佳胰岛素浓度和最佳作用时间后,建立最适宜的胰岛素诱发的HepG2胰岛素抵抗细胞模型。
1.4.3 M TT法筛选荔枝核皂苷、荔枝核黄酮工作浓度 建立HepG2胰岛素抵抗细胞模型后,将细胞接种于96孔板,每孔约5 000个细胞。实验设荔枝核皂苷组、荔枝核黄酮组、对照组。荔枝核皂苷组、荔枝核黄酮组分别加入浓度为0.01、0.1、1、10、50、100 mg/L的荔枝核皂苷和荔枝核黄酮,对照组加入正常培养基,各实验组中DMSO的终浓度均<0.1%。于37℃、5%CO2培养箱中孵育24 h后,每孔加入20μl浓度为5 mg/m l的M TT溶液,置培养箱中继续孵育4 h。弃上清液,各孔分别加入100μl的DMSO,微型振荡器振荡10 min,酶联免疫检测仪于波长490 nm处测各孔吸光度(A)。细胞存活率=(药物组A/对照组A)×100%。
1.4.4 荔枝核皂苷和荔枝核黄酮对胰岛素抵抗HepG2细胞葡萄糖消耗量的影响 建立HepG2胰岛素抵抗细胞模型后,将细胞接种于96孔板,每孔约5 000个细胞。实验设HepG2胰岛素抵抗细胞模型组、罗格列酮组(终浓度为10-5mol/L)、荔枝核皂苷组和荔枝核黄酮组。各组加入相应的药物后置37℃、5%CO2培养箱中培养24 h后,用葡萄糖氧化酶法测定细胞培养上清液中葡萄糖含量。
1.5 统计学处理 采用SPSS 18.0软件进行统计分析,数据以均数±标准差(±s)表示,多样本均数差的多重比较采用单因素方差分析,以P<0.05为差异有统计学意义。
2 结果
2.1 不同胰岛素浓度对HepG2细胞胰岛素抵抗的影响 从表1可以看出,与对照组相比,胰岛素浓度为10-5、10-6、10-7mol/L时HepG2细胞培养上清液中葡萄糖含量增加(P<0.05)。且在胰岛素浓度为10-6mol/L时葡萄糖含量最高,即葡萄糖消耗量最小,达到最大胰岛素抵抗状态。因此,选择10-6mol/L为最佳胰岛素浓度,建立HepG2胰岛素抵抗细胞模型。
表1 不同浓度胰岛素对HepG2细胞胰岛素抵抗的影响(n=6,±s)
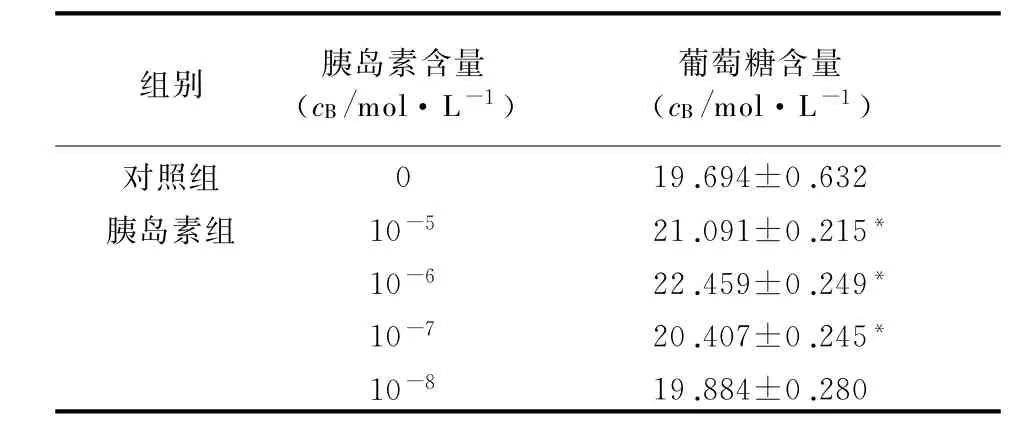
表1 不同浓度胰岛素对HepG2细胞胰岛素抵抗的影响(n=6,±s)
*P<0.05,与对照组比较
组别胰岛素含量(c B/mol・L-1)葡萄糖含量(c B/mol・L-1)对照组0 19.694±0.632胰岛素组10-521.091±0.215*10-622.459±0.249*10-720.407±0.245*10-819.884±0.280
2.2 胰岛素不同作用时间对HepG2细胞胰岛素抵抗的影响 从表2可以看出,与对照组相比,胰岛素作用时间为24、36、48 h时,HepG2细胞培养上清液中葡萄糖含量增加(P<0.05)。在胰岛素作用24 h时,胰岛素抵抗与对照组比较差异显著(P<0.01)。此外,随着培养时间的延长,细胞状态逐渐变差。因此,选择10-6mol/L胰岛素处理HepG2细胞24 h为建模条件,建立胰岛素抵抗HepG2细胞模型。
表2 胰岛素不同作用时间对HepG2细胞胰岛素抵抗的影响(n=6,±s)
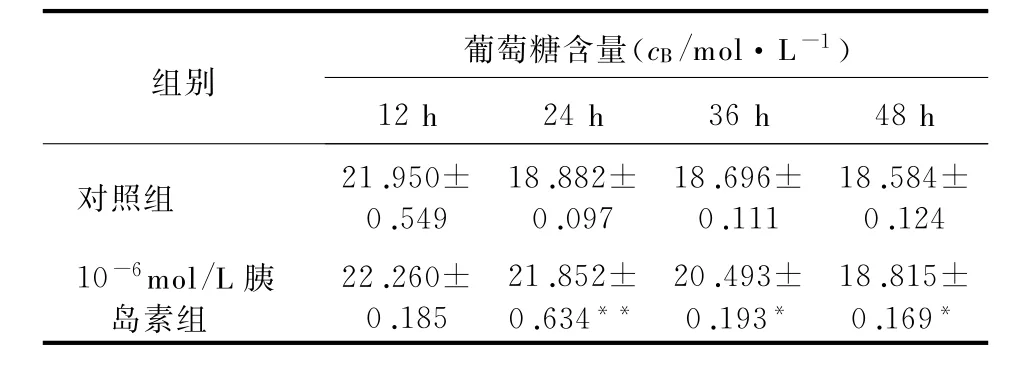
表2 胰岛素不同作用时间对HepG2细胞胰岛素抵抗的影响(n=6,±s)
*P<0.05,与对照组比较;**P<0.01,与对照组比较
组别葡萄糖含量(cB/mol・L-1)12 h 24 h 36 h 48 h对照组21.950± 0.549 18.882± 0.097 18.696± 0.111 18.584± 0.124 10-6mol/L胰岛素组22.260± 0.185 21.852± 0.634**20.493± 0.193*18.815± 0.169*
2.3 M TT实验筛选荔枝核皂苷的工作浓度 由图1可知,HepG2细胞存活率随着荔枝核皂苷的浓度增加而降低,当荔枝核皂苷浓度为50 mg/L时,细胞存活率为(99.44±5.692)%,表明此时当荔枝核皂苷对HepG2细胞生长开始产生抑制作用,为了消除因抑制细胞生长而对葡萄糖消耗量产生的影响,本实验选取50、10、1 mg/L为荔枝核皂苷的工作浓度。
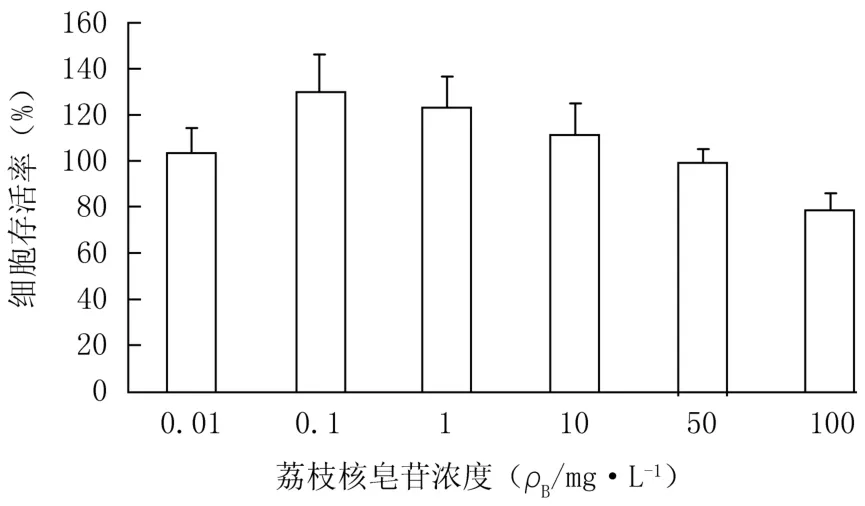
图1 不同浓度荔枝核皂苷对HepG2细胞存活率的影响(n=6,±s)
2.4 M TT实验筛选荔枝核黄酮的工作浓度 由图2可知,当荔枝核黄酮浓度为50、100 mg/L时,HepG2细胞存活率分别为(101.97±7.963)%、(82.38±8.374)%,为了消除因抑制细胞生长而对葡萄糖消耗量产生的影响,本实验选取50、10、1 mg/L为荔枝核黄酮的工作浓度。
2.5 荔枝核皂苷对胰岛素抵抗HepG2细胞葡萄糖消耗量的影响 由图3可知,与对照组相比,荔枝核皂苷浓度为50 mg/L时细胞培养上清液中葡萄糖含量增加,两者差异有统计学意义(P<0.05)。罗格列酮组能够提高葡萄糖消耗量,即具有降血糖作用。
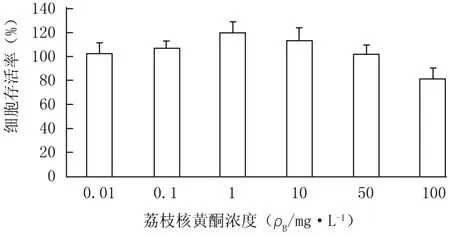
图2 不同浓度荔枝核黄酮对HepG2细胞存活率的影响(n=6,±s)

图3 不同浓度荔枝核皂苷对胰岛素抵抗HepG2细胞葡萄糖消耗量的影响(n=6,±s)
2.6 荔枝核黄酮对胰岛素抵抗HepG2细胞葡萄糖消耗量的影响 由图4可知,与对照组相比,经3个浓度荔枝核黄酮处理后的细胞培养上清液中葡萄糖含量有所降低,但差异均无统计学意义。罗格列酮能够显著提高胰岛素抵抗HepG2细胞葡萄糖消耗量,即有降血糖作用。

图4 不同浓度荔枝核黄酮对胰岛素抵抗HepG2细胞葡萄糖消耗量的影响(n=6,±s)
3 讨论
2型糖尿病的发病机制主要是胰岛β细胞功能障碍和外周组织产生IR,改善IR是治疗2型糖尿病的主要研究方向之一[9,10]。肝脏是产生IR的主要组织,胰岛素从胰岛细胞分泌后,经门静脉约一半以上被肝摄取。本实验采用的HepG2细胞为人的肝胚胎瘤细胞,保留肝的一般生物学特性[10]。通过采用高于生理浓度的胰岛素诱导HepG2细胞,在一定程度上模拟了IR的自然发病过程。本实验结果提示,应用高胰岛素诱导培养法可使HepG2细胞胰岛素刺激的葡萄糖消耗量减少,即发生IR。
本实验在成功建立IR HepG2细胞模型基础上进行,通过测定药物干预后细胞培养上清液中葡萄糖含量来判定荔枝核皂苷和荔枝核黄酮改善HepG2细胞IR的作用。从实验结果来看,荔枝核皂苷和荔枝核黄酮体外并无明显降糖作用。
以往的研究表明,荔枝核降糖的主要功效成分为皂苷[5]、多糖[11]和氨基酸[12]。其中,荔枝核皂苷主要是通过促进外周组织尤其是肌肉、脂肪组织对葡萄糖的摄取、酵解和利用,提高对胰岛素的敏感性,拮抗胰高血糖作用,从而产生降血糖作用[13]。而本研究的结果却表明荔枝核皂苷体外并无明显降糖作用,基于此,我们认为荔枝核皂苷改善IR的作用部位可能并非位于肝细胞,而是位于肌肉和脂肪等其他外周组织。
本课题组一项对荔枝核有效部位群改善3T3-L1脂肪细胞IR作用的研究表明,荔枝核有效部位群能够显著改善IR[14]。虽然本实验在进一步对荔枝核化学成分进行细致研究发现,荔枝核皂苷不能改善IR,荔枝核黄酮类改善IR作用并不明显,但这样的结果更加提示我们,中药材的药效恰恰是一个整体的效应,正所谓“每一味中药都是一个小复方”。中药有效部位群的作用与进一步细分下去的化学成分的作用可能难以完全一致,单一化学成分的药理活性难以体现有效部位群的作用,与有效部位群的功能主治也不尽相同。构成有效部位群的每个化学组分,若离开其所在的特定物质群或特定复方环境,则失去其意义。因此,对荔枝核降糖作用的研究,或进一步推广到对中药的研究,应着眼于有效部位群。
[1] Samuel VT,Shulman GI.Mechanisms for insulin resistance:common threads and m issing links[J].Cell,2012,148(5):852-871.
[2] Li GQ,Kam A,Wong KH,et al.Herbalmedicines for the management of diabetes[J].Adv Exp M ed Biol,2012,771:396-413.
[3] 郭洁文,潘竞锵.荔枝和荔枝核的化学成分、生物活性及药理作用研究[J].中国新药杂志,2006,15(8):585-588.
[4] 郭洁文,李丽明,潘竞锵,等.荔枝核拮抗2型糖尿病大鼠胰岛素抵抗作用的药理学机制[J].中药材,2004,27(6):435-438.
[5] 郭洁文,廖惠芳,潘竞锵,等.荔枝核皂苷改善地塞米松致大鼠胰岛素抵抗作用机制研究[J].中国药房,2004,15(12):719-720.
[6] 郭洁文,廖惠芳,潘竞锵,等.荔枝核皂苷改善高脂血症-脂肪肝大鼠胰岛素抵抗作用的机制研究[J].中国药房,2005,16(10):732-734.
[7] 郭洁文,潘竞锵,邱光清,等.荔枝核增强2型糖尿病-胰岛素抵抗大鼠胰岛素敏感性作用[J].中国新药杂志,2003,12(7):526-529.
[8] 张汝学,贾正平,李茂星,等.体外胰岛素抵抗细胞模型的建立及在药物筛选中的应用[J].中国药理学通报,2008,24(7):971-976.
[9] Skoczen S,Wojcik M,Fijorek K,et al.Expression of the central obesity and type 2 diabetesmellitus genes is associated w ith insulin resistance in young obese children[J].Exp Clin Endocrinol Diabetes,2015,123(4):252-259.
[10] Moller DE.New drug targets for type 2 diabetes and themetabolic synd rome[J].Nature,2001,414(6865):821-827.
[11] 袁 红.荔枝核多糖提取物对四氧嘧啶致糖尿病小鼠降糖作用[J].健康研究,2010,30(4):113-116.
[12] 徐 婷,吴 青,高骏伟.荔枝核提取物及其阳离子树脂分离物体外降血糖作用[J].食品与机械,2012,28(04):252-255.
[13] 楼忠明,田菊霞,王文香,等.荔枝核总皂甙提取物对糖尿病小鼠的降糖疗效观察[J].浙江医学,2007,29(06):548-549.
[14] 廖向彬,李常青,李小翚,等.荔枝核有效部位群改善3T3-L1脂肪细胞胰岛素抵抗作用及机制[J].中药材,2014(07):1247-1250.
Effect of litchi saponin and litchi flavones on insulin resistance in HepG 2 cells
XIAO Zhijun1,GUO Jiewen2,XU Feng1(1.Department of Pharmacy,Fengxian Central Hospital,Shanghai 201400,China;2.Guangzhou Hospital of Traditional Chinese Medicine,Guangzhou 510130,China)
ObjectiveTo study the effect of litchisaponin and flavones on glycometabolism in insulin resistancemodelof HepG2 cells.MethodsUsing high insulin in HepG2 cells to establish a cellmodelof insulin resistance.Cellmodelwas treated by litchisaponin,litchi flavones and rosiglitazone,respectively.Glucose concentration of cell culture supernatantwas detected by glucose oxidasemethod.ResultsIn the concentration of 10-6mol/L insulin for 24 hours,HepG2 reached the highest level of resistant to insulin,whichmeans a successful insulin resistance cellmodelwas established.However,no significant decrease in glucose concentration of cell culture supernatantwas observed w ith litchisaponin and flavones.ConclusionThis study suggests that litchi saponin and flavones have no effect to improve insulin resistance.
litchi saponin;litchi flavones;insulin resistance;HepG2 cells
R285
A
1006-0111(2015)04-0316-04
10.3969/j.issn.1006-0111.2015.04.007
2015-04-22
2015-06-06[本文编辑]李睿旻
上海市卫生局中医药科研基金(No.2012Y010A)
肖志军,药师.研究方向:中药药理学.E-mail:zhijxiao@163.com
徐 峰,主任药师.研究方向:临床药理学.Tel(021)57422032;E-mail:andrew fxu@sina.com

