细胞共培养模型在口服药物吸收研究中的应用
黎 迎,朱春燕(中国医学科学院&北京协和医学院药用植物研究所,北京 100193)
・综述・
细胞共培养模型在口服药物吸收研究中的应用
黎 迎,朱春燕(中国医学科学院&北京协和医学院药用植物研究所,北京 100193)
细胞共培养体系能很好地模拟人体小肠生理环境,准确预测药物在肠道内的转运和代谢情况,增强体外细胞模型与整体动物实验研究之间的相关性,近年来在评价口服药物吸收方面发挥着越发重要的作用,已成为新药研发过程中评价药物口服吸收的热点。综述体外模拟肠道环境的细胞共培养模型,并对其应用于口服药物研发的体外评价吸收做出展望。
细胞模型;共培养体系;口服药物;胃肠道吸收;新药筛选
口服给药因其具有方便、安全、有效的特点,最容易为人们所接受。成功开发一个口服制剂的关键是要深入了解药物的吸收特点,确定药物的适宜吸收部位,考察影响药物吸收的因素,从而选择适宜的给药系统以提高药物的生物利用度。评价药物口服吸收的方法包括:体外法(如细胞模型)、体内法(如整体动物的药动学)、在体法(如单向灌流)等。由于体内或在体药物胃肠道渗透性评价不仅成本高、耗时长,且有悖伦理,故体外细胞模型评价药物的胃肠道吸收日益受到重视。
胃肠道内环境比较复杂,小肠部位的上皮细胞由许多细胞组成,包括肠细胞、杯状细胞、内分泌细胞、潘纳斯细胞、M细胞等;小肠中的胰液素、胰蛋白酶、脂酶、肽酶和麦芽糖酶等多种酶均影响药物的口服吸收(图1)。Caco-2和MDCK细胞模型是目前公认的较好的体外吸收模型,但均存在一定缺陷,体内外结果之间存在一定差异。建立体外细胞共培养体系,最大程度地模拟体内小肠生理环境,弥补了单一细胞模型的不足。本文就细胞共培养体系及其在口服药物吸收中的应用进行综述。
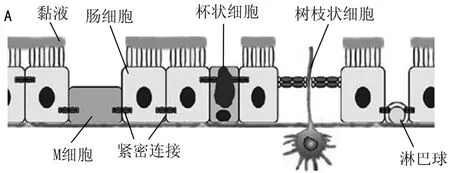
1 分泌黏液的胃肠道细胞模型
HT29细胞为人类腺癌细胞系,在甲氨蝶呤(M TX)诱导下可分化为成熟的杯状细胞,可以分泌黏液,缺点是单层细胞跨膜电阻(TEER)值过低,且不表达P-糖蛋白(P-glycoprotein,P-gp),将Caco-2细胞与HT29细胞系共培养可以克服上述不足,较好地模拟体内黏液层情况,适于研究生物黏附制剂或大分子药物的转运。
有些HT29细胞亚系形成多层细胞,只有上层细胞分化为杯状分泌细胞,而HT29-D1和HT29-E12细胞亚系均为M TX转染,能够全部转化为杯状分泌细胞,在Caco-2细胞上形成均一的黏液层,可以通过阿尔蓝染色法判定共培养细胞是否分泌黏液质[2]。Behrens等[3]报道HT29-D1分泌黏液层厚度为(53±52)μm,HT29-M TX-E12分泌黏液层的厚度为(142±51)μm,可以用于模拟胃肠道的不同片段。Caco-2/HT29-M TX细胞模型的不足是对以主动转运为主的药物能产生负结果[4]。
1.1 评价药物胃肠道吸收机制 Caco-2/HT29共培养模型可以更好地模拟胃肠道内黏液情况,因此能更准确地评价那些依赖胃肠道黏液吸收的药物经胃肠道吸收情况。Woitiski等[5]将胰岛素制成纳米粒,其在Caco-2细胞上的渗透性是胰岛素原药的2.1倍,在Caco-2/HT29细胞模型上的渗透性是原药的3.7倍,而离体小肠吸收实验证明是原药的3.9倍,Caco-2/HT29和动物模型证明,胃肠道黏液层对难溶性药物的纳米制剂的吸收起着重要作用。有些研究者[6-8]通过建立Caco-2/HT29-MTX共同培养的细胞模型用于预测化学元素的口服吸收,发现胃肠道黏液层在胃肠道吸收过程中起重要作用,是一种很有价值的体外评价模型。
1.2 评价药物胃肠道吸收的影响因素 Caco-2/
HT29-MTX共同培养的细胞模型用于研究药物在胃肠道吸收的影响因素,比如药物、食物或制剂辅料等。Sam等[9]以膜分泌型肠细胞模型HT29-MTXE12研究蜂毒肽作为吸收促进剂促进胃肠道吸收的可能机制和细胞毒性。Maresca等[10]用HT29细胞模型研究发现,不同浓度的脱氧瓜蒌镰菌醇能有选择性地调节肠道转运蛋白的活性,从而影响各种营养素(如糖类、氨基酸和脂类)的吸收。
1.3 评价细菌胃肠道转运及抗菌药物应用 有些细菌对胃肠道的侵袭依赖于黏液,因此Caco-2/ HT29共培养体系可用于抗菌药物的研发。Gagnon等[11]研究并比较沙门菌对Caco-2细胞、HT-29细胞和HT29-M TX细胞的黏附性和侵袭性,由于沙门菌对小肠上皮细胞的侵袭性主要依赖于黏蛋白,因此HT29-M TX细胞更适合作为体外细胞模型评价沙门菌的小肠细胞黏附性和侵袭性,从而更好地评价抗菌药物在胃肠道的作用。
2 M细胞模型
M细胞是肠道黏膜滤泡相关上皮细胞内一种特殊的抗原摄取细胞,主要存在于有囊泡的上皮组织中,在肠道中M细胞与肠上皮细胞紧密排列,共同形成天然的上皮屏障。与正常的肠上皮细胞相比,M细胞具有高内吞和低降解的特征;与Caco-2细胞相比,M细胞的TEER值小,碱性磷酸酶的活性降低了15%~36%,聚苯乙烯和白蛋白微粒在M细胞上的渗透性明显增高[12]。生物大分子、纳米颗粒、微生物等物质可以经M细胞跨肠上皮转运[13],M细胞介导的跨上皮细胞转运可分为3个阶段:肠腔内物质首先被吸附于细胞顶膜,然后通过内吞囊泡被转运至胞内内涵体,最后从基底膜经胞吐作用出胞,且呈温度依赖性[13,14]。
Gullberg等[15]建立了Caco-2/Raji B细胞共培养模型,诱导分化出形态及功能特征与M细胞极其类似的M样细胞,如图2A所示。des Rieux等[16]对上述方法进行了优化,该方法Raji B细胞与Caco-2细胞通过聚碳酸酯膜密切接触,促进了M样细胞的分化,如图2B所示。可以利用免疫组织化学法检测M样细胞表层,若出现β1和α5β1整合蛋白的表达,即可证明M样细胞的形成[17]。另外,Pielage等[18]利用DNA微阵列分析并比较M样细胞和Caco-2细胞基因表达水平的差别,发现凝集素-9可以作为M细胞表面标记物。
2.1 评价药物胃肠道吸收机制 M细胞可以用来研究一些生物大分子及纳米粒子等在胃肠道的转运情况。des Rieux等[16]用M细胞研究聚苯乙烯羧酸纳米粒(粒径为200 nm)的转运机制,分别加入乙二醇双(2-氨基乙基醚)四乙酸和吞饮抑制剂时发现,前者对纳米粒的转运无影响,后者能限制其转运,且具有能量和温度依赖性,说明聚苯乙烯羧酸纳米粒在M细胞上是通过细胞吞噬作用被摄取,而不是经细胞旁路转运。Kadiyala等[19]对壳聚糖-DNA纳米粒在人小肠M样细胞模型和正常肠细胞模型上的转运进行了比较,发现纳米粒在M样细胞上的转运速率是Caco-2细胞的5倍。
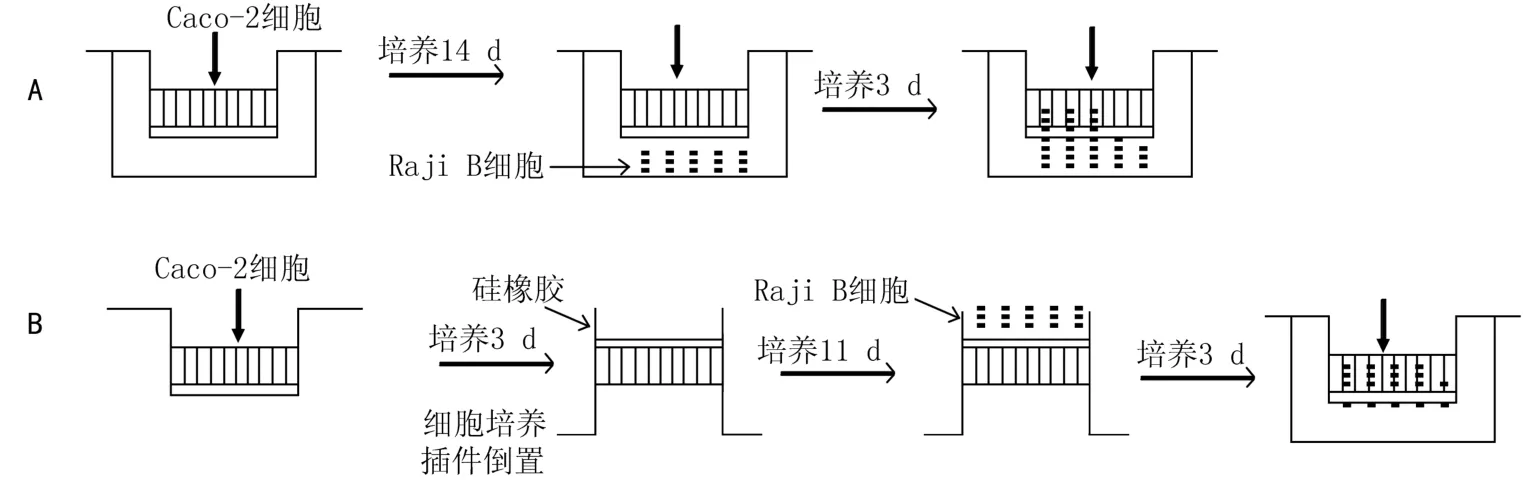
图2 M样细胞模型培养过程
2.2 评价细菌胃肠道转运及抗菌药物应用 有些细菌经M细胞在胃肠道内转运,可以通过M细胞评价细菌转运情况,可为抗菌药物的合理应用提供参考。Tonry等[20]研究炭疽杆菌及其孢子经M细胞和Caco-2细胞的转运情况,发现炭疽杆菌孢子更容易经M细胞转运,为炭疽杆菌发病机制提供参考,从而更准确地指导抗菌药物的应用。
2.3 Caco-2/HT29/Raji B细胞共培养模型 Caco-2、HT29和Raji B这3种细胞共培养时,能同时模拟肠上皮细胞、黏液分泌细胞和M细胞,可考察不同药物的多种吸收机制。Antunes等[21]采用Caco-2/HT29-M TX/Raji B细胞共培养模型,研究胰岛素溶液及其纳米粒的体外渗透情况,新建立的模型能更准确地模拟体内胃肠道环境。A raújo等[22]建立了Caco-2/HT29-M TX/Raji B细胞共培养模型,并筛选了Caco-2和HT29-M TX细胞共培养的比例,当两者比例为90∶10时,共培养细胞模型具有更好的生理学特性。
3 表达酶及转运体胃肠道细胞模型
药物单种细胞模型中,CYP酶和其他转运蛋白的表达低于小肠上皮细胞。一些研究者[23-25]用细胞系转染一些转运体,比如人氨基酸转运体,还有一些外排转运体,例如MDR1,这些修饰的细胞系在载体介导转运的体外渗透模型中具有可预见性。
有的研究者[26,27]以CYP3A4转染的Caco-2细胞为模型,用于评价药物的吸收和代谢情况;有的研究者[28-31]利用MDCK-MDR1细胞模型研究P-gp对药物胃肠道吸收的影响,能有效评价P-gp底物的药物胃肠道吸收情况;而有的研究者[32]则建立了同时表达胃肠道细胞色素酶和外排蛋白的细胞模型,即利用MDCK转染MDR1或MRP2形成单转染模型,并同时转染MDR1或MRP2和CYP3A4形成双转染模型,用于研究药物胃肠道的代谢与转运,并可用于研究CYP3A4和P-gp对药物吸收的影响。
4 炎症病变胃肠道细胞模型
由于没有合适的体外细胞模型模拟炎症状态的胃肠道屏障,治疗炎症的药物评价通常采用动物模型,建立有效模拟炎症状态胃肠道的体外细胞模型对于研发治疗胃肠道炎症药物及其制剂具有重要的现实意义。
Schmohl等[33]建立了体外Caco-2上皮细胞和人类全血的共培养体系,他们建立的免疫系统可以用来研究抗炎药物的胃肠道吸收和模拟免疫调节处理过程。有人[34,35]建立IEC-巨噬细胞共培养模型,主要用于体外评价治疗炎症性肠病药物的胃肠道吸收。Leonard等[36]建立了人胃肠道上皮细胞系-巨噬细胞-树枝状细胞系共培养细胞模型,此模型不仅可以用来模拟炎症性肠病的状态,还可以研究外源性物质与炎症状态的上皮细胞之间的相互作用。
5 其他
陈晓清等[37]构建了Caco-2细胞与乳双歧杆菌、植物乳酸杆菌、大肠杆菌和粪肠球菌组成的混合菌群体外共培养体系,用于评价食源性抗菌药及其耐药菌作用于肠道菌群时对人体健康造成的危害。Le Hégarat等[38]将Caco-2细胞系在Transwell板上培养21 d分化成熟后,将类淋巴母细胞TK6细胞系加入BL层,AP层加入致突变化合物[如苯并[α]-苾(BαP)],在Caco-2细胞代谢转运后靶向于TK6细胞,然后检测转运后代谢物对Caco-2及TK6细胞的基因毒性,结果BαP对Caco-2细胞具有基因毒性,但对TK6细胞无毒性。因为其代谢物不能从AP侧转移至BL侧,说明胃肠道上皮细胞能阻止类似基因毒性药物的损害,同时胃肠道的首过效应也会降低药物的生物利用度。
6 展望
与体内评价相比,体外评价药物胃肠道吸收的方法既便宜又方便,细胞模型已经是制药企业药物研发中最经济的评价药物胃肠道吸收的方法。体外细胞模型能否成功评价药物经胃肠道的吸收情况,取决于其与体内胃肠道特征的相似性。为了能够建立更类似于体内环境的培养体系,应使体外环境与体内环境相吻合,从而使细胞间能相互沟通信息,相互支撑生长和增殖。根据药物的性质挑选合适的细胞共培养模型,有效评价多因素影响过程,比如代谢作用或者免疫反应,旨在增加结论的准确性,扩大其应用范围和评价效率。
目前,细胞共培养在技术和应用方面有以下几点尚待加强:①共培养体系的培养条件仍不成熟,重复性较差,需要进一步优化和统一标准,以保证实验室之间结果的重现性。②人体胃肠道含有多种细胞,细胞之间相互作用复杂,并不能完全反应体内情况,需要加强体外细胞模型评价和体内评价结果的相关性研究,建立准确且完整的药物结构-细胞渗透性-体内吸收三者之间的关系网络图,以实现药物口服吸收体外细胞模型评价方法代替体内评价方法的目标。③细胞共培养需向微型化(如384孔板或1 536孔板)、智能化和自动化方向发展,实现新药及其制剂的快速筛选及评价。相信随着基因蛋白水平研究和细胞培养技术的发展,用于评价药物胃肠道吸收的细胞模型将进一步完善,将为建立更加快捷准确的药物口服吸收评价方法开拓广阔的前景。
[1] Fröhlich E,Roblegg E.M odels for oral uptake of nanoparticles in consumer products[J].Toxicology,2012,291(1-3):10-17.
[2] Chen XM,Elisia I,Kitts DD.Defining conditions for the coculture of Caco-2 and HT29-M TX cells using Taguchi design[J].JPharmacol Toxicol M eth,2010,61(3):334-342.
[3] Behrens I,Stenberg P,A rtursson P,et al.Transport of lipophilic d rug molecules in a new mucus-secreting cell culture model based on HT29-MTX cells[J].Pharm Res,2001,18(8):1138-1145.
[4] Walter E,Janich S,Roessler BJ,et al.HT29-M TX/Caco-2 cocultures as an in vitro model for the intestinal epithelium:in vitro-in vivo correlation w ith permeability data from rats and humans[J].JPharm Sci,1996,85(10):1070-1076.
[5] Woitiski CB,Sarmento B,Carvalho RA,et al.Facilitated nanoscale delivery of insulin across intestinalmembranemodels[J].Int JPharm,2011,412(1-2):123-131.
[6] Rocha RA,Vélez D,Devesa V.In vitro evaluation of intestinal fluoride absorp tion using different cellmodels[J].Toxicol Lett,2012,210(3):311-317.
[7] Mahler GJ,Shuler M L,Glahn RP.Characterization of Caco-2 and H T29-M TX cocultures in an in vitro digestion/cell culture model used to p redict iron bioavailability[J].JNutr Biochem,2009,20(7):494-502.
[8] Vázquez M,Calatayud M,Vélez D,et al.Intestinal transport ofmethy lmercury and inorganicmercury in variousmodels of Caco-2 and HT29-M TX cells[J].Toxicology,2013,311(3):147-153.
[9] Sam M,Linda F,David JB,et al.Melittin as a Permeability EnhancerⅡ:In vitro investigations in human mucus secreting intestinalmonolayers and rat colonic mucosae[J] .Pharm Res,2007,24(7):1346-1356.
[10] M aresca M,M ahfoud R,Garmy N,et al.The M ycotoxin deoxynivalenol affects nutrient absorp tion in human intestinal epithelial cells[J].Amer Soc Nutr Sci,2002,132(9):2723-2731.
[11] Gagnon M,Zihler Berner A,Chervet N,et al.Comparison of the Caco-2,HT-29 and the mucus-secreting HT29-MTX intestinal cell models to investigate Salmonella adhesion and invasion[J].JM icrobiol Meth,2013,94(3):274-279.
[12] Lai YH,D'Souza M J.M icroparticle transport in the human intestinal M cellmodel[J].JDrug Target,2008,16(1):36-42.
[13] Corr SC,Gahan CC,H ill C.M-cells:origin,morphology and role in mucosal immunity and m icrobial pathogenesis[J].FEMS Immunol MedMicrobiol,2008,52(1):2-12.
[14] des Rieux A,Ragnarsson EG,Gullberg E,et al.Transport of nanoparticles across an in vitromodel of the human intestinal follicle associated epithelium[J].Eur JPharm Sci,2005,25(4-5):455-465.
[15] Gullberg E,Leonard M,Karlsson J,et al.Expression of specific markers and particle transport in a new human intestinal M-cellmodel[J].Biochem Biophys Res Commun,2000,279(3):808-813.
[16] des Rieux A,Fievez V,Théate I,et al.An imp roved in vitro model of human intestinal follicle-associated epithelium to study nanoparticle transport by M cells[J].Eur J Pharm Sci,2007,30(5):380-391.
[17] Garinot M,Fiévez V,Pourcelle V,etal.PEGylated PLGA-based nanoparticles targeting M cells for oral vaccination[J].JControl Release,2007,120(3):195-204.
[18] Pielage JF,Cichon C,Greune L,etal.Reversible differentiation of Caco-2 cells reveals galectin-9 as a surface marker molecule for human follicle-associated epithelia and M celllike cells[J].Int JBiochem Cell Biol,2007,39(10):1886-1901.
[19] Kadiyala I,Looa Y,Roy K,et al.Transport of chitosan-DNA nanoparticles in human intestinal M-cell model versus normal intestinal enterocytes[J].Eur JPharm Sci,2010,39(1-3):103-109.
[20] Tonry JH,Popov SG,Narayanan A,et al.In vivo murine and in vitro M-like cellmodels of gastrointestinal anthrax[J].M icrob Infect,2013,15(1):37-44.
[21] Antunes F,Andrade F,A raújo F,et al.Establishment of a triple co-culture in vitro cell models to study intestinal absorption of peptide drugs[J].Eur JPharm Biopharm,2013,83(3):427-435.
[22] A raújo F,Sarmento B.Tow ards the characterization of an in vitro triple co-culture intestine cell model for permeability studies[J].Int JPharm,2013,458(1):128-134.
[23] Han HK,Oh DM,Amidon GL.Cellular uptake mechanism of amino acid ester prodrugs in Caco-2/hPepT1 cells overexpressing a human peptide transporter[J].Pharm Res,1998,15(9):1382-1386.
[24] Annette B,Sibylle H,Kayoshi S,etal.Cell cultures as tools in biopharmacy[J].Eur J Pharm Sci,2000,11(Suppl2):S51-S60.
[25] Tang F,Horie K,Borchardt RT.A re MDCK cells transfected w ith MRP2 gene a good model of the human intestinalmucosa?[J].Pharm Res,2002,19(6):773-779.
[26] Cumm ins CL,Jacobsen W,Christians U,et al.CYP3A4-transfected Caco-2 cells as a tool for understanding biochem ical absorption barriers:studies w ith sirolimus and m idazolam[J].JPharmacol Exper Therap,2004,308(1):143-155.
[27] Korjamo T,Monkkonen J,Uusitalo J,et al.Metabolic and efflux p roperties of Caco-2 cells stably transfected w ith nuclear receptors[J].Pharm Res,2006,23(9):1991-2001.
[28] Agarwal S,Jain R,Pal D,et al.Functional characterization of pep tide transporters in MDCK II-MDR1 cell line as amodel for oral absorp tion studies[J].Int JPharm,2007,332(1-2):147-152.
[29] Xiaokui H,Qi L,Changyuan W,et al.Enhancement effect of P-gp inhibitors on the intestinal absorp tion and antiproliferative activity of bestatin[J].Eur JPharm Sci,2013,50(3-4):420-428.
[30] Hellinger E,Bakk M L,Pócza P,et al.Drug penetration model of vinblastine-treated Caco-2 cultures[J].Eur J Pharmaceut Sci,2010,41(1):96-106.
[31] Brayden DJ,Griffin J.Avermectin transepithelial transport in MDR1-and MRP-transfected canine kidney monolayers[J].Vet Res Commun,2008,32(1):93-106.
[32] Darw ich AS,Neuhoff S,JameiM,etal.Interp lay ofmetabolism and transport in determ ining oral drug absorption and gut wallmetabolism:a simulation assessment using the“advanced dissolution,absorp tion,metabolism(ADAM)”model[J].Curr Drug Metabol,2010,11(9):716-729.
[33] Schmohl M,Schneiderhan-M arra N,Baur N,et al.Characterization of immunologically active drugs in a novel organotypic co-culturemodel of the human gut and w hole blood[J].Int Immunopharmacol,2012,14(4):722-728.
[34] Clayburgh DR,Shen L,Turner JR.A porous defense:the leaky epithelial barrier in intestinal disease[J].Lab Invest,2004,84(3),282-291.
[35] Yasuda M,Furuyashiki T,Nakamura T,et al.Immunomodulatory activity of enzymatically synthesized glycogen and its digested metabolite in a co-culture system consisting of differentiated Caco-2 cells and RAW 264.7 macrophages[J].Food Funct,2013,4(9),1387-1393.
[36] Leonard F,Collnot EM,Lehr CM.A three-dimensional coculture of enterocy tes,monocytes and dend ritic cells to model inflamed intestinal mucosa in vitro[J].M ol Pharm,2013,7(6),2103-2119.
[37] 陈晓清,焦 红,程树军,等.Caco-2细胞与肠道菌共培养初建体外肠道共生模型[J].中山大学学报(医学科学版),2012,33(1):121-126.
[38] Le Hégarat L,Huet S,Fessard V.A co-culture system of human intestinal Caco-2 cells and lymphoblastoid TK 6 cells for investigating the genotoxicity of oral compounds[J].M utagenesis,2012,27(6):631-636.
Application of cell co-culturemodels in absorption of oral drug
LIYing,ZHU Chunyan(Institute of Medicinal Plant Development,Chinese Academy of Medical Sciences and Peking Union Medical College,Beijing 100193,China)
Cell co-culture system can better simulate the inner environment of human body,predict drug transport and metabolism in intestinal environment and increase the relation between in vitro cellmodel and integral animal test.In recent years,co-culture cellmodel plays an increasingly important role in evaluating the absorption of oral drugs,which becomes the highlight in the evaluation of drug oral absorption during new drug discovery.This essay summarized co-culture cellmodel which simulates intestinal environment and their application,and looked into the future of their application in evaluating oral drug intestinal absorption during oral drug discovery.
cellmodel;co-culture system;oral drug;intestinal absorption;new drug screening
R945
A
1006-0111(2015)04-0289-05
10.3969/j.issn.1006-0111.2015.04.001
2014-09-21
2015-03-05[本文编辑]李睿旻
国家自然科学基金面上项目(81274094);协和研究生创新基金项目(10023-1007-1017)
黎 迎,博士研究生.研究方向:口服新型给药系统.Tel:(010)57833263;E-mail:lysole@126.com
朱春燕,研究员,博士生导师.研究方向:新型给药系统.Tel:(010)57833276

