OPG/RANK/RANKL系统在实验动物骨骼发育营养需要评估中的应用
吕建敏
(浙江中医药大学动物实验研究中心,杭州 310053)
OPG/RANK/RANKL系统在实验动物骨骼发育营养需要评估中的应用
吕建敏
(浙江中医药大学动物实验研究中心,杭州 310053)
OPG/RANK/RANKL系统是调节骨代谢的主要信号通路,在维持骨形成和吸收之间的动态平衡中发挥着重要作用。本文主要综述OPG/RANK/RANKL的特点、作用机制,及其在骨代谢疾病、药物和相关营养因素干预效果评价等领域的应用现状,并展望将其引入实验动物骨骼发育营养评估领域的应用前景。
OPG;RANK;RANKL;实验动物;骨骼发育;营养需要
骨骼发育需要多种营养成分参与,这些营养成分(如钙、磷等)不仅是骨骼的重要组成成分,而且对维持正常骨代谢具有重要意义[1]。骨形成和吸收之间的动态平衡是保持正常骨代谢必要条件,而这种平衡需要依靠相应的细胞通路来调节。OPG/RANK/RANKL系统是近年发现的调节骨代谢的重要通路[2-3],由肿瘤坏死因子家族的三个新成员―①护骨素(osteoprotegerin,OPG)、②核因子κB受体活化子(receptor activator of NF-κB,RANK)和③核因子κB受体活化子配体(receptor activator of NF-κB ligand,RANKL)组成。目前,有关OPG/RANK/RANKL系统在骨代谢疾病病因学及药物疗效评价研究等领域报道很多,而在营养干预效果评价方面则报道较少。因此,本文在阐述OPG/RANK/RANKL系统的特点和作用机制的基础上,对近年来该系统在骨代谢疾病及相关药物和营养因素疗效评价的研究进展作一综述,为将其广泛应用于与骨代谢相关的营养学研究提供理论依据。
1 OPG/RANK/RANKL系统概述
1.1 OPG,RANK和RANKL的结构与功能
1.1.1 骨保护素(OPG)
OPG是由Simonet等[4]于1997年首先在大鼠上发现的一种新型肿瘤坏死因子,属于TNF受体(tumor necrosis factor receptor,TNFR)超家族成员。大鼠、人、和小鼠OPG同源性大于85%[4]。OPG mRNA可在小鼠皮肤、肝脏、肺和心脏等组织中表达[4]。OPG蛋白属分泌型糖蛋白,无疏水跨膜区,氨基酸全长为401个残基,包含21个氨基酸的信号肽和380个氨基酸成熟肽[5],共7个结构域(D1~D7):D1~D4区为半胱氨酸含量丰富区域,位于N端,主要功能是抑制破骨细胞分化和骨吸收;D5、D6区是位于C端的高度同源的两个区域,为死亡域。D7区含有肝素结合位点,可通过N端糖基化,形成巯基化二聚体[4]。
OPG主要功能是作为诱饵受体调节配体和受体之间的相互作用。如OPG与RANKL具有高度结合能力,是RANKL的诱饵样受体,对RANK信号起着负调控的作用。体外实验表明OPG可抑制破骨细胞(osteoclast,OC)产生[4]。
1.1.2 NF-κB受体活化因子(RANK)
RANK也属于TNF受体家族成员,是RANKL的信号受体,属I型跨膜蛋白。人的RANK蛋白是由616个氨基酸的组成的同源三聚体,其胞外结构由208个氨基酸组成,包含4个富含半胱氨酸的重复序列[6],为N-末端,主要功能是与RANKL的C-端结合并产生传递信号。RANK在细胞内的信号传递需要由细胞浆内的肿瘤坏死因子受体相关因子(TRAFs)介导[7]。RANK蛋白的胞内结构域有383个氨基酸,在细胞膜末端的氨基酸胞质尾区可与TRAF家族中的1、2、3、5因子结合,使其活性被激活;在细胞膜近端Pro-X-Glu-X-X-(aromatic/acid residue)结合部与TRAF6结合[8]。RANK mRNA广泛存在于胸腺、肝脏、骨胳肌、结肠、胰腺、肾上腺、心脏、乳腺、骨髓、肺、脑、肾脏、皮肤等组织器官[9]。
RANK信号区别于其他TNFR超家族成员的一个重要特征是它不仅可激活典型的NF-κB信号通路,还可以激活非典型的NF-κB信号通路[10]。RANK的主要功能是与RANKL结合形成RANKRANKL信号,在相关信号转导因子的参与下,促进OC的形成和骨吸收功能的加强[11]。
1.1.3 RANK的配体(RANKL)
RANKL是由4个独立的研究团队分别发现并加以命名的肿瘤坏死因子超家族成员[12],因此还被称为肿瘤坏死因子活化诱导细胞因子(TRANCE),破骨细胞分化因子(ODF),护骨素配体(OPGL)。
RANKL蛋白属II型跨膜蛋白,与肿瘤坏死因子超家族(TNFSF)成员中的TRAIL,FasL和TNF-a具有同源性[13]。人和小鼠的RANKL蛋白具有83%的同源性[11],小鼠的RANKL蛋白包含316个氨基酸,由细胞外C-端受体作用区域和跨膜区域组成。研究发现RANKL蛋白存在膜结合和分泌型两种形式[9]。RANKL蛋白有3种不同的亚型,最短的亚型缺乏细胞内区域和跨膜区,以分泌型存在于细胞外基质中,对RANKL活性具有抑制作用[14]。
RANKL mRNA可在多种组织表达,包括T淋巴细胞,成骨细胞,骨细胞,骨基质和肺[12]。RANKL不仅可与功能性受体―RANK结合,还可以与诱饵受体―OPG结合[12]。RANKL对骨代谢具有重要调节作用,它与RANK结合后产生的转录活化信号,可促进OC的分化成熟[13]。
1.2 OPG/RANK/RANKL系统对骨代谢的调节机制
OPG/RANK/RANKL系统在维持骨吸收和骨形成两者动态平衡,防止骨的丢失,保证正常的骨转化更新等方面起着关键调节作用[15],并主导了破骨细胞(OC)的形成和活化的调控[16]。其作用机制是[16]:破骨细胞(OC)和成骨细胞(osteoblast,OB)分别介导骨的吸收和合成过程,RANKL主要由成骨细胞前体细胞及骨髓基质细胞表达,RANK主要由破骨细胞表达,RANKL与RANK结合,可促进破骨细胞分化、融合及成熟,并抑制破骨细胞凋亡,从而促进骨的吸收;与此同时,成骨细胞也表达OPG,OPG实质上是一种受体诱饵,可与RANKL家族竞争性结合,抑制破骨细胞的形成、成熟。RANK与OPG竞争性地与RANKL的结合,使骨吸收和骨形成处于平衡状态(图1)。因此,正常情况下,骨组织中RANKL、RANK与OPG三者相互间比值保持恒定,一旦由于某种原因使这种稳态被打破,就可能引起骨代谢紊乱,导致相应骨代谢疾病的发生。如OPG缺失小鼠具有骨质疏松的骨病变[17],其病因就是OPG缺失使体内OPG、RANK、RANKL相互间的正常比例被打破,RANKL与RANK结合的能力增强,从而促进了OC的增殖。
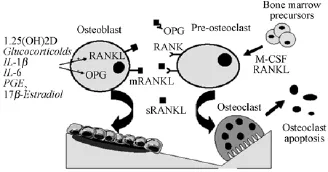
图1 OPG/RANK/RANKL对骨代谢的调节机制[16]Fig.1 Regulatory mechanisms of bone remodeling:role of RANK,RANKL,and OPG in osteoclast activation
2 OPG/RANK/RANKL系统在骨代谢疾病和药物疗效研究中应用现状
在骨代谢疾病研究方面,大量资料显示,许多先天遗传性骨病[18-19](和后天获得性骨代谢疾病[20-21]都与OPG/RANK/RANKL系统发生异常密切相关。遗传性骨病变的产生的主要原因就是OPG/RANK/RANKL系统中的相关基因编码发生了改变,如家族扩张性骨质溶解症(FEO)的发病与RANK基因编码外显子1瞬间框内复制有关[18];少年Paget’s病的骨病变主要由OPG基因编码发生突变所致[19]。OPG/RANK/RANKL系统在骨质疏松和类风湿关节炎等后天获得性骨代谢疾病的发病过程中也起着重要作用。目前已证实,绝经期后妇女骨质疏松的发病原因是由于绝经后体内雌激素水平急剧下降,引起骨髓细胞RANKL水平的上升,RANKL/OPG的比值发生改变,增强了OC的骨吸收功能[20];有关类风湿关节炎(RA)大鼠模型的研究也证明在RA形成过程中存在RANK/RANKL/OPG表达异常[21],该研究显示,RA模型动物的关节滑液中CD3+T细胞的RANK、RANKL表达明显升高,并伴有OPG表达减少。
另一方面,与骨代谢疾病相关的药效学研究显示,一些与此相关的激素(如甲状旁腺激素(PTH)、糖皮质激素、雌激素)和药物都可调节OPG、RANKL、RANK的表达。如甲状旁腺激素(PTH)可使RANKL表达持续升高,而对OPG产生起到抑制作用,导致骨吸收作用增强[22];王建忠等[23]研究发现,糖皮质激素可使OPG mRNA表达降低,RANKL mRNA表达增高,使RANKL/OPG比值上升,从而加速破骨细胞的分化。Shu等[24]观察了一种植物异黄酮类药物―鹰嘴豆芽素A(BCA)对卵巢切除大鼠骨丢失的保护作用,发现BCA可降低大鼠股骨组织RANKL/OPG mRNA比值,起到防止骨破坏作用;冯建书等[25]在研究仙灵骨葆的疗效时也证实该药物对骨质疏松模型大鼠的治疗作用是通过促进OPG的表达,抑制RANK及RANKL的表达来实现。以上一系列研究表明PG/RANK/RANKL系统可较直观反映骨代谢疾病的发病原因和药物的干预效果,是研究骨代谢特征的重要标志物。
3 OPG/RANK/RANKL系统在骨骼发育营养需要研究中的应用前景
3.1 传统骨骼发育营养需要研究方法应用于实验动物的局限性
在骨骼发育营养需要(如钙、磷等需要量的研究)研究的方法学上,传统动物营养学通常是通过“剂量―反应”、“析因法”及“平衡试验”等方法来研究和确定动物钙、磷需要量的推荐值,主要采用的观察指标是动物的生长性能,平衡状况指标、骨骼和血液指标[26]。以上方法虽然操作简单,但存在工作量大,准确度低,不能精确反映钙、磷等相关营养摄入对骨代谢的影响等缺点。同时,与经济动物的生产目的不同,实验动物的饲养目的是为科学研究提供健康、标准的实验材料。在研究实验动物钙、磷需要量时,不仅要考虑宏观水平上的标准化,更需要关注一些微观的、更能精准反映骨代谢情况的生理指标。
3.2 OPG/RANK/RANKL系统在骨骼营养学研究中的应用现状
随着生物技术的发展,分子生物学为营养学研究提供了新的方法,营养学研究的相关参数也从宏观向微观发展。一些调控营养物质代谢的关键基因和蛋白逐步受到人们的重视。如在钙、磷等营养成分与骨代谢关系的研究过程中,人们发现钙、磷摄入水平的变化会引起体内一些激素和细胞因子水平的改变(如甲状旁腺激素(PTH)、降钙素(CT)、1α,25-双羟维生素D3等),它们作用于成骨细胞和/或破骨细胞,进而影响骨代谢并使骨组织形态发生改变[27]。而以上因素对骨代谢的作用最终都是通过直接或间接调节OPG、RANK和RANKL的表达来实现的[28]。因此,OPG/RANK/RANKL系统是反映骨代谢水平的核心环节。
目前,有关营养因素对OPG/RANK/RANKL系统影响的研究报道较少,但仅有的几个报道都充分证明该系统可作为反映骨代谢水平的重要指针,用于营养干预对骨代谢影响的系统性研究。如Shin-ichi等[29]研究高磷日粮对大鼠骨代谢的影响,发现高磷日粮可显著提高大鼠股骨中RANKL mRNA的表达,导致破骨细胞数量增加和骨量的大量丢失。Dan Liang M等[30]利用体外细胞培养方法,观察了微量元素锌对MC3T3-E1成骨细胞增殖的影响,发现适量的锌可使细胞内OPG基因和蛋白的表达显著提高,并推断锌可能是通过改变成骨细胞中的OPG表达水平来影响骨的重塑,且锌与骨骼形成和吸收的动态平衡间存在一定剂量关系。Spyridon Kanellakis等(2012)[31]在研究富含钙、磷、VD和VK的营养日粮对绝经妇女骨代谢影响时,首次以血清OPG、RANKL的水平为主要参数来评估营养干预对骨代谢的作用效果,为骨骼营养学的研究提供了新的途径。据此,我们可以将OPG/RANK/RANKL作为骨骼发育营养需要研究的一种新手段,通过定量研究某种营养成分对OPG/RANK/RANKL表达的影响,探询营养因素与RANK/RANKL/OPG表达之间的相关性,最终较精确地评估动物对该种营养成分的需要量。
4 总结
OPG/RANK/RANKL系统是近年来骨科学研究的重大发现,不仅为骨代谢疾病发病机制和治疗手段的研究开辟了新方向,也为骨骼营养方法学研究提供了一种全新思路。OPG/RANK/RANKL系统在骨骼营养学研究中应用的不断完善,必将为营养学研究带来广阔的前景。
[1]付强,刘源.钙、磷与维生素D对动物骨代谢的影响研究进展[J].中国比较医学杂志,2006,16(8):502-505.
[2]Morinaga T,Nakagawa N,Y asuda H,et al.Cloning and characterization of the gene encoding human osteoprotegerin/osteoclasto-genesis inhibitory factor[J].Eur J Biochem,1998,254:685.
[3]Yun TJ,Chaudhary PM,Shu GL,et al.OPG/FDCR-1,a TNF receptor family member,is expressed in lymphoid cells and is upregulated by ligating CD40[J].J Immunol,1998,161(11):6113-6121.
[4]Simonet WS,Lacey D,Dunstan C,et al.Osteoprogerin:a novel secreted protein involved in the regulation of bone density[J].Cell,1997,89:309-319.
[5]Yamaguchi K,Kinosaki M,Goto M,et al.Characterization of structural domains of human osteoclastogenesis inhibitory factor[J].J Biochem,1998,273(9):5117-5123.
[6]Kanazawa K,KudoA.Self-assembled RANK induces osteoclastogenesis ligand-independently[J].J Bone Miner Res.2005,20(11):2053-2060.
[7]GalibertL,Tometsko ME,Anderson DM,etal.The involvement of multiple tumor necrosis factor receptor(TNFR)-associated factors in thesignalingmechanismsofreceptor activator of NF-kappaB,a member of the TNFR superfamily[J].J Biol Chem.1998,273(51):34120-34127.
[8]Ye H,Arron JR,Lamothe B,Cirilli M,et al.Dis-tinct molecular mechanism for initiating TRAF6 signalling[J].Nature,2002,418(6896):443-447.
[9]Silva I,Branco JC.Rank/Rankl/opg:literature review[J].Acta Reumatol Port,2011,36(3):209-218.
[10]姚静,侯加法.OPG/RANKL/RANK系统的研究进展[J].动物医学进展,2006,27(2):5-9.
[11]Boyce BF.Advances in theregulation of osteoclasts and osteoclast functions[J].J Dent Res,2013,92(10):860-867.
[12]Anderson DM,Maraskovsky E,Billingsley WL,et al.A homologue of the TNF receptor and its ligand enhance T-cell growth and dendritic-cell functio[J].Nature,1997,390(6656):175-179.
[13]Wong BR,Josien R,Lee SY,et al.TRANCE(tumor necrosis factor[TNF]-related activation-induced cytokine),a new TNF family member predominantly expressed in T cells,is a dendritic cell-specific survival factor[J].J Exp Med,1997,186(12):2075-2080.
[14]Ikeda T,Kasai M,Suzuki J,et al.Multimerization of the receptor activator of nuclear factor-kappaB ligand(RANKL)isoforms and regulation of osteoclastogenesis[J].J Biol Chem,2003,278(47):47217-47222.
[15]Patrick Garnero.New developments in biological markers of bone metabolism in osteoporosis[J].Bone,2014,66:46-55.
[16]Damaris Vega,Naim M.Maalouf,The Role of Receptor ActivatorofNuclear Factor-B(RANK)/RANK Ligand/Osteoprotegerin:ClinicalImplications[J].TheJournalof Clinical Endocrinology&Metabolism,2007,92(12):4514-4521.
[17]Bucay N,Sarosi I,Dunstan CR,et al.Osteoprotegerin-deficient mice develop early onset osteoporosis and arterial calcification[J].Genes Dev,1998,12(9):1260-1268.
[18]HughesAE,Ralston SH,MarkenJ,etal.Mutations in TNFRSF11 A,affecting the signal peptide of RANK,cause familial expansile osteolysis[J].NatGenet,2000,24(1):45-48.
[19]Whyte MP,Obrecht SE,Finnegan PM,et al.Osteoprotegerin deficiency and juvenile Paget’s disease[J].N Engl J Med,2002,347(3):175-184.
[20]Eghbali-Fatourechi G,Khosla S,Sanyal,et al.Role of RANK ligand in mediating increased bone resorption of in early postmenopausal women[J].Clin Invest,2003,111(8):1120-1122.
[21]王建杰,罗文哲,齐建祥,等.川芎嗪对类风湿关节炎模型大鼠关节滑液RANK/RANKL/OPG表达的影响[J].中国老年学杂志,2011,31:833-835.
[22]Locklin RM,Khosla S,Riggs BL.Mechanisms of biphasic arrabolic and catabolic effects of parathyroid hormone(PTH)on bone cells[J].Bone,2001,28(Suppl):80.
[23]王建忠,王坤正,时志斌,等.长期应用糖皮质激素对大鼠股骨头骨组织OPG/RANKL mRNA表达的影响[J].西安交通大学学报(医学版),2008,12(6):629-632.
[24]Shu-Jem Su,Yao-Tsung Yeh,Huey-Wen Shyu.The Preventive Effect of Biochanin A on Bone Loss in Ovariectomized Rats:Involvement in Regulation of Growth and Activity of Osteoblasts and Osteoclasts[J/OL].Evidence-Based Complementary and Alternative Medicine,2013,Article ID 594857,10 pages.http://dx.doi.org/10.1155/2013/594857.
[25]冯建书,付强,闫世杰,等.仙灵骨葆对骨质疏松大鼠OPG/RANK/RANKL表达的影响[J].现代生物医学进展,2012,12(23):4438-4441.
[26]赵智力,王洪荣.评定反刍动物钙、磷营养需要的指标[J].畜牧与饲料科学,2005,4:14-16.
[27]俞路,王雅倩,章世元.动物钙营养代谢的基因调控探讨[J].猪与禽,2007,27(4):61-62.
[28]L.C.Hofbauer,C.A.Kühne,V.Viereck.The OPG/RANKL/RANK system in metabolic bone diseases[J].J Musculoskel Neuron Interact,2004,4(3):268-275.
[29]Shin-ichi Katsumata,Ritsuko Masuyama,Mariko Uehara,et al.High-phosphorus diet stimulates receptor activator of nuclear factor-kB ligand mRNA expression by increasing parathyroid hormone secretion in rats[J].British Journal of Nutrition,2005,94,666-674.
[30]Dan LM,Yang AW,Guo BL,et al.Upregulates the Expression of Osteoprotegerin in Mouse Osteoblasts MC3T3-E1 Through PKC/MAPK Pathways[J].Biol Trace Elem Res,2012,146:340-348.
[31]Spyridon Kanellakis,George Moschonis,Roxane Tenta,et al.Changes in Parameters of Bone Metabolism in Postmenopausal Women Following a 12-Month Intervention Period Using Dairy Products Enriched with Calcium,Vitamin D,and Phylloquinone(Vitamin K1)orMenaquinone-7(Vitamin K2):The Postmenopausal Health Study II[J].Calcif Tissue Int,2012,90:251-262.
Prospect of OPG/RANK/RANKL system in assessing nutrient requirement for bone development in laboratory animal
LV Jian-min
(Laboratory Animal Research Center,Zhejiang Chinese Medical University,Hangzhou 310053,China)
OPG/RANK/RANKL system is an important signaling pathway in regulating bone metabolism,which plays key role in maintaining bone homeostasis.This paper focus on characteristic and regulation mechanism of OPG/RANK/RANKL system,and its current utility in the areas of bone metabolism diseases,pharmacodynamic and nutrient facts assessment.Furthermore,the prospect of OPG/RANK/RANK system in assessing nutrient requirement for bone development in laboratory animal was elaborated.
OPG;RANK;RANKL;Laboratory animal;Bone development;Nutrient requirement
R-332
A
1671-7856(2015)11-0076-06
10.3969.j.issn.1671-7856.2015.11.016
浙江省科技厅资助项目基金(2014C37008);浙江中医药大学比较医学创新团队基金(XTD201301)。
吕建敏(1971-),女,研究员,博士,研究方向:实验动物营养。E-mail:ljm6666@163.com。
﹞2015-10-15

