GROβ在基础及肿瘤研究领域的新进展
孙思进,彭小忠,高红军
(1.中国医学科学院 基础医学研究所2011级临床医学本科;2.中国医学科学院 基础医学研究医学分子生物学国家重点实验室,北京100005;3.煤炭总医院 检验科,北京100028)
1 GROβ 简介
趋化因子根据N端半胱氨酸残基所在位置被分为CXC、CC、CX3C 和C 4个家族,gro 基因编码的蛋白是CXC 趋化因子家族的成员,4个半胱氨酸残基通过二硫键相连[1]。在人体中,趋化因子系统共编码50多个蛋白配体及超过20个蛋白受体,受体均为G 蛋白耦联受体[1]。生长相关基因产物β(growth-related gene productβ,GROβ)是一种小的趋化因子,又名C-X-C 趋化因子配体[chemokine (CX-C motif)ligand 2,CXCL2],为CXC家族的成员之一。GROβ的受体为C-X-C 趋化因子受体2[chemokine (C-X-C motif)receptor 2,CXCR2]。表达TLR4的巨噬细胞被革兰阴性菌的内毒素活化后分泌GROβ。通过释放GROβ,机体发生炎性反应,启动对中性粒细胞的趋化作用[2]。后续研究发现GROβ是一个功能广泛的细胞因子,其在肿瘤方面的作用开始引人关注。
后续又发现另外2个GRO蛋白。尽管3个GRO蛋白的一级结构十分相似,但3个蛋白由3个不同的独立基因表达产生。这3个基因都位于4q21,连接十分紧密。
2 GROβ的基因及其相关结构
2.1 GROβ的基因结构
GROβ的基因由4个外显子和3个内含子组成,3'端有一个大约700 bp的非翻译区[3]。GROβ的基因序列与另外两个GRO 基因(GROα 与GROγ)的序列高度相似,其与GROα 基因的重合率达93%,但上游调节区域有很大的不同,预示着3个基因的转录可能受不同物质调节。后续实验发现同一供体的不同组织细胞GRO蛋白的表达谱是不同的,受不同物质诱导的GRO蛋白表达谱也是不同的,说明gro 基因的表达具有组织特异性及信号特异性[3]。这种精细的表达调控过程及有2个相似基因(groα,groγ)的现象恰恰也意味着GROβ在人体中发挥着重要的生理作用。
2.2 GROβ的mRNA 结构
mRNA 3'非翻译区序列可通过与mRNA的结构元件发生相互作用,在转录后水平调节mRNA的翻译[4]。研究表明GROβ mRNA 3'非翻译区序列与mRNA的稳定性相关,保证mRNA的快速降解。后续研究发现其中富含UA的序列也对翻译的效力有影响[4]。
2.3 GROβ 蛋白的结构
GROβ 共由107个氨基酸组成。图1显示了一些GROβ 蛋白重要的结构域。RCXC 序列(Arg-Cys-X-Cys)为CXC家族成员的重要特征,它可能是与CXC家族受体结合的必要条件。N 环也可能参与受体结合过程[6]。从N端至C端分布着许多糖胺聚糖结合位点,糖胺聚糖参与集中趋化因子至特定细胞的过程。N端的ELR (Glu6-Leu7-Arg8)结构以及GPH(Gly32-Pro33-His34)结构对受体的亲和力发挥重要作用[7]。ELR 在所有CXC家族成员的作用为启动第一个半胱氨酸与中性粒细胞的结合,并激活该细胞。
GROβ的三维结构在1999年通过磁共振的方法获得(图2)。GROβ 以同源二聚物的形式存在,由6个反向平行的β 片层和1对具有二重对称性的螺旋组成[5]。因此每1个GROβ 单体含有3个β片层(位置分别为25 -29aa、39 -44aa、49 -52aa),C端具有一个α 螺旋。
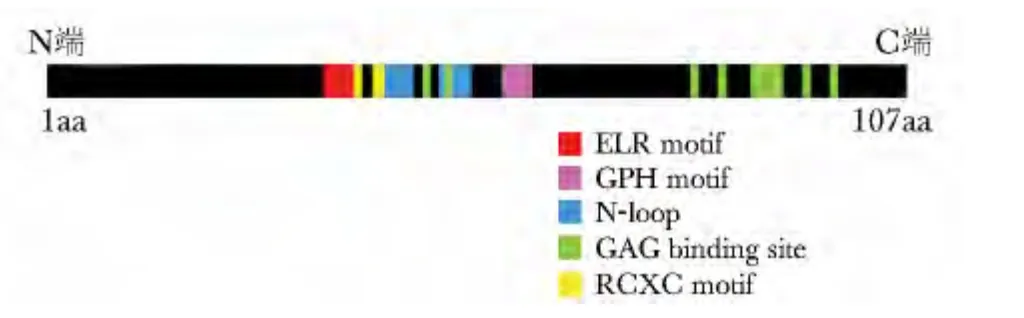
图1 GROβ 蛋白的保守序列Fig1 Conserved sequence of GROβ protein

图2 GROβ的三维结构[5]Fig2 Three dimensional structure of GROβ protein
3 GROβ的功能
GROβ是一个强大的细胞因子,调控着许多生理过程。GROβ 参与平滑肌细胞迁移、骨骼重塑、吸引中性粒细胞至炎性反应部位、维持牙周组织稳态和促进肿瘤迁移等过程[2,8-10]。
经Toll 样受体(Toll-like receptor,TLR)激活后的巨噬细胞会分泌GROβ,参与对中性粒细胞的趋化作用,从而参与炎性反应的初始阶段[2]。在一部分糖尿病患者中,由于胰岛β细胞自身分泌GROβ等趋化因子促进白细胞的募集,对胰岛B 细胞进行破坏,造成糖尿病的发生[11-12]。这也说明GROβ 可能参与排斥反应的调节过程,对细胞因子这方面特性加以研究可能对组织移植、器官移植和自身免疫病的治疗有所帮助。
对艾滋病与神经梅毒的研究[13]发现,同时患有艾滋病与神经梅毒的患者脑脊液中GROβ的浓度远高于单独患有艾滋病患者的浓度。这为诊断这两种疾病提供了新的检验思路。
4 GROβ在肿瘤研究方面的进展
趋化因子本是一类在生理条件下发挥重要作用的蛋白质,负责细胞骨架的重构、细胞迁移、参与免疫反应等。然而,近年的研究表明很多趋化因子还参与癌症的发生与恶化。CXC家族的趋化因子就发挥着肿瘤微环境的构建功能。
血管生成对于肿瘤的生长是至关重要的,同时也是一些肿瘤预后的重要指标。在肿瘤血管生成领域的研究发现大量促血管生成因子如血管内皮生长因子A、胎盘生长因子等[14]。事实上,由趋化因子介导的血管生成作用也在恶性肿瘤中扮演着重要角色[15]。在人体黑色素瘤细胞中,CXC家族配体与受体均在细胞内大量表达,表达水平受细胞来源影响呈现动态变化[16]。遗传学研究表明在CXC 基因位点4q13的重复突变将增大黑素瘤的患病风险,说明CXC家族的成员参与肿瘤的发展与转移过程[17]。针对GROβ在人体黑色素瘤中所起的作用还需进一步研究。
在食管癌方面发现依靠顺铂的化学疗法疗效差,分子生物学显示早期生长调节因子1EGR1(early growth regulator 1,EGR1)可能是GROβ的下游因子[18]。敲除EGR1 或GROβ 基因的细胞抑制由顺铂诱导的凋亡,具体表现为caspase的激活被延迟。临床研究发现在食管癌患者血清中GROβ的含量明显增高,并且增高的程度与肿瘤的大小、肿瘤分期以及淋巴结扩散程度呈现正相关[18]。这些说明GROβ 可能在肿瘤的形成、生长以及转移过程中均发挥重要作用。在移植了食管瘤的小鼠中,利用替莫唑胺进行干预后可有效抑制肿瘤的发展并提高存活率[19]。
在卵巢癌与子宫内膜癌方面,实验表明黄体酮和骨化三醇可以抑制癌细胞内GROβ 蛋白的表达,而GROβ 蛋白的低表达使细胞的侵袭性降低,同时与癌细胞转移相关的蛋白表达也受到抑制[20]。在口腔鳞状细胞癌中,通过对两组细胞进行微阵列分析,发现GROβ 高表达的细胞系易发生骨质破坏[21]。同时,骨髓脂肪细胞分泌GROβ 可加速前列腺癌对骨骼的侵袭[22]。
肿瘤干细胞是一小部分在肿瘤组织中维持增殖及分化能力细胞,并赋予肿瘤组织药物抵抗和转移的能力[23]。在乳腺癌中的研究发现CXCR1/2 通路的激活可促进肿瘤干细胞的活性[24],CXCR4的激活可上调CXCR2 及其配体的表达,提高细胞淋巴结转移的能力[25]。
综上所述,GROβ在不同肿瘤组织中发挥不同的作用,受所处环境的影响而改变,具体的作用机制尚需进一步深入研究。
5 小结与展望
GROβ是一个功能广泛的细胞因子,由于它在细胞凋亡以及细胞增殖方面均发挥作用,因此不难将它与癌症的发生机制联系在一起。CXC家族的许多成员在肿瘤产生、增长和转移等方面均发挥重要作用。因此,了解其结构、信号通路、分子机制以及标志对肿瘤的治疗与诊断都有着重要意义。与此同时,由于GROβ 与CXC家族其他成员的结构具有高度相似性,掌握GROβ 完整功能与结构将有助于对整个CXC家族的理解。鉴于GROβ 以及其受体CXCR2 已经被临床实验与基础实验证明参与多种肿瘤的作用,应该针对其调控机制进行研究。
[1]Lee HJ,Song IC,Yun HJ,et al.Cxc chemokines and chemokine receptors in gastric cancer:From basic findings towards therapeutic targeting [J].World J Gastroenterol,2014,20:1681-1693.
[2]De Filippo K,Dudeck A,Hasenberg M,et al.Mast cell and macrophage chemokines cxcl1/cxcl2 control the early stage of neutrophil recruitment during tissue inflammation[J].Blood,2013,121:4930-4937.
[3]Haskill S,Peace A,Morris J,et al.Identification of three related human gro genes encoding cytokine functions[J].Proc Natl Acad Sci U S A,1990,87:7732-7736.
[4]Vislovukh A,Vargas TR,Polesskaya A,et al.Role of 3'-untranslated region translational control in cancer development,diagnostics and treatment[J].World J Biol Chem,2014,5:40-57.
[5]Qian YQ,Johanson KO,McDevitt P.Nuclear magnetic resonance solution structure of truncated human grobeta[5-73]and its structural comparison with cxc chemokine family members groalpha and il-8[J].J Mol Biol,1999,294:1065-1072.
[6]Marchler-Bauer A,Zheng C,Chitsaz F,et al.Cdd:Conserved domains and protein three-dimensional structure[J].Nucleic Acids Res,2013,41:D348-352.
[7]Rajarathnam K,Sykes BD,Kay CM,et al.Neutrophil activation by monomeric interleukin-8 [J].Science,1994,264:90-92.
[8]Maeda A,Bandow K,Kusuyama J,et al.Induction of cxcl2 and ccl2 by pressure force requires il-1beta-myd88 axis in osteoblasts[J].Bone,2015,74:76-82.
[9]Zenobia C,Luo XL,Hashim A,et al.Commensal bacteria-dependent select expression of cxcl2 contributes to periodontal tissue homeostasis [J].Cell Microbiol,2013,15:1419-1426.
[10]Al-Alwan LA,Chang Y,Mogas A,et al.Differential roles of cxcl2 and cxcl3 and their receptors in regulating normal and asthmatic airway smooth muscle cell migration[J].J Immunol,2013,191:2731-2741.
[11]Burke SJ,Lu D,Sparer TE,et al.Nf-kappab and stat1 control cxcl1 and cxcl2 gene transcription [J].Am J Physiol Endocrinol Metab,2014,306:E131-149.
[12]Cowley MJ,Weinberg A,Zammit NW,et al.Human islets express a marked proinflammatory molecular signature prior to transplantation[J].Cell Transplant,2012,21:2063-2078.
[13]Tsai HC,Ye SY,Lee SS,et al.Expression of cxcl2 in the serum and cerebrospinal fluid of patients with hiv and syphilis or neurosyphilis [J].Inflammation,2014,37:950-955.
[14]Blonska M,Agarwal NK,Vega F.Shaping of the tumor microenvironment:Stromal cells and vessels[J].Semin Cancer Biol,2015.doi:10.1016/j.semcancer.2015.03.002.
[15]Maru GB,Gandhi K,Ramchandani A,et al.The role of inflammation in skin cancer [J].Adv Exp Med Biol,2014,816:437-469.
[16]Pinto S,Martínez-Romero A,O'Connor Jé E,et al.Intracellular coexpression of cxc-and cc-chemokine receptors and their ligands in human melanoma cell lines and dynamic variations after xenotransplantation [J].BMC Cancer,2014.doi:10.1186/1471-2407-14-118.
[17]Yang XR,Brown K,Landi MT,et al.Duplication of cxc chemokine genes on chromosome 4q13 in a melanomaprone family [J].Pigment Cell Melanoma Res,2012,25:243-247.
[18]Dong QM,Zhang JQ,Li Q,et al.Clinical significance of serum expression of grobeta in esophageal squamous cell carcinoma [J].World J Gastroenterol,2011,17:2658-2662.
[19]Bruyere C,Lonez C,Duray A,et al.Considering temozolomide as a novel potential treatment for esophageal cancer[J].Cancer,2011,117:2004-2016.
[20]Kavandi L,Collier MA,Nguyen H,et al.Progesterone and calcitriol attenuate inflammatory cytokines cxcl1 and cxcl2 in ovarian and endometrial cancer cells[J].J Cell Biochem,2012,113:3143-3152.
[21]Oue E,Lee JW,Sakamoto K,et al.Cxcl2 synthesized by oral squamous cell carcinoma is involved in cancer-associated bone destruction [J].Biochem Biophys Res Commun,2012,424:456-461.
[22]Hardaway AL,Herroon MK,Rajagurubandara E,et al.Marrow adipocyte-derived cxcl1 and cxcl2 contribute to osteolysis in metastatic prostate cancer[J].Clin Exp Metastasis,2015.doi:10.1007/s10585-015-9714-5.
[23]Song IS,Jeong JY,Jeong SH,et al.Mitochondria as therapeutic targets for cancer stem cells[J].World J Stem Cells,2015,7:418-427.
[24]Singh JK,Simoes BM,Howell SJ,et al.Recent advances reveal il-8 signaling as a potential key to targeting breast cancer stem cells [J].Breast Cancer Res,2013,15:210.
[25]Sobolik T,Su YJ,Wells S,et al.Cxcr4 drives the metastatic phenotype in breast cancer through induction of cxcr2 and activation of mek and pi3k pathways[J].Mol Biol Cell,2014,25:566-582.

