STAT3异常激活对人脐带间充质干细胞在乳腺癌微环境中恶性转化的影响
汪 玲,朱 静*,田 杰,2,谭 彬,燕 莎
(重庆医科大学附属儿童医院1.儿童发育与疾病研究教育部重点实验室 儿科学重庆市重点实验室;2.心血管内科,重庆400014)
近年来恶性肿瘤的治疗已成为临床医学研究关注的热点。据报道,间充质干细胞作为载体靶向治疗肿瘤开展了大量实验研究并取得了较好的成果,多项实验已进入临床试验阶段[1-2]。已有研究提示,MSCs 在长期体外培养条件下存在恶性转化的风险[3],但并无针对特定环境中干细胞是否发生生物学特性变化,从而引发潜在的安全应用风险的相关报道。本研究将探寻在MCF-7B 乳腺癌微环境中人脐带间充质干细胞(human umbilical cord mesenchymal stem cells,hUCMSCs)是否存在恶性转化的风险,以及该恶变与STAT3异常激活的关系,从而为hUCMSCs的临床安全应用奠定科学的实验基础。
1 材料与方法
1.1 材料
DMEM/F12 培养基、胎牛血清(Gibco 公司);胰蛋白酶(Sigma 公司);STAT3、c-Myc、Bcl-xL 和GAPDH 引物(上海生工);全蛋白提取试剂盒(凯基生物);抗体:STAT3、p-STAT3、c-Myc 和Bcl-xL(Abcam公司);β-actin(中杉金桥);人脐带间充质干细胞hUCMSCs(重庆市干细胞库惠赠);人乳腺癌细胞系MCF-7B(广州吉妮欧生物科技有限公司)。
1.2 方法
1.2.1 细胞培养:用含10%胎牛血清的DMEM/F12 培养基于37℃,5% CO2孵育箱中培养hUCMSCs 及MCF-7B 细胞,待贴壁增殖至汇合度约90%经0.25%胰蛋白酶消化后按1∶2 传代培养。
1.2.2 实验分组:本研究共设为3 组,空白对照组:10%胎牛血清DMEM/F12 培养基培养hUMSCs 2 周;实验组:MCF-7B 乳腺癌细胞2次培养液与10%胎牛血清DMEM/F12 培养基以1∶1 比例培养hUCMSCs 2 周;阳性对照组:10%胎牛血清DMEM/F12 培养基培养MCF-7B 2 周细胞。
1.2.3 细胞形态学观察:倒置相差显微镜观察各组细胞增殖状态,拍照记录。
1.2.4 流式细胞术检测细胞周期:胰蛋白酶消化并收集1×106个细胞,PBS 清洗两遍后弃上清,70%乙醇1 mL 内固定,4℃过夜,RNase 消化,PI 染色30 min,流式细胞仪检测。
1.2.5 RT-qPCR检测各组细胞STAT3、c-Myc 和Bcl-xL的mRNA的表达:根据RNA 提取试剂盒说明书步骤提取各组细胞RNA,反转录成cDNA,以其为模板进行PCR扩增。目的基因的引物序列如下,以GAPDH 为内参,将空白对照组的mRNA表达量设为1,以2-△△ct计算各组mRNA的相对表达量(表1)。
1.2.6 细胞免疫荧光检测p-STAT3、c-Myc 和BclxL蛋白表达及定位:4%多聚甲醛固定15 min,1%Triton-X 通透10 min,5%牛血清白蛋白室温封闭30 min,加一抗4℃孵育过夜,根据一抗来源加对应二抗37℃孵育1 h,DAPI 染核10 min;封片,荧光显微镜观察。观察10个视野,细胞阳性表达率为阳性细胞数/细胞总数。
1.2.7 Western blot检测p-STAT3、STAT3、c-Myc 和Bcl-xL蛋白表达:按照蛋白提取试剂盒说明提取各组细胞总蛋白,BCA法蛋白定量后加入SDS 上样缓冲液,煮沸使其充分变性。聚丙烯酰胺凝胶电泳后湿转至PVDF膜,5%脱脂牛奶室温孵育1 h,加一抗4℃摇床孵育过夜,PBST 洗膜后根据一抗来源加对应二抗,室温孵育1 h,PBST 洗膜后于凝胶成像系统发光显影。
1.3 统计学分析
采用SPSS17.0 对数据进行统计分析,计量资料以均数±标准差(±s)表示,两个样本均数之间的比较采用独立样本t 检验。
2 结果
2.1 各组细胞形态学特征
对照组hUCMSCs 细胞呈扁平长梭形,排列有序,漩涡状生长。实验组hUCMSCs 经2 周共培养后细胞呈多形性,大小不均,核质比增大,细胞聚集成团状生长,排列紊乱。MCF-7B 细胞贴壁性强,呈多边形,核质比大,细胞成团生长,排列不规则(图1)。

表1 RT-qPCR引物序列Table1 RT-qPCR primer sequence of target gene
2.2 流式细胞术检测各组细胞周期
实验组细胞G1期比例显著低于对照组(P<0.05),S期和G2期均显著高于对照组(P<0.05)(表2)。
2.3 RT-qPCR检测各组细胞STAT3、c-Myc 和Bcl-xLmRNA的表达
实验组细胞STAT3、c-Myc 和Bcl-xLmRNA的表达量均显著高于空白对照组(P<0.05)(图2)。
2.4 细胞免疫荧光检测p-STAT3、c-Myc 和BclxL蛋白表达及定位
p-STAT3表达定位于细胞核,实验组细胞核内表达阳性率为82%,空白对照组核内没有表达;c-Myc表达定位于细胞核,实验组细胞核内表达阳性率为88%,显著高于空白对照组的11% (P<0.05);Bcl-xL 胞质与胞核均有表达,但主要定位于细胞核外膜,实验组细胞表达阳性率为78%显著高于空白对照组的15%(P<0.05)(图3)。
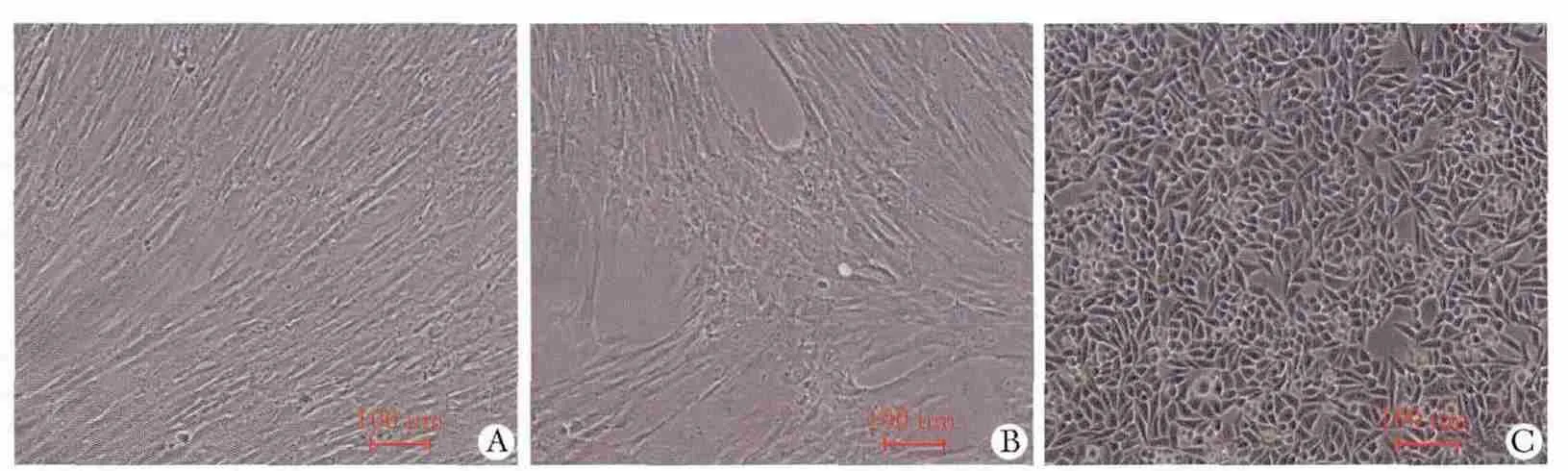
图1 各组细胞形态Fig1 Morphology of cells detected by invertedmicroscope(×100)

表2 各组细胞周期时相布Table2 The cell cycle distribution analysised by FCM
2.5 Western blot检测p-STAT3、STAT3、c-Myc和Bcl-xL蛋白表达
实验组细胞p-STAT3、STAT3、c-Myc 和Bcl-xL蛋白表达量均显著高于空白对照组(P<0.05)(图4)。

图2 各组细胞STAT3、c-Myc 和Bcl-xL的mRNA的表达Fig2 The mRNA expressions of STAT3,c-Myc and Bcl-xL by RT-qPCR

图3 免疫荧光检测p-STAT3、c-Myc 和Bcl-xL蛋白表达及定位Fig3 The protein expression and location of p-STAT3,c-Myc and Bcl-xL(scale bar=100 μm)

图4 Western blot检测p-STAT3、STAT3、c-Myc 和Bcl-xL蛋白表达Fig4 The protein expressions of p-STAT3,STAT3,c-Myc and Bcl-xL by Western blot
3 讨论
间充质干细胞具有低免疫原性和肿瘤趋化性,通过细胞工程学改造使其成为各种抗癌成分的载体,可靶向释放细胞因子、溶瘤病毒和转化药物等治疗肿瘤[4]。据报道,携带IL-12 基因的干细胞不但能够有效地抑制黑色素瘤、乳腺癌和肝癌等肿瘤细胞向淋巴结的转移,还能够明显的增加肿瘤细胞的凋亡[5]。然而国内外均有间充质干细胞发生恶性转化的报道,提示特定的干细胞生存微环境与其恶性转化相关,但具体机制不明[6-7]。本课题组前期研究发现,将大鼠骨髓间充质干细胞与C6 胶质瘤细胞共培养后检测到突变型P53、Cyclin D1 和BclxL 等相关癌基因的表达增高,并可在裸鼠皮下形成肿瘤[8]。
间充质干细胞来源丰富,hUCMSCs 因来源方便、无伦理学问题、不损害供者生命健康,具有良好增殖能力的优势,广泛应用于临床干细胞治疗。hUCMSCs 在靶向治疗过程中暴露于肿瘤微环境,在肿瘤细胞及其分泌的各种活性因子的作用下是否会出现恶性转变,成为临床安全应用hUCMSCs的关键性问题。
肿瘤形成过程中广泛存在信号传导及转化因子3(signal transducer and activator of transcription 3,STAT3)的异常激活,STAT3 处于多条致癌信号通路的交汇点,被认为是一种原癌基因[9]。肿瘤微环境中高分泌的多种细胞因子、生长因子(IL-6、IL-8、TNF-α 和VEGF 等)[10]均可使STAT3 磷酸化激活后入核调控相关靶基因,通过其下游调控基因c-Myc和Bcl-xL的表达参与肿瘤形成[11]。本研究从STAT3异常激活的角度探讨STAT3 与hUCMSCs 恶性转化的关系。
本实验结果显示,与MCF-7B 间接共培养2周后的hUMSCs 排列紊乱,成团聚集生长,黏附性差,折光性增强。细胞周期检测结果表明与肿瘤细胞共培养促进干细胞通过G1-S期这一最重要的周期检测点,其主要受细胞外信号的调控,而失去限制点调控的细胞倾向于在细胞周期中持续循环,导致肿瘤发生。细胞中STAT3 和p-STAT3表达明显增高,且免疫荧光显示p-STAT3的表达主要定位于细胞核内,表明经乳腺癌细胞2次培养液诱导后的干细胞STAT3 高表达并高度激活,磷酸化进入细胞核内对下游基因的转录进行调控。其下游靶基因c-Myc 高表达于恶性肿瘤的发生、发展过程中,是参与调控细胞增殖、分化及凋亡的原癌基因,在细胞周期调控中起重要作用。c-Myc 蛋白高表达与乳腺癌的侵袭、血管生成和预后密切相关[12]。Bcl-xL是Bcl-2 家族的重要成员,在阻遏细胞凋亡,延长细胞寿命中发挥重要作用,而凋亡不足正是许多肿瘤发生的重要机制[13]。本实验在基因及蛋白水平证实了下游c-Myc和Bcl-xL的显著高表达,这与上述文献报道中肿瘤发生发展的相关过程是一致的,表明hUCMSCs 受到MCF-7B 乳腺癌细胞微环境中多种细胞因子、生长因子的持续作用,引发STAT3异常磷酸化激活后与靶基因结合,启动下游c-Myc 和Bcl-xL 等肿瘤相关靶基因表达,致使hUCMSCs 出现增殖失控、凋亡不足、细胞周期紊乱的恶性转化趋势。
综上所述,hUCMSCs 在乳腺癌微环境中存在恶性转化倾向,且STAT3的异常激活是导致hUCMSCs恶性转变的重要因素之一,然而肿瘤信号通路网络调控极其复杂,STAT3 也受到了上游信号分子的多重调控,因此有必要构建STAT3 过表达及干扰模型来进一步验证STAT3异常激活在hUCMSCs 恶性转化中的作用机制。
[1]Seo SH,Kim KS,Park SH,et al.The effects of mesenchymal stem cells injected via different routes on modified IL-12-mediated antitumor activity[J].Gene Ther,2011,18:488-495.
[2]Shah K.Mesenchymal stem cells engineered for cancer[J].Adv Rev,2012,64:739-748.
[3]Rosland GV,Svendsen A,Torsvik A,et al.Long-term cultures of bone marrow-derived human mesenchymal stem cells frequently undergo spontaneous malignant transformation[J].Cancer Res,2009,69:5331-5339.
[4]Yang ZS,Tang XJ,Guo XR,et al.Cancer cell-oriented migration of mesenchymal stem cells engineered with an anticancer gene (PTEN):an imaging demonstration[J].Onco Targets Ther,2014,7:441-446.
[5]Chen X,Lin X,Zhao J,et al.A tumor-selective biotherapy with prolonged impact on established metastases based on cytokine gene-engineered MSCs[J].Mol Ther,2008,16:749-756.
[6]Rubio D,Garcia S,Paz MF,et al.Molecular characterization of spontaneous mesenchymal stem cell transformation[J].PLoS ONE,2008,doi:10.1371/journal.pone.0001298.t004.
[7]Pan Q,Fouraschen SMG,de Ruiter PE,et al.Detection of spontaneous tumorigenic transformation during culture expansion of human mesenchymal stromal cells[J].Exp Biol Med,2014,239:105-115.
[8]张亚兰,周娜,张晓萍.肿瘤微环境中间充质干细胞的相关生物学特性分析[J].解放军医学杂志,2010,35:67-70.
[9]Johnston PA,Grandis JR.STAT3 signaling:anticancer strategies and challenges[J].Mol Interv,2011,11:18-26.
[10]Troester MA,Lee MH,Carter M,et al.Activation of host wound responses in breast cancer microenvironment[J].Clin Cancer Res,2009,15:7020-7028.
[11]Lai SY,Johnson FM.Defining the role of the JAK-STAT pathway in head and neck and thoracic malignancies:implications for future therapeutic approaches[J].Drug Resist Updat,2010,13:67-78.
[12]Gabay M,Li Y,Felsher DW.MYC activation is a hallmark of cancer initiation and maintenance[J].Cold Spring Harb Perspect Med,2014,4:46-54.
[13]Tischner D,Woess C,Ottina E,et al.Bcl-2-regulated cell death signalling in the prevention of autoimmunity[J].Cell Death Dis,2010,1:e48.doi:10.1038/cddis.2010.27.

