YC-1对低氧诱导人肺动脉平滑肌细胞增殖和P53表达的影响
李明星,蒋德旗,2,王 艳,马艳姣,喻珊珊*,王 勇*
(1.南方医科大学珠江医院 药剂科,广东 广州510282;2.玉林师范学院 生物制药教研室,广西 玉林537000)
低氧性肺动脉高压(hypoxia pulmonary hypertension,HPH)是由低氧性肺动脉收缩和低氧性肺血管重构引起的肺动脉压持续升高的不可逆性疾病[1]。肺血管重构是HPH 形成的重要标志,其组织病理学主要表现为中膜平滑肌层的过度增生和肥大,中膜的增厚主要由于肺动脉平滑肌细胞(pulmonary artery smooth muscle cells,PASMCs)的聚集所致。目前研究已证实低氧能够上调HIF-1α (hypoxia-inducible factor-1 alpha)的表达,进而调控下游与增殖相关的靶蛋白,促进PASMCs的增殖[2]。YC-1{3-(5-hydroxymethl-2-furyl)-1-benzylind-azole}是HIF-1α 特异性抑制剂,已被证实其具有优越的保护血管平滑肌受损的活性,并具有剂量依从性。本研究拟在探究YC-1对低氧诱导人HPASMCs增殖、凋亡以及P53表达的影响,并探讨其相关分子机制,为HPH的治疗提供新的策略。
1 材料与方法
1.1 材料
人肺动脉平滑肌细胞(Life 公司);DMEM 高糖培养液、胎牛血清、胰蛋白酶(Gibco 公司);低氧气体(3% O2、5% CO2、92% N2)(佛山德力梅塞尔气体有限公司);CCK-8 试剂盒、AnnexinV/FITC凋亡检测试剂盒(Dojindo 公司);YC-1(Cayman 公司);BCA蛋白测定试剂盒和ECL 显色试剂盒(Thermo 公司);HIF-1α 兔多克隆抗体(Abclonal公司);P53 兔多克隆抗体(万类生物科技公司);GAPDH 兔多克隆抗体(CST 公司);RIPA 裂解液和山羊抗兔辣根过氧化物酶标记二抗(碧云天生物技术研究所)。
1.2 方法
1.2.1 细胞培养:HPASMCs 培养于含10%胎牛血清的DMEM(高糖)培养基中。常氧组培养于含有5% CO2、37℃恒温培养箱中;低氧培养:3% O2、5%CO2、92% N2;培养24 h。
1.2.2 CCK-8 法检测YC-1对HPASMCs增殖率的影响:取对数增殖期HPASMCs 制成细胞悬液,接种于96 孔培养板,每孔5×103个,加入含10% FBS的DMEM 培养基预培养24 h,换无FBS的DMEM培养基培养24 h(以去除血清对细胞增殖的诱导作用),实验组加入不同浓度的YC-1 并置低氧环境中培养。实验分为对照组、低氧组及低氧+YC-1(0.01 和0.05 mmol/L)组,每组设5个复孔;低氧培养24 h后,每孔加入10 μL CCK-8 溶液。在37℃恒温培养箱中孵育2 h,用酶标仪于450 nm 波长下读取吸光度A值,以常氧组A值为100%,计算处理组与常氧对照组A的比值即细胞增殖率。
1.2.3 流式细胞术检测YC-1对HPASMCs 凋亡的影响:将HPASMCs细胞接种于6孔板中,每孔1×105个,加入含10% FBS的DMEM 培养基预培养24 h,换无FBS的DMEM 培养基培养24 h,实验组加入不同浓度的YC-1 并置于低氧环境中培养24 h,按流式细胞仪检测方法收集细胞,用预冷的PBS 洗涤两次,1 000 r/min 离心5 min,Annexin V 和碘化丙啶(PI)双染15 min后,用流式细胞仪检测细胞的凋亡率。
1.2.4 Western blot检测HIF-1α 和P53 蛋白的表达:将HPASMCs 接种于60 mm×15 mm 培养皿内,培养至80%汇合时,换无FBS的DMEM 培养基培养24 h,实验组加入不同浓度的YC-1,低氧处理24 h后,用PBS 洗2次,加入RIPA细胞裂解液,用细胞刮刮取细胞于1.5 mL 离心管中,冰上裂解45 min,12 000 r/min 离心10 min,取上清,用BCA法进行蛋白定量。取25 μg 蛋白进行10% SDS-聚丙烯酰胺凝胶电泳分离,目标分子质量的蛋白采用半干转膜法转至PVDF膜上,5%脱脂奶粉室温封闭2 h,一抗(稀释浓度HIF-1α 1∶1 000、P53 1∶1 000、GAPDH 1∶2 000)4℃孵育过夜。TBST 缓冲液室温洗膜5 min×3次,辣根过氧化物酶(HRP)标记二抗(山羊抗兔1 ∶5000)室温孵育1 h,TBST 漂洗5min×3次。ECL 显色,采用Image J 软件进行吸光度分析。
1.2.5 RT-PCR检测P53 mRNA 水平的表达:按照Trizol 试剂盒提取各组细胞总RNA,反转录成cDNA。引物序列由英潍捷基(上海)贸易有限公司合成,P53 上游引物为5'-CAGCACATGACGGAGGTTGT-3',下游引物为5'-TCATCCAAATACTCCACACGC-3',扩增长度125 bp;GAPDH 上游引物为5'-CGGAGTC AACGGATTTGGTCGTAT-3',下游引物为5'-AGCCT TCTCCATGGTGGTGAAGAC-3',扩增长度210 bp。反应体系是:95℃预变性1 min,94℃变性20 s,60℃退火20 s,72℃延伸20 s,共40个循环。取5 μL PCR 产物,加入6×上样缓冲液,反复吸打混匀后进行电泳,加Maker 5 μL,100 V 电泳30 min,凝胶成像系统观察结果并进行拍照,以P53对GAPDH的吸光度值的比值表示P53的mRNA 相对量。
1.3 统计学分析
数据采用SPSS19.0 统计软件处理,计量资料以均值±标准差(±s)表示,组间比较采用One-way ANOVA。
2 结果
2.1 不同浓度YC-1对HPASMCs细胞增殖的影响
与常氧组相比,低氧组HPASMCs的增殖水平显著增加(P<0.05);低氧条件下,HPASMCs 经过0.01 和0.05 mmol/L YC-1 处理24 h后,其增殖水平显著降低(P<0.05)(表1)。
表1 低氧和YC-1对HPASMCs增殖的影响Table1 Effect of hypoxia and YC-1 on the proliferation of HPASMCs(±s,n=5)

表1 低氧和YC-1对HPASMCs增殖的影响Table1 Effect of hypoxia and YC-1 on the proliferation of HPASMCs(±s,n=5)
*P<0.05 compared with normoxia;#P<0.05 compared with hypoxia+0mmol/L YC-1.
?
2.2 不同浓度YC-1对HPASMCs细胞凋亡的影响
与常氧组相比,低氧未加YC-1 药物组细胞凋亡率显著降低(P<0.05);低氧条件下,YC-1(0.01和0.05 mmol/L)组细胞凋亡率显著增加,但早期凋亡细胞数变化相对较小,晚期凋亡细胞数变化明显(P<0.05)(图1)。

图1 流式细胞术检测各组HPASMCs的凋亡Fig1 Apoptosis rate of HPASMCs in each group detected by flow cytometry(n=3)
2.3 不同浓度YC-1对HPASMCs 胞内HIF-1α、P53 蛋白表达水平的影响
低氧组HPASMCs 胞内HIF-1α蛋白表达水平显著升高,P53 蛋白表达水平显著降低(P<0.05);低氧条件下,加入YC-1 干预后,随着YC-1浓度的升高,HIF-1α蛋白表达显著降低,P53 蛋白表达显著增加(P<0.05)(图2)。

图2 Western blot检测HIF-1α、P53 蛋白表达Fig2 Expressions of HIF-1α and P53 protein by Western blot(n=3)
2.4 RT-PCR 分析不同浓度YC-1对P53 mRNA表达水平的影响
低氧组HPASMCs 胞内P53 mRNA表达水平显著升高(P<0.05);低氧条件下,加入不同浓度YC-1处理后,随着YC-1浓度增大,P53 mRNA表达水平升高,且0.01 和0.05 mmol/L YC-1 组显著高于0 mmol/L组(P<0.05)(图3)。
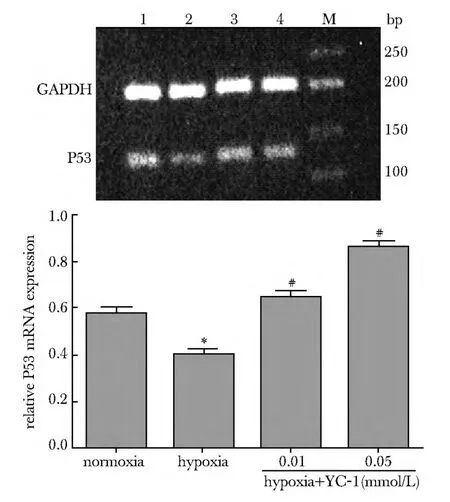
图3 RT-PCR检测不同实验组P53 mRNA表达Fig3 mRNA expression of P53 in different experi mental groups detected by RT-PCR(±s,n=3)
3 讨论
低氧性肺动脉高压是临床上常见的一组严重慢性阻塞性肺循环疾病,具有很大的潜在危险性,可导致右心功能严重受限、衰竭甚至死亡[3]。肺动脉血管的重构是HPH 持续发展的主要病理基础,目前研究认为,由肺动脉平滑肌细胞增殖引起的肺血管中膜增厚是肺动脉血管重构的主要病理改变之一[4]。低氧条件下,PASMCs的异常增殖可导致肺动脉血管收缩性增加、血管壁增厚、管腔狭窄,引起肺动脉压持续升高,最终诱发肺动脉高压[5]。因此,治疗HPH的策略之一就是通过抑制PASMCs的增殖,逆转肺动脉血管的重塑,降低肺动脉压力。
P53是一种肿瘤抑制基因,被认为是肿瘤中最常变化的基因,同时也是主要的细胞周期抑制因子之一,参与了细胞内多种生理和病理过程,包括DNA的损伤修复、细胞增殖、分化、凋亡及血管生成等[6-7]。P53 基因分为野生型和突变型两种,具有抑制细胞分裂和促进细胞凋亡的功能,能抑制某些促使细胞进入有丝分裂的酶活性,阻止细胞从G1期进入S期,发挥对细胞分裂与增殖的负调控作用,同时对DNA 损伤的修复起到保护作用[8]。周期蛋白依赖性激酶(cyclin-dependent kinase,CDK)是细胞分化过程中重要的分子蛋白,调控细胞周期进程。有研究证实,P53 能够上调CDK 抑制因子P21的表达,抑制细胞周期的G1/S期转化,进而抑制低氧诱导的PASMCs增殖,改善肺动脉重塑[9]。
YC-1是一种化学合成吲唑化合物,能够直接激活鸟苷酸环化酶,是近年来发现的一种新型HIF-1α抑制剂,具有很好的抗血管新生及肿瘤治疗活性[10]。有研究表明,在低氧诱导的小鼠PASMCs中,HIF-1α表达的增加,沉默野生型P53 基因,导致P21 下调,促进PASMCs增殖,导致肺血管重塑[11]。
本实验研究发现,低氧能够促进HIF-1α的表达,下调P53的表达,导致HPASMCs增殖;加入不同浓度的YC-1 处理后,HIF-1α的表达降低,P53 蛋白与mRNA表达水平增加,促进HPASMCs的凋亡。由此推测,低氧条件下,YC-1 促进HPASMCs的凋亡机制可能与HIF-1α的下调和P53的上调有关,但HIF-1α 与P53 之间如何相互作用以及是否通过信号通路相互作用仍未得到证实,有待于下一步深入探究。因此,研究YC-1 抗血管新生活性,有望成为治疗HPH的新策略。
[1]Montani D,Price LC,Humbert M,et al.Pulmonary arterial hypertension[J].Orphanet J Rare Dis,2013,8:97-125.
[2]Li Q,Qiu Y,Mao M,et al.Antioxidant mechanism of rutin on hypoxia-induced pulmonary arterial cell proliferation[J].Molecules,2014,19:19036-19049.
[3]Fraidenburg D,Yuan J.Current and future therapeutic targets for pulmonary arterial hypertension[J].High Alt Med Biol,2013,14:134-143.
[4]刘亚,田红燕,闫晓丽,等.贝前列素促进野百合碱诱导肺动脉高压大鼠肺动脉细胞凋亡[J].基础医学与临床,2013,33:955-959.
[5]Bonnet S,Neyron A,Paulin R,et al.Signal transduction in the development of pulmonary arterial hypertension[J].Pulm Circ,2013,3:278-293.
[6]Reed S,Quelle D.P53 acetylation:regulation and consequences[J].Cancers,2015,7:30-69.
[7]史晋叔,涂怀军,张娟,等.P53对胚胎干细胞分化的影响及作用机制[J].基础医学与临床,2014,34:1264-1267.
[8]Woods SJ,Hannan KM,Pearson RB,et al.The nucleolus as a fundamental regulator of the P53 response and a new target for cancer therapy[J].Biochim Biophys Acta,2015,1849:821-829.
[9]Mizuno S,Kadowaki M,Demura Y,et al.p42/44 mitogen-activated protein kinase regulated by P53 and nitric oxide in human pulmonary arterial smooth muscle cells[J].Am J Respir Cell Mol Biol,2004,31:184-192.
[10]Tsui L,Fong TH,Wang IJ.YC-1 targeting of hypoxia-inducible factor-1alpha reduces RGC-5 cell viability and inhibits cell proliferation [J].Mol Vis,2012,18:1594-1603.
[11]Mizuno S,Bogaard HJ,Kraskauskas D,et al.P53 gene deficiency promotes hypoxia-induced pulmonary hypertension and vascular remodeling in mice[J].Am J Physiol Lung Cell Mol Physiol,2011,300:L753-L761.

