加速量热仪研究2,4,6-三氨基-3,5-二硝基吡啶-1-氧化物的热分解
何志伟, 颜事龙, 刘祖亮, 李洪伟
(1. 安徽理工大学化学工程学院, 安徽 淮南 232001; 2. 安徽理工大学安全科学与工程博士后流动站,安徽 淮南 232001;3. 南京理工大学化工学院, 江苏 南京 210094)
1 引 言
2,4,6-三氨基-3,5-二硝基吡啶-1-氧化物(TANPyO)是一种新型高能量密度含能材料[1],以2,6-二硝基吡啶为原料,通过硝化和氧化反应可以合成TANPyO,该化合物综合性能与1,3,5-三氨基-2,4,6-三硝基苯(TATB)基本相当,可以作为潜在高能钝感含能材料候选化合物[2-3]。为保证TANPyO在生产、运输和使用过程中安全可靠,需对其热分解进行深入的研究。2012年本课题组已开展了TANPyO及其造型粉热分解动力学特性的研究[4],2013年,肖鹤鸣报道了压力对TANPyO晶体的结构、导电性、能带吸收以及热动力学性能的影响[5]。这些研究均采用常规热分析方法研究含能材料的热稳定性和安全性,虽然具有精度高和方法固定等优点,但是,试样的取样量为毫克级,不具有代表性,同时也不能给出热分解过程中压力和升温速率随时间的变化关系。而绝热加速量热仪(ARC)具有测试数据丰富、克量级的取样量更具均匀性和代表性以及能够探测到低温条件下慢分解反应[6]等特点,因此在含能材料热安定性研究领域的应用越来越广泛。
为此,本研究利用ARC研究了TANPyO绝热分解过程,对整个绝热分解过程的升温速率、温度和压力随时间的变化进行测试,并通过压力转化分数、动力学参数等计算和表征研究了其热稳定性和热安全性,为TANPyO的安全生产、贮存和使用提供参考。
2 实验部分
2.1 样品
TANPyO为实验室自合成,桔红色固体粉末,粒径0.2~30 μm,熔融分解温度大于340 ℃,理论密度1.876 g·cm-3[1]。样品球为ARC配套组件,材质为钛合金。
2.2 仪器与测试条件
ARC由美国哥伦比亚科学工业公司制造,其详细的原理和结构参见文献[7]。操作温度为0~500 ℃,压力为0~17 MPa,测试样品量为0.1~5 g。测试样品球的质量Mb为15.401 g; 起始设置温度T0为220 ℃; 温升速率灵敏度s为0.02 ℃·min-1; 样品球的比热容cv,b为0.42 J·g-1·℃-1; 根据文献[8],可以得到TANPyO的比热容cv。
3 结果与讨论
3.1 绝热分解过程
对TANPyO进行绝热加速量热测试,样品质量为0.207 g,测试结果如图1所示,特性参数见表1。
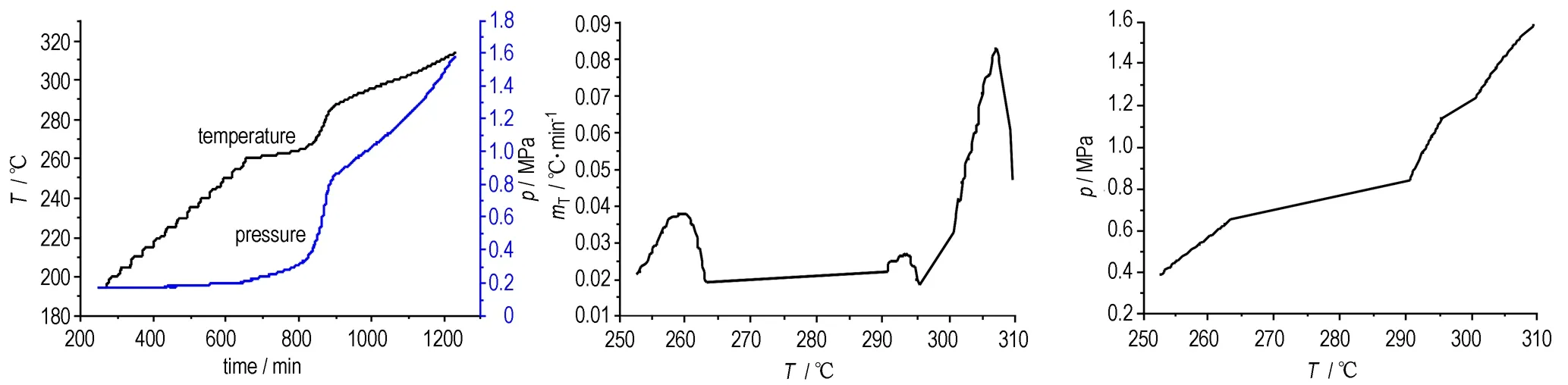
a. temperature and pressure vs time b. temperature rise rate vs temperature c. pressure vs temperature

d. pressure conversion rate vs time e. temperature conversion rate vs time f. time of reaching maximum temperature rise rate(TMR)
图1 TANPyO的绝热分解曲线
Fig.1 Adiabatic decomposition curves of TANPyO
表1 TANPyO的绝热分解特性参数
Table 1 Parameters of TANPyO adiabatic decomposition

T0,s/℃m0,s/℃·min-1p0/MPaTf,s/℃ΔTad,s/℃mm0,s/℃·min-1θm0,s/minTm,s/℃pm/MPapm,s/MPa252.70.0210.394309.444.50.083188.25307.21.5831.581
Note:T0,s, initial decomposition temperature;m0,s, initial temperature rise rate;p0, initial decomposition pressure;Tf,s, maximum decomposition temperature; ΔTad,s, adiabatic temperature rise;mm0,s, maximum temperature rise rate;θm0,s, time from initial temperature rise rate to maximum temperature rise rate;Tm,s, temperature at maximum temperature rise rate;pm, pressure at maximum temperature rise rate;pm,s, final pressure; subscript s is the reaction system between TANPyO and sample ball.
由图1a可知,ARC初始设置温度为195 ℃,在该温度TANPyO没有发生热分解,在ARC经过若干次加热-等待-搜寻的运行周期后,在252.7 ℃探测到TANPyO开始分解的放热效应,在此分解反应之前TANPyO经历了一个缓慢的吸热升温过程。由图1b可知,TANPyO温升速率变化趋势不单一,主要经历了两个升降过程,所以其绝热分解主要表现为两次放热反应。由图1b、1c和表1可知, TANPyO第一放热反应阶段,在252.7 ℃开始分解放热,此时温升速率为0.021 ℃·min-1(图1b),起始分解压力为0.394 MPa(图1c)。放热反应开始后温升速率、温度和压力持续升高,温升速率在259.2 ℃时达到最大值0.038 ℃·min-1(图1b),对应压力为0.552 MPa。接着,温升速率开始下降,直到第一次放热反应结束。但是,在温升速率不断下降的过程中,温度和压力继续升高,第一次放热反应结束时,温度达到该过程的最大值262.8 ℃(图1b),压力为0.629 MPa(图1c),此时温升速率为0.021 ℃·min-1。然后,ARC又经过若干次加热-等待-搜寻的运行周期后,直到290.6 ℃时,探测到TANPyO开始第二次放热反应,此时温升速率为0.023 ℃·min-1(图1b),压力为0.882 MPa(图1c),温升速率在307.2 ℃时达到最大值0.083 ℃·min-1,对应压力为1.583 MPa。随后,温升速率后开始下降,直到反应结束,在温升速率不断降低的过程中,温度和压力仍继续升高。
在第一分解过程中,温升速率在252.7~259.2 ℃内持续升高,其波动范围为0.021~0.038 ℃·min-1,达到最大值后开始减小,当温度为262.8 ℃时,第一过程结束。随后进入ARC自动运行周期直到第二分解过程开始,290.6 ℃后由于TANPyO分解产生的气态产物发生化学反应,导致温升速率出现一段不规则的波动。温升速率在295.3~301.6 ℃内持续升高,由0.020 ℃·min-1增加到0.041 ℃·min-1; 然后在301.6~307.2 ℃内进入陡升阶段,由0.041升至0.083 ℃·min-1,以上过程中温度和压力保持持续升高。最后温升速率进入迅速下降阶段,至0.047 ℃·min-1。比较两个分解放热过程,第一过程中,在6.5 ℃的温度范围内,温升速率增幅为0.017 ℃·min-1(图1b),而第二过程中,在5.6 ℃的范围内,温升速率增幅为0.042 ℃·min-1(图1b)。说明第二过程分解反应进行得比较剧烈,热效应和压力效应明显,温升速率、压力和温度都表现出更显著的变化,所以此阶段是主要的热分解过程。
为了进一步说明压力、温度随时间的变化以及最大温升速率时间与温度的关系,将相对于初始分解反应发生时的压力增加与最大反应压力减去初始分解反应压力的差值之比,定义为压力转化分数。温度转化分数与压力转化分数的定义相似[9]。压力或温度转化分数与时间的关系(图1d,图1e)比较简明,可以通过样品热分解过程中压力或温度的变化情况反映样品热分解反应进行的程度。系统在绝热条件下从某一温度开始直到出现最大温升速率所对应的时间为TMR,即最大温升速率时间[10],TMR与起始温度的关系反映了在某一设定起始温度分解反应进行的相对快慢(图1f)。图1d,图1e,图1f从压力和温度的变化以及达到最大温升速率所需时间的角度反映了TANPyO的热稳定性。
由表1可知,TANPyO初始分解温度为252.7 ℃,温升速率最高时的分解温度为307.2 ℃,并且随着时间推移,温度逐步升高,说明其具有较高的热分解温度,具有良好的热稳定性。
3.2 测试数据的校正
由于TANPyO分解放出的热量不仅用于自身的加热,而且还要加热样品球,所以测试结果是样品和样品球组成的整个反应系统。当样品分解放出的热量全部用于加热自身时,样品的实际升温和实际温升速率都比测试值要高,所以需要对表1测定的绝热分解特性参数进行校正,其相应的换算关系如下。
ARC测试中样品的自加热温度与测量值之间的关系为[7,11]:
ΔTad=Tf-T0=φΔTad,s
(1)
(2)
在零级或准零级反应条件下(T0附近),样品的初始温升速率为:
m0=φm0,s
(3)
样品从初始分解温度T0开始到达最大温升速率m0所需要的时间
θm0=θm0,s/φ
(4)
式中,T0、Tf和ΔTad分别为样品的初始分解温度、最大分解温度和绝热温升,℃;φ为热惰性因子,它描述了传递给样品球的热量多少;M为样品的质量,g;θm0为样品达到最大温升速率所需时间,min。下标s表示样品和样品球组成的反应系统。
根据以上方法对TANPyO测试结果进行校正,结果见表2。样品分解过程中被样品球吸收的热量通过换算得到补偿,样品换算后的数值比测量值偏大。
表2 TANPyO绝热分解特性参数测试结果校正值
Table 2 Modified values for parameters of TANPyO adiabatic decomposition

φcv/J·g-1·℃-1T0/℃m0/℃·min-1Tf/℃ΔTad/℃θm0/min22.0851.482260.710.910888.8628.136.964
Note:φisthermal inertia factor;cvis specific heat of TANPyO.
3.3 动力学和热力学参数计算
根据测试得到的样品初始分解温度、样品最大分解温度以及不同时刻反应样品的温度和温升速率,由ARC的温升速率方程(式(5))求得不同温度下的速率常数k[7,12]。
(5)
(6)
由Arrhenius公式[7]的对数形式:
(7)
式中,mT为温度T时对应的温升速率,℃·min-1;Ea为表观活化能,kJ·mol-1;R为气体常数,8.314 J·mol-1·K-1;A为指前因子,min-1。根据温升速率的变化情况,确定252.7~259.2 ℃和301.6~307.2 ℃两个明显的拟合温度范围。用Excel和Origin软件处理试验数据,根据测试得到样品初始分解温度T0、样品最大分解温度Tf以及不同时刻下反应样品的温度T和温升速率mT数据,由式(6)可计算出不同温度下的k值,得出lnk-1000/T曲线(图2)。对曲线进行线性回归,由不同级数下拟合系数的大小确定反应级数n,拟合系数越大,lnk-1000/T的线性关系越好。当反应级数n选取合适时,lnk-1000/T为直线,由直线的斜率和截距可求活化能Ea和指前因子A,结果见表3和表4。
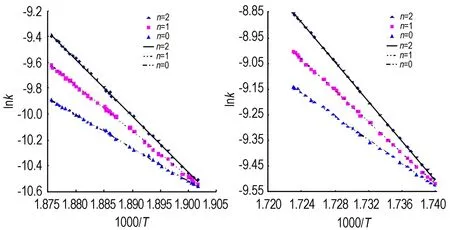
a. 252.7-259.2 ℃ b. 301.6-307.2 ℃
图2 TANPyO的lnk-1000/T曲线
Fig.2 The lnk-1000/Tcurves of TANPyO
表3 TANPyO的动力学参数(252.7~259.2 ℃)
Table 3 Kinetic parameters of TANPyO adiabatic decomposition(252.7-259.2 ℃)

nInA-Ea/Rr2A/min-1Ea/kJ·mol-1036.781-24606.020.98639.414×1015204.57139.576-25792.360.98751.844×1017214.43241.978-26978.720.98861.701×1018224.30
Note:nis reaction order;Ais pre-exponential factor;Eais apparent activation energy;Ris gas constant;ris correlation coefficient.
表4 TANPyO的动力学参数(301.6~307.2 ℃)
Table 4 Kinetic parameters of TANPyO adiabatic decomposition(301.6-307.2 ℃)
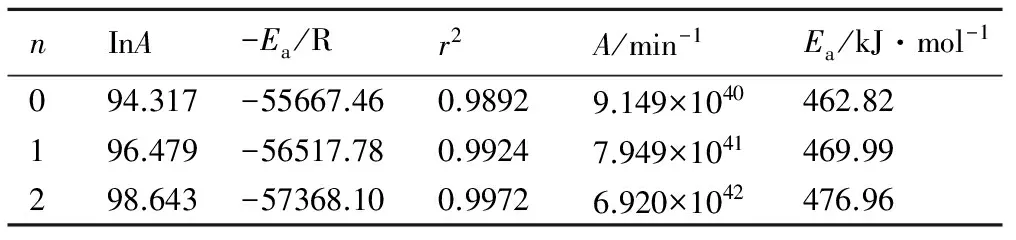
nInA-Ea/Rr2A/min-1Ea/kJ·mol-1094.317-55667.460.98929.149×1040462.82196.479-56517.780.99247.949×1041469.99298.643-57368.100.99726.920×1042476.96
根据文献[13],可由式(8)计算出ARC样品球内TANPyO分解产生的总热量ΔH,即反应热。
ΔH=CVΦΔTad,s
(8)
根据表3计算数据可知,252.7~259.2 ℃时,用不同反应级数拟合曲线得到的相关性不同,反应级数越高,相关性越好。反应级数为2时,lnk-1/T的相关性最好,活化能和指前因子分别为224.30 kJ·mol-1和1.701×1018min-1。由表4计算数据可知,301.6~307.2 ℃时,拟合曲线也符合表3的规律。活化能和指前因子分别为476.96 kJ·mol-1和6.920×1042min-1。由式(8)计算的反应热为930.84 J·g-1。TANPyO的两个放热过程中,第二过程为主要过程,以此条件下的计算结果作为TANPyO绝热分解的表观活化能、指前因子和反应热。由此可知, TANPyO具有较高的表观活化能,其热分解稳定性较好。
3.4 TANPyO与2,6-二氨基-3,5-二硝基吡啶-1-氧化物(ANPyO)[6]绝热分解的比较
TANPyO与ANPyO同属于多氨基多硝基吡啶氮氧化物,绝热分解具有相似性,但分子结构前者比后者多一个氨基,也存在差异。二者都具有较高的初始分解温度,均超过250 ℃,具有较好的热安定性和稳定性。但前者初始分解温度比后者低38.1 ℃,热安定性弱于后者。二者绝热分解过程均发生多次放热反应,整个绝热分解过程中温度和压力持续升高。TANPyO第二次放热反应为主要放热过程,该过程中在温升速率陡升的5.6 ℃范围内,其增幅为0.042 ℃·min-1,而ANPyO第一次放热反应为主要放热过程,该过程中在11.7 ℃的范围内,温升速率的增幅为0.061 ℃·min-1,二者比较TANPyO温升速率的增幅更显著。二者的动力学及热力学参数计算表明,其活化能均较大,热稳定性较好,TANPyO活化能高于ANPyO,但是其分解反应热略低于ANPyO。
4 结 论
(1) TANPyO在252.7 ℃开始绝热分解,其绝热分解主要有两个放热过程。其中第二过程温升速率升降幅度大、反应快,为主要的分解过程。温升速率的最大值为0.083 ℃·min-1,此时温度为307.2 ℃,压力为1.583 MPa,整个分解过程中温度和压力持续稳定升高。TANPyO初始分解温度较高,具有良好的热稳定性。
(2) 获得TANPyO在整个绝热分解过程中温度、压力和温升速率随时间的变化规律,据此计算了不同温度范围、不同反应级数条件下的动力学参数。在301.6~307.2 ℃范围和反应级数为2的条件下,TANPyO的绝热分解反应的活化能、指前因子和反应热分别为476.96 kJ·mol-1、6.920×1042min-1和930.84 J·g-1。为全面评价TANPyO的热稳定性提供了可靠的测试依据。
(3) 比较TANPyO与ANPyO绝热分解,前者初始分解温度低38.1 ℃,热安定性弱于后者; 前者活化能高于后者,而反应热相反; 主要放热反应过程中,TANPyO温升速率的增幅高于后者。
参考文献:
[1] 李金山,黄奕刚,董海山. 多硝基吡啶及其氮氧化物性能的理论预测[J]. 含能材料,2004,12(增刊): 576-579.
LI Jin-shan, HUANG Yi-gang, DONG Hai-shan. Theoretical prediction of properties of polynitropyridines and theirN-oxides[J].ChineseJournalofEnergeticMaterials(HannengCailiao), 2004, 12(Supl):576-579.
[2] Ritter H,Licht H. Review of energetic materials synthesis[J].JHeterocyclChem, 1995,32:585-590.
[3] Pagoria P F, Lee G S, Mitchell A R, et al. A review of energetic materials synthesis[J].ThermochimActa, 2002, 384(1): 187-204.
[4] 何志伟,刘祖亮. 2,4,6-三氨基-3,5-二硝基-1-氧化物及其造型粉的热分解动力学[J]. 火炸药学报,2012,35(5):17-21.
HE Zhi-wei, LIU Zu-liang. Thermal decomposition kinetics of 2,4,6-triamino-3,5-dinitropyridine-1-oxide and its moulding powders[J].ChineseJournalofExplosives&Propellants, 2012,35(5):17-21.
[5] WU Qiong, ZHU Wei-hua, XIAO He-ming. Pressure effects on structural, electronic, absorption, and thermodynamic properties of crystalline 2,4,6-triamino-3,5-dinitropyridine-1-oxide:ADFT study[J].JournalofPhysicalOrganicChemistry, 2013,26(7): 589-595.
[6] 何志伟, 颜事龙, 刘祖亮. 加速量热仪研究2,6-二氨基-3,5-二硝基吡啶-1-氧化物的绝热分解[J]. 含能材料, 2014, 22(1): 31-35.
HE Zhi-wei, YAN Shi-long, LIU Zu-liang. Adiabatic decomposition study on 2,6-diamino-3,5-dinitropyridine-1-oxide by accelerating rate calorimeter[J].ChineseJournalofEnergeticMaterials(HannengCailiao), 2014, 22(1):31-35.
[7] Townsend D I, Tou J C. Thermal hazard evaluation by accelerating rate calorimeter[J].ThermochimActa, 1980,37:1-30.
[8] 赵国良,靳国新. 有机物热力学数据的估算[M]. 北京: 高等教育出版社,1983.
[9] 钱新明,王耘,冯长根. 用加速量热仪研究KClO3/CuO/S/Mg-Al/C6Cl6的热分解[J]. 物理化学学报,2001,17(1):70-73.
QIAN Xin-ming, WANG Yun, FENG Chang-gen. Investigation of thermal decomposition of KClO3/CuO/S/Mg-Al/C6Cl6system by accelerating rate calorimeter[J].ActaPhysico-ChimicaSinica, 2001, 17(1): 70-73.
[10] Degroot P B, Niemitz K J. A spreadsheet kinetic model and its use to compare ARC and dewar storage test data for two exothermic decomposition[J].ThermochimActa, 1993,225:177-188.
[11] 高大元, 徐容, 董海山, 等. TATB及其杂质的绝热分解研究[J]. 爆炸与冲击,2004, 24(1): 69-74.
GAO Da-yuan, XU Rong, DONG Hai-shan, et al. Study on thermal decomposition of TATB and its impurity by accelerating rate calorimeter[J].ExplosionandShockWaves, 2004, 24(1): 69-74.
[12] 周新利,刘祖亮,吕春绪. 3#煤矿许用膨化硝铵炸药的绝热分解[J]. 火炸药学报,2007, 30(5): 15-18.
ZHOU Xin-li, LIU Zu-liang, LU Chun-xu. Adiabatic decomposition of No. 3 permisible expanded ammonium nitrate explosive[J].ChineseJournalofExplosives&Propellants, 2007, 30(5): 15-18.
[13] Pauline P L, Margaret H B. Kinetic studies on the thermal decomposition of tetryl using accelerating rate calorimetry(partⅠ): derivation of the activation energy for decomposition[J].ThermochimiActa, 1986, 107: 1-16.

