盐酸羟胺和N-甲基羟胺盐酸盐的自催化分解特性
闫姣姣, 陈利平, 陈网桦, 呂家育, 李 焓, 陈莹莹
(南京理工大学化工学院, 江苏 南京 210094)
1 引 言
自催化分解反应由于引发因素的多样性和热量释放的突然性及由此带来的高风险性而备受关注。检测和表征物质热分解是否具有自催化分解特性常用的方法是差示扫描量热法(DSC),其中等温DSC测试是目前最可靠且使用最多的方法[1-2]。此外,杨庭等[3]在Roduit等人理论预测的基础上,采用动态和等温DSC分析对过氧化氢异丙酯、2,4-DNT等四种物质的自催化分解特性进行研究时,提出了一种采用动态DSC测试判别物质分解是否具有自催化分解特性的方法——中断回扫法。
尽管DSC能快速鉴别样品是否具有自催化特性,但是DSC分析样品量小,且检测灵敏度较低,其实验结果一般无法直接应用于工程设计,而常用于筛选及基础研究。因此,人们常常在DSC测试之后仍需要采用绝热量热的方法获取更可靠物质/物料的热安全参数[4-6]。
如果通过绝热量热测试在获得样品绝热分解特性的同时,也能够判断出该样品分解是否具有自催化特性,则不需要再进行DSC或其它能够鉴别物质热分解是否具有自催化分解特性的实验,以减少物资和时间耗费。采用绝热量热方法鉴别物质热分解是否具有自催化分解特性的工作较少,如,MacNail等[7]及Bohn和Pontius[8]采用绝热加速量热法(ARC),依据钴酸锂化合物(LixCoO2)、黑索今(RDX)热分解过程中温升速率的变化快慢,判定LixCoO2、RDX的热分解具有自催化分解特性,这一判据比较抽象; Wei等[9]采用压力自动跟踪绝热测试仪(APTAC)测试结果,依据硝酸羟胺(HAN)在heat-soak-search(HSS)和heat-wait-search(HWS)两种模式下起始分解温度等参数的差异性,判定HAN的热分解具有自催化分解特性,HSS模式相当于等温和HWS模式的组合,这种方法测试时间很长。若能找出一种直观快捷的方法,定量判断物质的自催化分解特性会更好。
盐酸羟胺(HH)和N-甲基羟胺盐酸盐(NMHH)是重要的化工原料,在医药合成、显影技术和生物工程等领域均有广泛应用[10-12],但是国内外鲜有对HH和NMHH热危险性的研究报道。基于此,本研究以这两种物质作为研究对象,首先采用被认可的等温DSC法和中断回扫法鉴别二者的热分解是否具有自催化分解特性; 进而采用ARC分析获取二者的起始分解温度、最大温升速率等特征参数。此外,选用HH、NMHH的ARC数据,并结合确认有自催化分解特性的RDX[13]、三硝基甲苯(TNT)[14]、奥克托今(HMX)[15]和过氧化苯甲酰(BPO)[2]的ARC数据,及确认不具有自催化分解特性的硝酸异辛酯(EHN)[3]、过氧化苯甲酸叔丁酯(TBPB)[16]和过氧化二叔丁基(DTBP)[17]的ARC数据进行对比分析,探索绝热条件下自催化分解反应区别于非自催化分解反应的特性,分析可以用于判别物质热分解是否具有自催化分解特性的特征参数。
2 实验部分
2.1 样品
盐酸羟胺(HH),无色晶体,纯度98.5%,熔点152 ℃,密度1.67 g·m-3,上海试四赫维化工有限公司生产;N-甲基羟胺盐酸盐(NMHH),白色晶体,纯度97%,熔点86~88 ℃,东京化成工业株式会社生产。
2.2 测试条件
差示扫描量热分析采用瑞士Mettler Toledo公司的热通量型差示扫描量热仪DSC1,其检测灵敏度为0.04 μW,温度范围为-35~500 ℃,升温速率范围为0.02~300 ℃·min-1。试验选用密闭不锈钢坩埚为样品池,空的不锈钢坩埚为参比,测试气氛为N2(反应气和干燥气的流速分别为100 mL·min-1和200 mL·min-1)。HH和NMHH等温测试的温度分别为98 ℃和75 ℃; 中断回扫法的温升速率均为10 ℃·min-1,起始温度T1均为25 ℃,终止温度T2均为 250 ℃,HH和NMHH的中断温度Ts分别为97 ℃和92 ℃。
绝热量热测试选用英国THT公司生产的加速量热仪es-ARC,其测试温度可达到500 ℃,最大灵敏度为0.005 ℃·min-1。试验选用哈氏合金球为样品球,检测灵敏度设置为0.02 ℃·min-1,温度台阶为5 ℃,等待时间为10 min,HH和NMHH的样品量分别为0.154 g和0.146 g。
3 结果与讨论
3.1 等温DSC分析
HH和NMHH等温DSC曲线见图1。
等温条件下,n级化学反应的反应速率因转化率的增加而单调下降,而自催化分解反应由于反应产物参与催化反应,反应速率会随反应产物的增加而增大,达到最大值后因反应物的消耗开始下降,最终得到一条“钟状”的放热速率曲线,这是等温DSC分析物质自催化分解特性的依据[1]。
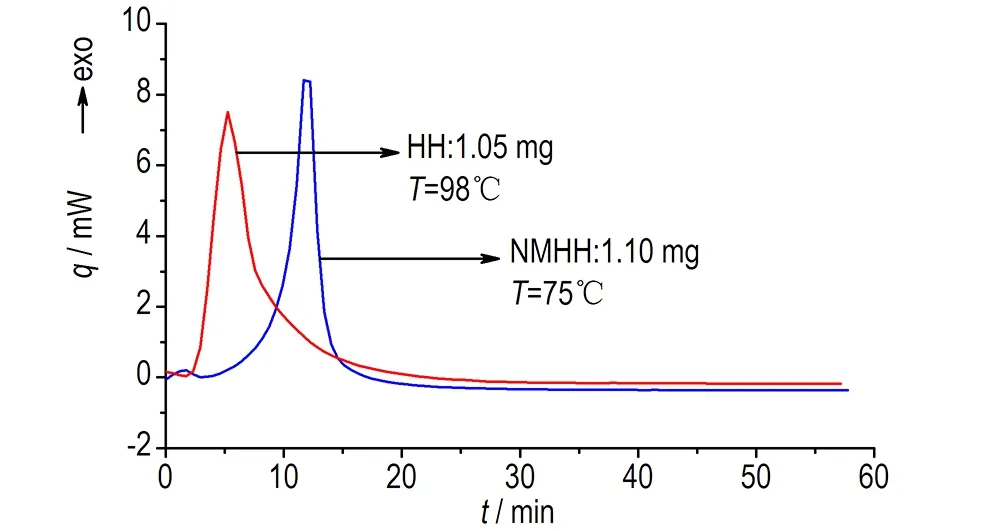
图1 HH和NMHH的等温DSC曲线
Fig.1 Isothermal DSC curves of HH and NMHH
由图1可知,HH和NMHH的热流随时间先增大后减小,基本呈现“钟形”曲线的特性,故HH和NMHH的热分解均具有自催化分解特性。HH和NMHH的峰形曲线都比较尖锐,可见二者热分解都非常剧烈,对峰形曲线积分得HH和NMHH的放热量分别为2041.65 J·g-1和1475.16 J·g-1,均高于800 J·g-1,依据文献[1]对失控反应严重度的评估标准可知,HH和NMHH反应失控的严重度是“灾难性的”,即HH和NMHH一旦反应失控,后果很严重。
3.2 中断回扫法
中断回扫法鉴别HH和NMHH的热分解是否具有自催化分解特性示意图如图2所示。

图2 中断回扫法示意图[3]
Fig.2 Schematic diagram of the interruption and re-scanning method[3]
中断回扫法需要进行两次动态DSC测试。第一次从起始温度T1线性扫描至终止温度T2; 第二次先从T1线性扫描至中断温度Ts(Ts在起始分解温度附近),然后迅速冷却到T1,再次线性扫描至终止温度T2,两次测试得到两条动态DSC曲线。若第二次测试的起始分解温度和峰值温度较第一次测试均明显提前,则说明样品的热分解具有自催化分解特性; 若第二次测试的起始分解温度和峰值温度较第一次测试没有明显变化,则表明样品的热分解不具有自催化分解特性。
中断回扫法得到的HH和NMHH的动态DSC曲线见图3。
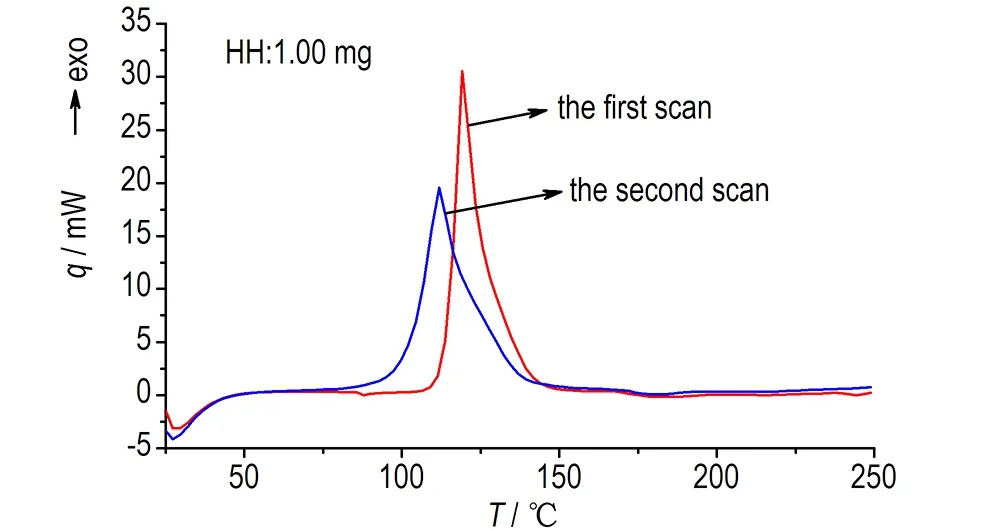
a. HH
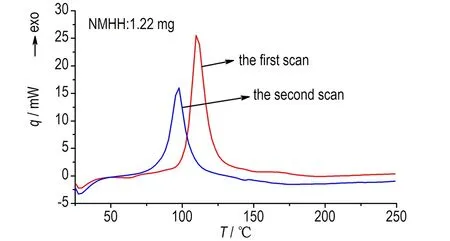
b. NMHH
图3 HH和NMHH的动态DSC曲线
Fig.3 Dynamic DSC curves of HH and NMHH obtained by the interruption and re-scanning method
由图3可知,HH和NMHH第二次动态DSC扫描的初始分解温度、峰值温度均低于第一次,故HH和NMHH的热分解均具有自催化分解特性。同时由图可以发现HH和NMHH的动态DSC峰形曲线较尖锐,鉴于第一次动态DSC是一个测温范围内完整的线性升温过程,而第二次动态DSC扫描,存在从中断温度Ts冷却到起始温度T1的过程,放热量有损失,所以对第一次扫描的曲线积分,得到二者的放热量分别为2284.85 J·g-1和2188.41 J·g-1,与硝酸异辛酯(2040.59 J·g-1[13])相当,可见HH和NMHH的含能均较高。动态DSC测得的放热量均高于等温DSC测试结果,这可能是因为等温DSC测试时HH和NMHH所处环境温度较高,仪器开始检测前已有部分物质分解,从而导致放热量偏低。
3.3 HH和NMHH的ARC实验结果
对ARC数据进行分析,可以获得物质的起始分解温度等参数,从而为工程设计提供依据。HH和NMHH绝热分解过程中的相关曲线见图4。

a. HH

b. NMHH
图4 放热过程中温度-时间、压力-时间曲线
Fig.4 Histories of temperature and pressure in exothermal process
图4显示,HH和NMHH热分解的起始分解温度T0分别为110.6 ℃和90.7 ℃,说明NMHH比HH对热更敏感。HH和NMHH分解反应能够达到的最高温度Tf分别为141.52 ℃和131.48 ℃。由于HH的熔点为152 ℃,故推断HH的热分解反应属于固相分解。NMHH的熔点为86~88 ℃,略低于T0,故在仪器检测到物质分解之前,NMHH已经发生相变。从检测到放热至反应结束,HH和NMHH分别耗时5.5 min和23.1 min,这意味着一旦引发这两种样品的分解,其失控后果几乎无法避免。
3.4 基于ARC结果鉴别是否为自催化分解
为了探讨自催化分解特性物质区别于非自催化分解特性物质的绝热分解特性,将确认有自催化分解特性的HH、NMHH、TNT、HMX、RDX和BPO的ARC数据,与确认不具有自催化分解特性的TBPB、EHN和DTBP的ARC数据进行对比分析,上述样品的实验数据均为实测,其中TNT、RDX、BPO、TBPB、EHN和DTBP的测试结果与文献[18-22]的绝热量热数据在起始分解温度等方面有较好的一致性,HH、NMHH和HMX无ARC数据文献资料。所有样品测试条件见表1,TNT-1和TNT-2以及BPO-1和BPO-2分别表示不同样品量的TNT、BPO。
表1 ARC测试条件
Table 1 ARC test conditions
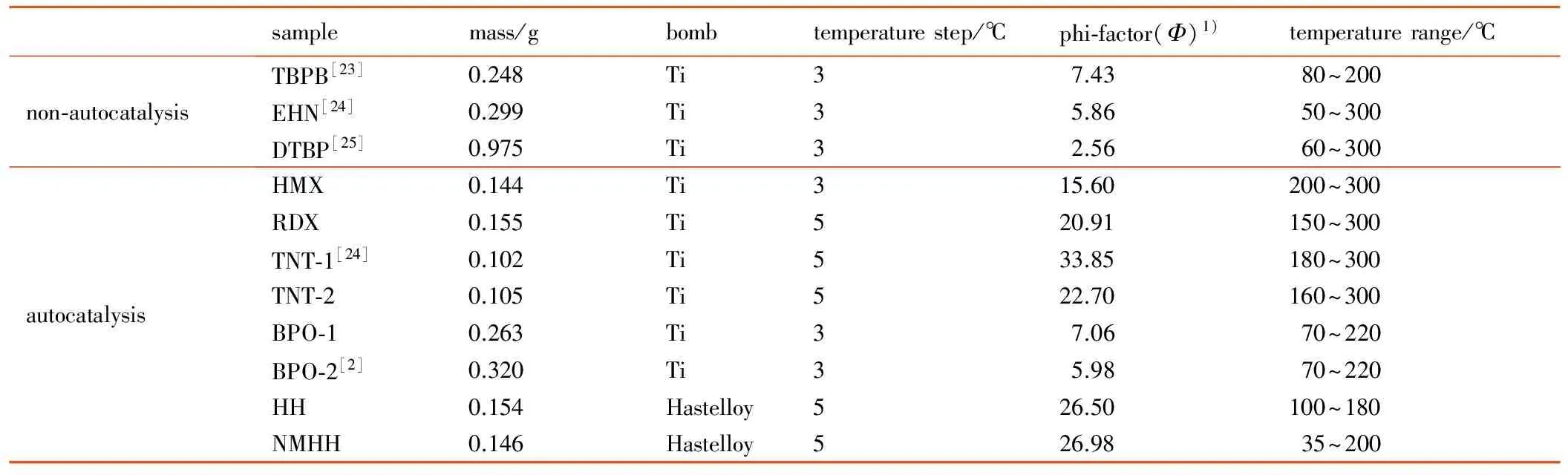
samplemass/gbombtemperaturestep/℃phi⁃factor(Φ)1)temperaturerange/℃non⁃autocatalysisTBPB[23]0.248Ti37.4380~200EHN[24]0.299Ti35.8650~300DTBP[25]0.975Ti32.5660~300autocatalysisHMX0.144Ti315.60200~300RDX0.155Ti520.91150~300TNT⁃1[24]0.102Ti533.85180~300TNT⁃20.105Ti522.70160~300BPO⁃10.263Ti37.0670~220BPO⁃2[2]0.320Ti35.9870~220HH0.154Hastelloy526.50100~180NMHH0.146Hastelloy526.9835~200
Note: 1) The specific heat capacity of organic peroxides used forΦwere 2.0 kJ·kg-1·K-1, others were obtain by Kopp rule[26].
所有样品的绝热温升速率随时间变化曲线见图5。为更清晰地显示各条曲线,图5只给出各样品从检测到放热至最大温升速率阶段的曲线。
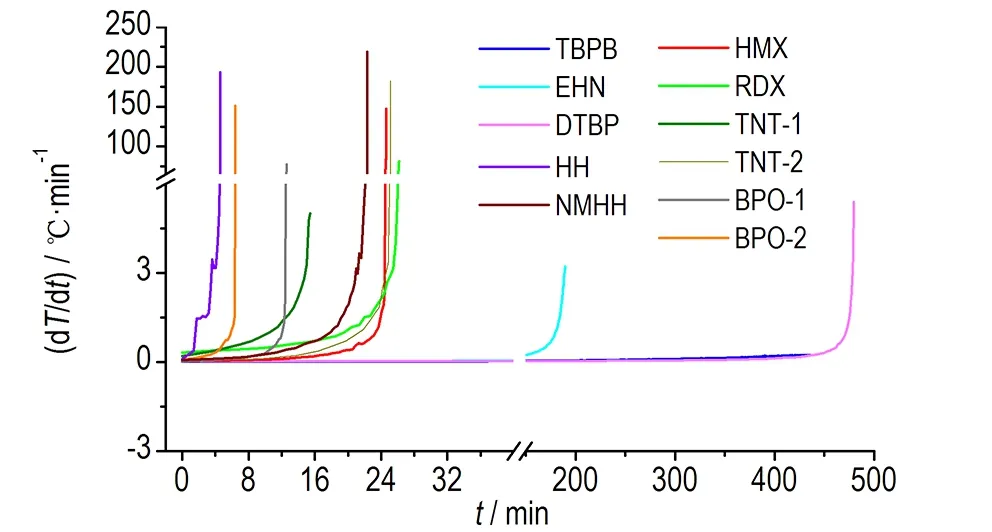
图5 样品的ARC温升速率-时间曲线
Fig.5 Curves of temperature rise rate vs time tested by ARC
由图5可知,自催化分解反应的温升速率曲线都比较陡,最大温升速率((dT/dt)max)偏大,而且从检测到放热至最大温升速率的时间(t0-max)较短; 而非自催化分解反应的温升速率变化则比较平缓,且t0-max远大于自催化分解反应对应的时间。这可能是因为自催化分解反应有较长的诱导期(绝热条件下物质热分解从放热开始到最大温升速率的时间,研究表明对于自催化分解特性物质,物质分解的初始转化率为10%就会导致其绝热诱导期缩短一倍),且在诱导期内反应及放热速率均很慢,甚至会低于ARC的检测灵敏度(0.02 ℃·min-1)。当ARC检测到物质放热时,可能已有部分物质分解。自催化分解反应在经历诱导期后,反应及放热速率会迅速增加,并很快达到最大速率[1]。因此,自催化分解反应与非自催化分解反应在温升速率和从检测到放热至最大温升速率的时间方面存在差异性。
鉴于上述分析,从绝热测试结果中选择表征速率及时间的最大温升速率((dT/dt)max)以及从检测到放热至最大温升速率的时间(t0-max)参数进行分析比较。由于样品分解释放的热量除了用于加热自身外,还会损失一部分用来加热样品球,所以,需要对温升速率进行修正,热修正系数Φ的定义为[27]:
Φ=1+MbCvb/MsCvs
(1)
式中,Ms为试样质量,g;Cvs为试样平均比热容,J·g-1·K-1;Mb为试样容器的质量,g;Cvb为试样容器的平均比热容,J·g-1·K-1。
由式(1)可以看出,试样质量Ms越大,热修正系数Φ越小,当Ms≫Mb时,Φ≈1,接近理想状态(Φ=1),没有必要修正,反之必须修正。
最大温升速率的修正公式为[28]:
(dT/dt)max,s=Φ×(dT/dt)max
(2)
式中,(dT/dt)max,s为修正后最大温升速率,℃·min-1; (dT/dt)max为测试得到的最大温升速率,℃·min-1。
各样品绝热分解的t0-max、(dT/dt)max和(dT/dt)max,s对比图分别见图6、图7和图8。图中前三个样品(TBPB,EHN,DTBP)为非自催化分解特性物质,其余为自催化分解特性物质。
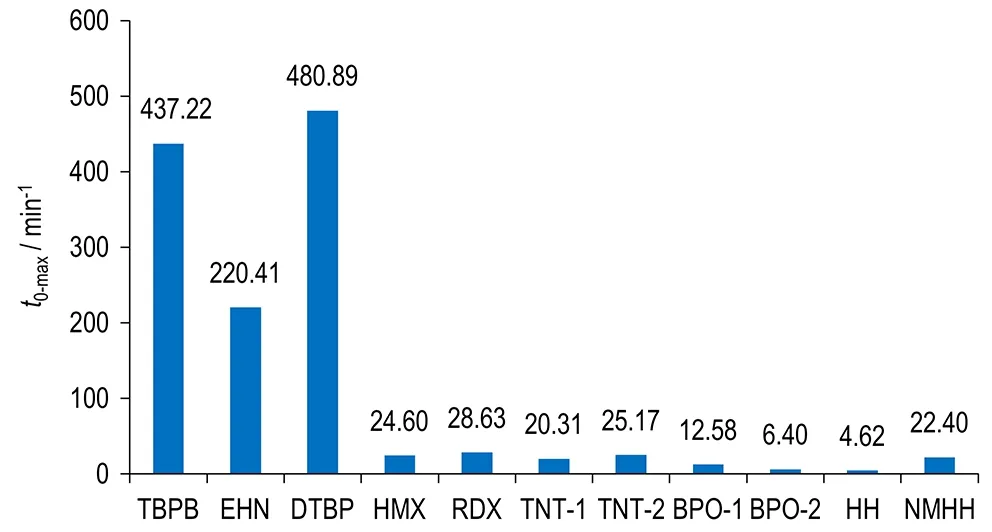
图6 ARC测试所得的各样品的t0-max值
Fig.6t0-maxvalues of samples tested by ARC
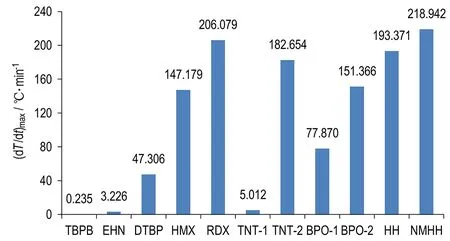
图7 ARC测试所得的最大温升速率
Fig.7 The maximum temperature rise rate tested by ARC
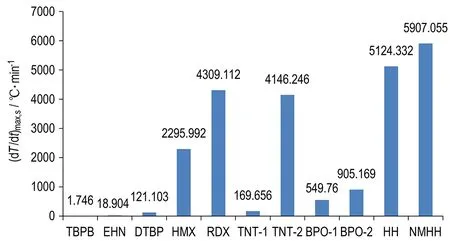
图8 ARC测试所得的修正后的最大温升速率
Fig.8 The corrected maximum temperature rise rate tested by ARC
由图6可知,选取物质中非自催化分解特性物质的t0-max均大于220 min,而自催化分解特性物质的t0-max最大值为28.63 min,且经DSC分析验证具有自催化分解特性的HH和NMHH的t0-max均小于28.63 min,即所有样品中自催化分解反应的t0-max均远小于非自催化分解反应的t0-max。自催化分解特性物质中,TNT-1和TNT-2的t0-max分别为20.31 min和25.17 min,BPO-1和BPO-2的t0-max分别为12.58 min和6.40 min。两组数据表明,样品量变化时t0-max值相差不大。TNT和BPO均为典型自催化分解特性物质,温度对其绝热测试得到的最大温升速率到达时间影响很大[1],同时浓度又是反应速率的重要影响因素。ARC测试表明,样品量不同时,体系检测得到的起始分解温度也略有不同。一般而言,样品量较小时起始分解温度稍高,高的起始分解温度可能会促使体系快速达到最大温升速率; 样品量较大时起始分解温度略低,但反应体系浓度较大,可能会促使体系从引发反应阶段较快进入自催化反应阶段,进而快速地达到最大温升速率。所以,样品量不同时,由于浓度的共同作用,ARC测得物质自催化分解的t0-max值差别不大。所以,可以采用t0-max判断样品是否具有自催化分解特性。
由图7可知,所有自催化分解特性物质中(包括HH和NMHH),TNT-1的(dT/dt)max为5.012 ℃·min-1; 非自催化分解特性物质中,DTBP的(dT/dt)max为47.306 ℃·min-1,数值上有交叉。 ARC测得的最大温升速率是样品池和样品共同构成的体系的最大温升速率,样品量较小时,样品分解产生的热量过多地用于加热样品球,反应体系温度偏低,反应速率偏小,体系最大温升速率偏小。对比表1和图7分析,Φ为22.70时,TNT-2的(dT/dt)max为182.654 ℃·min-1;Φ为33.85时,TNT-1的(dT/dt)max仅为5.012 ℃·min-1,可见Φ对温升速率影响很大,因此,需要对Φ值进行修正。理想状态下(Φ=1),自催化分解反应往往存在剧烈的温度变化,最大温升速率很大。实验中为避免剧烈的温度变化对仪器造成损坏,所用样品量均较小,Φ值较大,这会导致ARC测得的最大温升速率存在较大偏差,因此,最大温升速率不适宜做为判别物质热分解是否具有自催化分解特性的依据。
由图8可知,修正后HH和NMHH的(dT/dt)max,s分别为5124.332 ℃·min-1和5907.055 ℃·min-1,甚至高于TNT和RDX的(dT/dt)max,s,可见HH和NMHH的绝热分解非常剧烈。所有样品(包括HH和NMHH)自催化分解特性物质中低的(dT/dt)max,s为169.656 ℃·min-1,非自催化分解特性物质中高的(dT/dt)max,s为121.103 ℃·min-1,均处于100~200 ℃·min-1,界限不分明,可见(dT/dt)max,s也不宜用来判别物质的自催化分解特性。
4 结 论
(1) 等温和动态DSC测试结果表明,HH和NMHH的热分解均具有自催化分解特性。动态DSC测试获得HH和NMHH热分解的放热量较大,分别为2284.85 J·g-1、2188.41 J·g-1; ARC测试获得HH和NMHH的起始分解温度分别为110.6 ℃和90.7 ℃,最大温升速率分别为193.4 ℃·min-1和218.9 ℃·min-1,反应较剧烈。HH和NMHH较低的起始分解温度、高放热量和高温升速率,表明HH和NMHH热分解的危险性很大。建议在其生产、储存、使用诸环节中,充分考虑其热解过程自催化的特性,制定工艺条件及应急处置的措施,从而切实降低其热风险。
(2) 通过分析多种自催化分解特性和非自催化分解特性热分解物质的ARC数据,发现自催化分解反应的t0-max远小于非自催化分解反应,且经DSC测试验证具有自催化分解特性的HH和NMHH的ARC测试结果也符合该规律,同时Φ值变化对该规律不产生影响。综合考虑ARC测得的(dT/dt)max、(dT/dt)max,s和t0-max这些热分析常用特征参数,认为可以将t0-max值做为判别物质热分解是否具有自催化特性的依据。
参考文献:
[1] Francis Stoessel. 化工工艺的热安全-风险评估与工艺设计[M]. 陈网桦, 彭金华, 陈利平, 译. 北京: 科学出版社, 2009: 73.
Stoessel, F. Thermal Safety of Chemical Process: Risk Assessment and Process Design[M]. Chen Wang-hua, Peng Jin-hua, Chen Li-ping, Beijing: Science Press, 2009: 73.
[3] 杨庭, 陈利平, 陈网桦, 等. 分解反应自催化分解特性质快速鉴别的实验方法[J]. 物理化学学报, 2014, 30(7): 1215-1222.
YANG Ting, CHEN Li-ping, CHEN Wang-hua, et al. Experimental research on rapid identification for autocatalysis of decomposition reaction[J].ActaPhysico-ChimicaSinica, 2014, 30(7): 1215-1222.
[4] Kimura A, Otsuka T. Performance evaluation of differential accelerating rate calorimeter for the thermal runaway reaction of di-tert-butyl peroxide[J].JournalofThermalAnalysisandCalorimetry, 2013, 113(3): 1585-1591.
[5] Vethathiri Pakkirisamy S, Mahadevan S, Suthangathan Paramashivan S, et al. Water induced thermal decomposition of pyrotechnic mixtures-Thermo kinetics and explosion pathway[J].JournalofLossPreventionintheProcessIndustries, 2014. doi: 10.1016/j.jlp.2014.03.005.
[6] 田映韬, 吕家育, 陈网桦, 等. 过氧化甲乙酮的热危险性研究[J]. 中国安全科学学报, 2012, 22(6): 124-129.
TIAN Ying-tao, Lü Jia-yu, CHEN Wang-hua, et al. Study on thermal hazard methyl ethyl ketone peroxide[J].ChinaSafetyScienceJournal, 2012, 22(6): 124-129.
[7] MacNeil D D, Christensen L, Landucci J, et al. An Autocatalytic Mechanism for the Reaction of Li x CoO2 in Electrolyte at Elevated Temperature[J].JournaloftheElectrochemicalSociety, 2000, 147(3): 970-979.
2018—2020年是国家新“棚户区改造三年计划”实施阶段,全国计划改造各类棚户区1500万套,广西通过深入各市县摸底调查,挖掘棚户区改造潜力,将棚户区改造开工量原计划24万套扩大至37.57万套,旨在抓住棚户区改造政策和金融信贷政策机遇,在改善民生的同时进一步推动经济增长和城镇发展。
[8] Bohn M A, Pontius H. Thermal Behaviour of Energetic Materials in Adiabatic Selfheating Determined by ARCTM[C]∥Proceedings of the 43rdInternational Annual Conference of ICT on ‘Energetic Materials-Synthesis, Characterisation, Processing’, Germany, 2012, 57: 1-40.
[9] Wei C, Rogers W J, Mannan M S. Thermal decomposition hazard evaluation of hydroxylamine nitrate[J].JournalofHazardousMaterials, 2006, 130(1): 163-168.
[10] 高丽雅, 檀学军, 张东升, 等. 羟胺(盐)的合成及其应用研究进展[J]. 化工进展, 2012, 31(9): 2043-2048.
GAO Li-ya, TAN Xue-jun, ZHANG Dong-sheng, et al. Progress of synthesis and application of hydroxylamine (salts)[J].ChemicalIndustryandEngineeringProgress, 2012, 31(9): 2043-2048.
[11] 郭晓河, 张宏伟, 陶乐, 等. 替泊沙林的新合成方法及其镇痛活性的研究[J]. 药学学报, 2010, 45(10): 1260-1264.
GUO Xiao-he, ZHANG Hong-wei, TAO Le, et al. Novel synthetic method and analgesic activity of tepoxalin[J].ActaPhaarmaceuticaSincia, 2010, 45(10): 1260-1264.
[12] 关志炜, 李志香, 孙洪涛. 盐酸羟胺和紫外线复合诱变选育纳豆激酶高产菌株[J]. 食品与发酵工业, 2009, 35(6): 71-74.
GUAN Zhi-wei, LI Zhi-xiang, SUN Hong-tao. Research on the breeding of bacillus subtilis natto highly producing nattokinase by the compound mutation of hydroxylamine[J].FoodandFermentationIndustries, 2009, 35(6): 71-74.
[13] 郭明朝, 楚士晋, 冯长根,等. 高能炸药药柱实验热爆炸的方法和结果[J]. 爆炸与冲击, 1995, 15(2): 107-115.
GUO Ming-chao, CHU Shi-jin, FENG Chang-gen, et al. Investigation on thermal explosion of some high explosives[J].ExplosionandShockWaves, 1995, 15(2): 107-115.
[14] Long G T, Brems B A, Wight C A. Autocatalytic thermal decomposition kinetics of TNT[J].ThermochimicaActa, 2002, 388(1): 175-181.
[15] 贾会平, 白木兰. HMX 的热分解及其自催化作用[J]. 兵工学报, 1993 (4): 53-57.
JIA Hui-ping, BAI Mu-lan. Thermal decomposition of HMX and its autocalysis[J].ActaArmamentarii, 1993 (4): 53-57
[16] Lv J, Chen W, Chen L, et al. Thermal risk evaluation on decomposition processes for four organic peroxides[J].ThermochimicaActa, 2014, 589: 11-18.
[17] Li X R, Koseki H. Thermal decomposition kinetic of liquid organic peroxides[J].JournalofLossPreventionintheProcessIndustries, 2005, 18(4): 460-464.
[18] Kwok Q S M, Fouchard R C, Turcotte A M, et al. Characterization of aluminum nanopowder compositions[J].Propellants,Explosives,Pyrotechnics, 2002, 27(4): 229-240.
[19] Sun D X, Miao X, Xie C X, et al. Study on thermal properties and kinetics of benzoyl peroxide by ARC and C80 methods[J].JournalofThermalAnalysisandCalorimetry, 2012, 107(3): 943-948.
[20] 蒋慧灵, 闫松, 魏彤彤. 水分对过氧化苯甲酸叔丁酯热稳定性的影响[J]. 化工学报, 2011, 62(5): 1290-1295.
JIANG Hui-ling, YAN Song, WEI Tong-tong. Effect of water on thermal stability of tert-butyl peroxy benzoate[J].CiescJournal, 2011, 62(5): 1290-1295.
[21] Chen L P, Liu T T, Yang Q, et al. Thermal hazard evaluation for iso-octanol nitration with mixed acid[J].JournalofLossPreventionintheProcessIndustries, 2012, 25(3): 631-635.
[22] Lizuka Y, Surianarayanan M. Comprehensive kinetic model for adiabatic decomposition of di-tert-butyl peroxide using BatchCAD[J].Industrial&EngineeringChemistryResearch, 2003, 42(13): 2987-2995.
[23] Lv J Y, Wei S, Chen W H, et al. Thermal kinetic analysis of tert-butyl peroxy benzoate under dynamic and adiabatic conditions[J].AdvancedMaterialsResearch, 2012, 550: 2782-2785.
[24] 刘颖, 杨茜, 陈利平, 等. 绝热加速量热仪表征含能材料热感度的探讨[J]. 含能材料, 2012, 19(6): 656-660.
LIU Ying, YANG Qian, CHEN Li-ping, et al. Thermal sensitivity of energetic materials characterized by accelerating rate calorimeter(ARC)[J].ChineseJournalofEnergeticMaterials(HannengCailiao), 2009, 35(6): 71-74.
[25] Jiayu L, Wanghua C, Liping C, et al. Thermal decomposition analysis and safety study on di-tert-butyl peroxide[J].ProcediaEngineering, 2012, 43: 312-317.
[26] Cooper P W. Explosives engineering[M]. VCH: New York, 1996.
[27] 刘荣海, 陈网桦, 胡毅亭. 安全原理与危险化学品测评技术[M]. 北京: 科学出版社, 2004.
LIU Rong-hai, CHEN Wang-hua, HU Yi-ting. Safety principle and assessing technology on hazardous chemical[M]. Beijing: Chemical Industry Press, 2004.
[28] 万伟. 油溶性偶氮类引发剂热危险性研究[D]. 南京: 南京理工大学硕士论文, 2013.
WAN Wei. The thermal hazards of azo compounds[D]. Nanjing: Nanjing University of Science and Technology, 2013.

