持续偏热处理对肉仔鸡免疫器官指数、小肠形态结构和黏膜免疫指标的影响
张少帅 甄 龙,* 冯京海 胡春红 彭骞骞 常 玉 周 莹 张敏红**
(1.中国农业科学院北京畜牧兽医研究所,动物营养学国家重点实验室,北京100193;2.河北工程大学农学院,邯郸056021)
持续偏热处理对肉仔鸡免疫器官指数、小肠形态结构和黏膜免疫指标的影响
张少帅1甄 龙1,2*冯京海1胡春红1彭骞骞2常 玉1周 莹1张敏红1**
(1.中国农业科学院北京畜牧兽医研究所,动物营养学国家重点实验室,北京100193;2.河北工程大学农学院,邯郸056021)
本试验研究了不同持续偏热(26和31 ℃)处理对肉仔鸡免疫器官指数、小肠形态结构和黏膜免疫指标的影响。试验选取22日龄爱拔益加(AA)肉仔鸡144只转入人工气候实验舱,随机分成3个处理,每个处理6个重复,每个重复8只(公母各占1/2)。适应期7 d,温度21 ℃,相对湿度60%。29日龄时,试验温度分别调整到21、26和31 ℃,相对湿度60%,至试验结束,试验期共14 d。结果表明:与21 ℃处理相比,1)26和31 ℃处理对肉仔鸡胸腺指数无显著影响(P>0.05);第7天,31 ℃处理显著降低脾脏指数(P<0.05);第7、14天,31 ℃处理显著降低法氏囊指数(P<0.05)。2)26和31℃处理显著降低第14天空肠和回肠绒毛高度(P<0.05);31 ℃处理显著升高第14天空肠隐窝深度(P<0.05);26和31 ℃处理显著升高第14天回肠隐窝深度(P<0.05)。3)31 ℃处理显著降低第1天十二指肠分泌型免疫球蛋白A(SIgA)含量,26和31 ℃处理显著降低第7天十二指肠SIgA含量;31 ℃处理显著降低第1天空肠SIgA含量。因此,与21 ℃处理相比,持续偏热(26和31 ℃)处理不同程度影响肉仔鸡免疫器官的发育,损伤小肠形态结构,降低小肠黏膜免疫功能。
偏热处理;肉仔鸡;免疫器官指数;小肠形态结构;黏膜免疫
高温是家禽生产过程中普遍面临的问题,不但会降低生产性能[1-2],同时也会影响机体的免疫系统,威胁家禽个体的健康。据统计,大多数研究集中在32 ℃及以上高温条件下,导致免疫功能受到不同程度的损伤[3-6]。仅有少数研究报道了31 ℃会对家禽免疫功能造成消极的影响。Quinteiro-Pilho等[7]对肉仔鸡(35~42日龄)施加间歇性(08:00—18:00)31 ℃高温刺激,研究发现,法氏囊指数显著下降。同时Quinteiro-Pilho等[8]又发现上述高温刺激诱发了小肠的炎性反应。然而26和31 ℃持续偏热处理对肉仔鸡免疫功能的影响尚未见报道。
相对来说,偏热(26~31 ℃)环境的研究没有引起业内的重视,其在家禽生产中引发的潜在问题往往被忽视。实际上,偏热(26~31 ℃)环境普遍存在。目前,“纵向通风+湿帘降温”技术的成熟应用可以将规模化肉鸡舍内的温度下降8~10 ℃[9],即便在夏季舍内的温度也能控制在31 ℃以下。因此,偏热环境是家禽生产中面临的常见环境挑战之一。
本课题组经过一系列的试验,初步探索了偏热处理对家禽生产性能、糖脂代谢及基因表达、行为和生理的影响。甄龙等[10]研究发现,相对于21 ℃,持续偏热处理(26和31 ℃)影响肉鸡糖脂代谢及禽类解偶联蛋白(avUCP) mRNA表达,降低肉鸡生长性能,且不同偏热程度对肉鸡影响程度不同。同时,胡春红等[11]研究发现,对于热中性温度来说,26和30 ℃处理引起肉鸡坐着休息时间百分比显著下降和俯伏休息时间百分比显著升高,下丘脑热应激蛋白70(HSP70)浓度显著升高以及生产性能下降;30 ℃处理显著升高肉鸡体核温度。
因此,本试验以肉仔鸡为研究对象,研究不同持续偏热(26和31 ℃)处理肉仔鸡免疫器官指数、小肠绒毛高度(villus height,VH)、隐窝深度(crypt depth,CD)和分泌型免疫球蛋白A(secretory immunoglobulin A,SIgA)含量的变化,探讨持续偏热处理对免疫器官发育、小肠形态结构和黏膜免疫功能的影响,为探索肉仔鸡的热适应性和提高抗热能力提供理论依据。
1 材料与方法
1.1 试验动物与试验设计
选取同一批出雏、饲养管理一致、体质健壮的22日龄健康爱拔益加(AA)肉仔鸡144只,体重(1 376±55) g,随机分成3个处理,每个处理6个重复,每个重复8只鸡(公母各占1/2)。3个处理的试验鸡分别转入3个环境控制舱,适应期7 d,21 ℃,相对湿度60%。29日龄时,试验温度分别调整到21、26和31 ℃,相对湿度60%,至试验结束,共14 d。
1.2 饲养管理
试验在中国农业科学院北京畜牧兽医研究所动物营养学国家重点实验室昌平试验基地人工气候实验舱内进行,温度(±1 ℃)、相对湿度(±7%)自动控制,无风、24 h光照。试验肉仔鸡采用平养,所用笼具为本实验室研发的单层平养笼具[12],每8只试验鸡饲养面积0.64 m2。试验动物所用饲粮参照NRC(1994)配制(表1)。试验期间,肉仔鸡自由采食与饮水。
1.3 测定指标与方法
1.3.1 免疫器官指数
分别于试验第1、7和14天末,每处理随机选取6只(公母各3只;每重复选1只)肉仔鸡进行称重,颈部放血处死后,取出脾脏、胸腺和法氏囊,用滤纸吸去血液,用手术剪剪去表面脂肪和系膜,用电子天平称其重量。免疫器官指数计算公式如下:
免疫器官指数(g/kg)=免疫器官重(g)/
体重(kg)。

表1 基础饲粮组成及营养水平(饲喂基础)
1)预混料为每千克饲粮提供Premix provided the following per kg of the diet: VA 10 000 IU,VD33 400 IU,VE 16 IU,VK32.0 mg,VB12.0mg,VB26.4 mg,VB62.0 mg,VB120.012 mg,泛酸钙 pantothenic acid calcium 10 mg,烟酸 nicotinic acid 26 mg,叶酸 folic acid 1 mg,生物素 biotin 0.1 mg,胆碱 choline 500 mg,Zn (ZnSO4·7H2O) 40 mg,Fe (FeSO4·7H2O) 80 mg,Cu (CuSO4·5H2O) 8 mg,Mn (MnSO4·H2O) 80 mg,I (KI) 0.35 mg,Se (Na2SeO3) 0.15 mg。
2)计算值Calculated values。
1.3.2 小肠形态结构
小肠绒毛高度和隐窝深度:于试验第14天末,每处理随机选取6只(公母各3只;每重复选1只)肉仔鸡,取十二指肠、空肠和回肠中段各1段,置于4%多聚甲醛溶液中进行固定,用于测定肠道形态结构。常规石蜡包埋组织切片,苏木精-伊红(HE)染色,中性树脂封片。选择绒毛、隐窝形态完整的切片,选定最长的6根绒毛,应用Image-Pro Plus6.0软件对每张照片进行分析,得出每张照片的平均绒毛高度和隐窝深度。
1.3.3 小肠黏膜免疫指标
小肠SIgA含量:分别于试验第1、7和14天末,每处理随机选取6只(公母各3只;每重复选1只)肉仔鸡,采集小肠内食糜进行SIgA含量的检测,具体参照魏凤仙[13]的方法进行检测,试剂盒(Lot No.E30-103-29)购自美国Bethyl公司。
1.4 数据处理
采用SAS 9.2统计软件,对各处理进行单因素方差分析(one-way ANOVA),采用Duncan氏法多重比较检验,试验数据用平均值±标准差表示,P<0.05为差异显著水平。
2 结 果
2.1 持续偏热处理对肉仔鸡免疫器官指数的影响
由表2可知,温度处理对肉仔鸡胸腺指数均无显著影响(P>0.05)。温度处理对试验第1和14天肉仔鸡脾脏指数无显著影响(P>0.05),但随温度的升高均逐渐降低;温度处理对试验第7天脾脏指数有显著影响(P<0.05),且31 ℃处理显著低于21和26 ℃处理(P<0.05),21和26 ℃处理间无显著差异(P>0.05)。除试验第1天外,温度处理对试验第7和14天法氏囊指数均有显著影响(P<0.05),试验第7天时31 ℃处理显著低于21℃处理(P<0.05),第14天时31 ℃处理显著低于21和26 ℃处理(P<0.05),21和26 ℃处理间无显著差异(P>0.05)。
2.2 持续偏热处理对肉仔鸡小肠形态结构的影响
由表3可知,温度处理对十二指肠的绒毛高度和隐窝深度的影响有显著趋势(P<0.10)。温度处理对空肠的绒毛高度和隐窝深度有显著影响(P<0.05);3个处理间空肠绒毛高度均有显著差异(P<0.05),且温度越高绒毛高度越低;31 ℃处理的隐窝深度显著高于21和26 ℃处理,后两者差异不显著(P>0.05)。温度处理对回肠绒毛高度和隐窝深度有显著影响(P<0.05);3个处理间回肠绒毛高度均有显著差异(P<0.05),且温度越高绒毛高度越低;31和26 ℃处理的回肠隐窝深度显著高于21 ℃处理(P<0.05),31和26 ℃处理间无显著差异(P>0.05)。
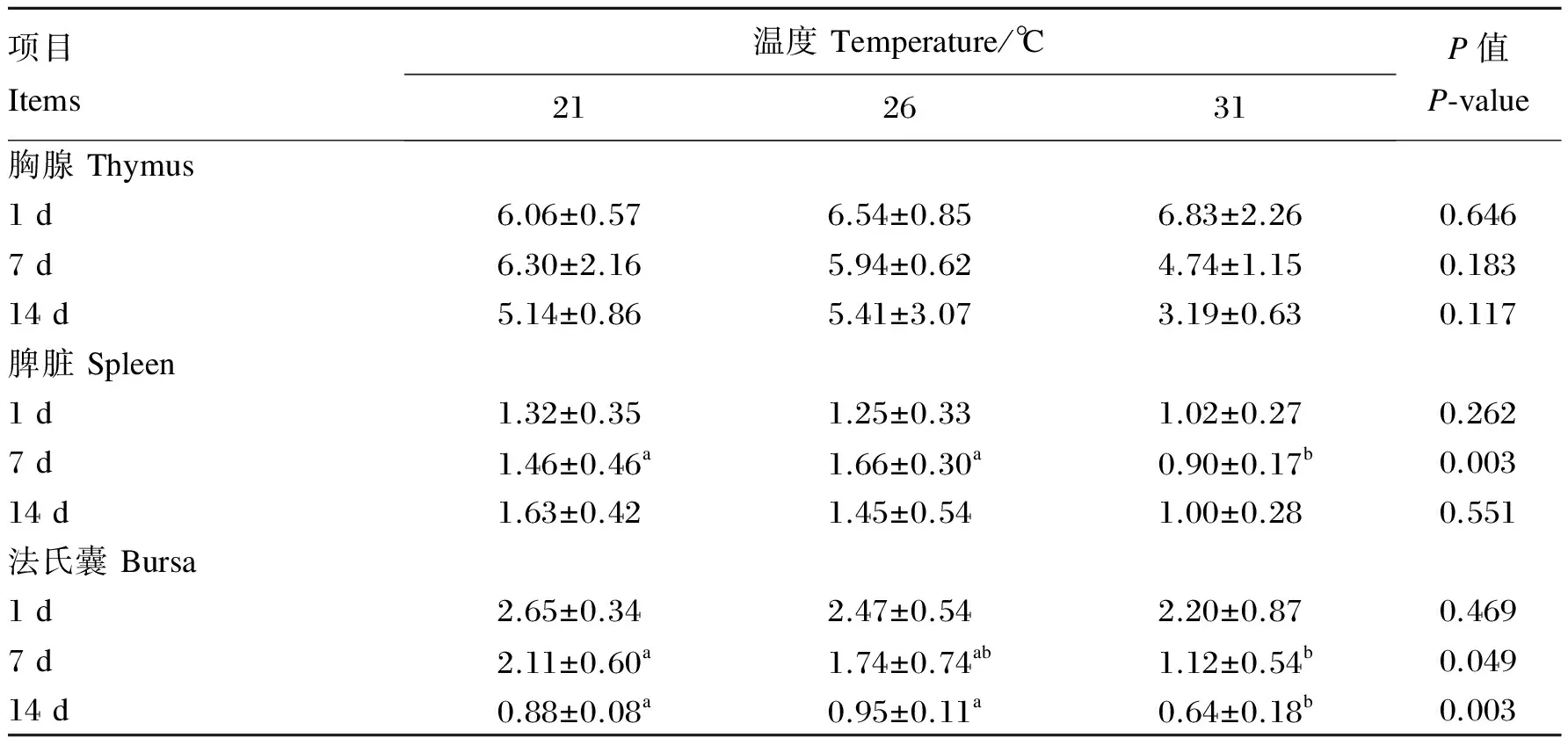
表2 持续偏热处理对肉仔鸡免疫器官指数的影响
同行数据肩标不同小写字母表示差异显著(P<0.05),相同或无字母表示差异不显著(P>0.05)。下表同。
In the same row, values with different small letter superscripts mean significant difference (P<0.05), while with the same or no letter superscripts mean no significant difference (P>0.05). The same as below.
2.3 持续偏热处理对肉仔鸡小肠黏膜免疫指标的影响
由表4可知,温度处理显著影响试验第1、7天十二指肠SIgA的含量(P<0.05),试验第14天各处理间差异不显著(P>0.05);试验第1天31 ℃处理显著低于21和26 ℃处理(P<0.05),后两者间差异不显著(P>0.05);处理第7天,相比于21 ℃处理,26和31 ℃处理SIgA的含量显著降低(P<0.05),后两者差异不显著(P>0.05)。温度处理显著影响试验第1天空肠SIgA的含量(P<0.05),试验第7、14天有显著趋势(P<0.10);试验第1天31 ℃处理显著低于21和26 ℃处理(P<0.05)。温度处理对回肠SIgA的含量影响不显著(P>0.05)。
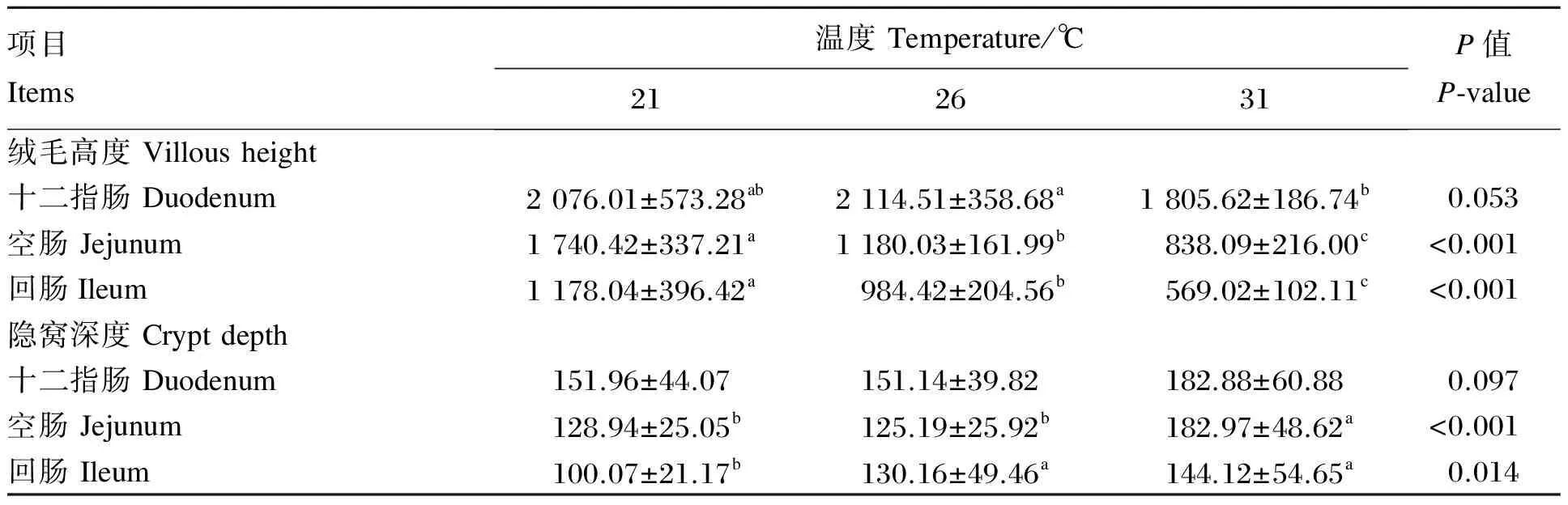
表3 持续偏热处理对肉仔鸡小肠形态结构的影响
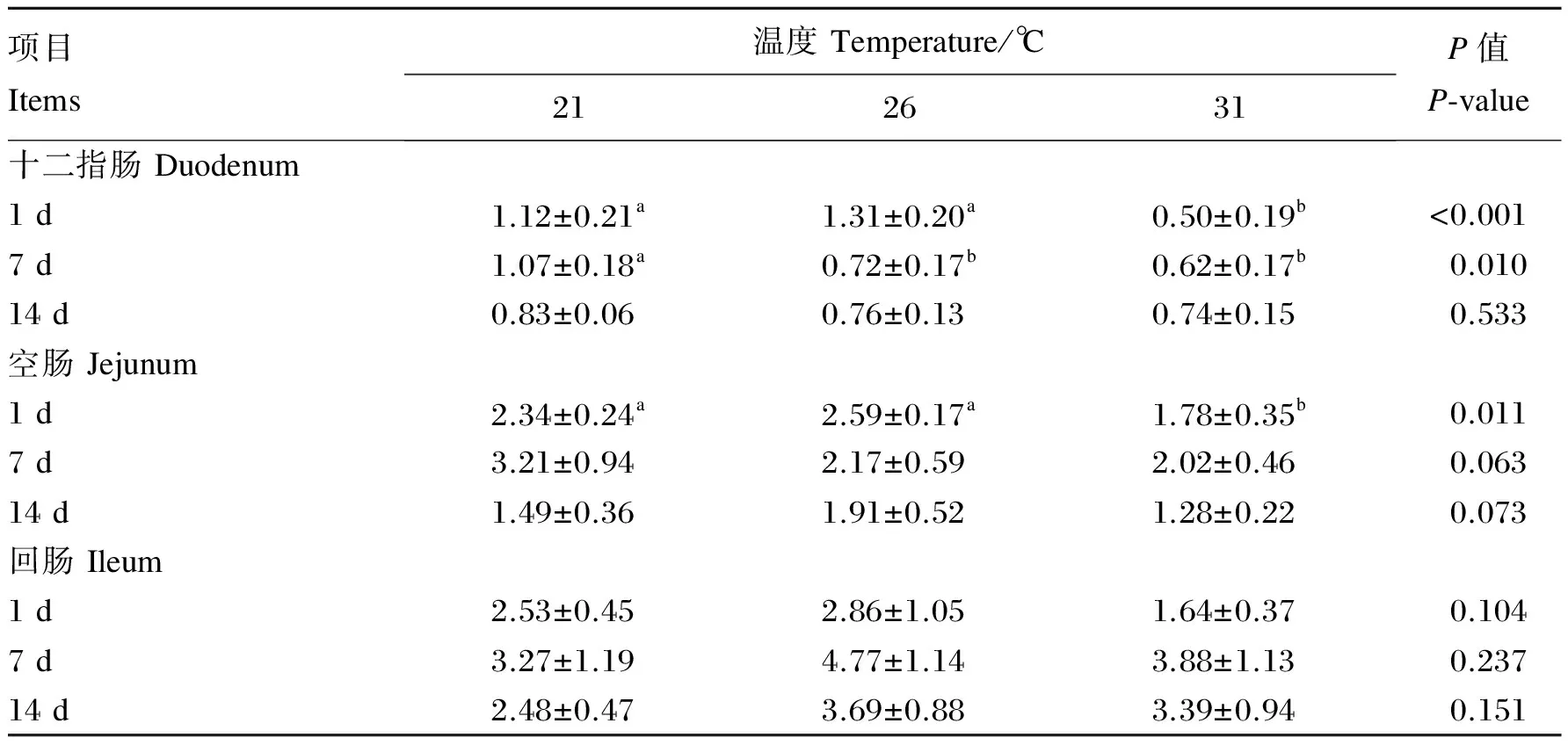
表4 持续偏热处理对肉仔鸡十二指肠、空肠和回肠SIgA含量的影响
3 讨 论
3.1 持续偏热处理对肉仔鸡免疫器官指数的影响
免疫器官的发育和重量的增加是自身细胞生长发育和分裂的结果[14],同时免疫器官又是机体体液免疫和细胞免疫细胞的来源与效应场所[15],因此免疫器官重量和指数的高低可在一定程度上反映机体免疫水平的强弱,是评价机体免疫状态的常用指标[16]。
诸多报道证实,高温会对肉仔鸡免疫器官发育产生不利的影响。张乐萃等[17]报道,相对于热中性温度(20~22 ℃)而言,热应激处理(32~36 ℃)显著降低肉仔鸡(28日龄~56日龄)脾脏、法氏囊和胸腺的重量以及脾脏和法氏囊指数,但对胸腺指数无显著影响。Quinteiro-Filho等[7]研究发现,36 ℃处理显著降低肉仔鸡(35~42日龄)胸腺、脾脏和法氏囊指数。本试验在研究持续偏热处理对肉仔鸡免疫器官指数影响时发现,试验全期(29~42日龄)26和31 ℃处理对胸腺指数没有显著影响,说明持续偏热刺激不会显著影响胸腺的发育。试验第7天,31 ℃处理显著降低脾脏和法氏囊指数,说明偏热环境已经影响到脾脏和法氏囊的生长发育,这与Quinteiro-Filho等[7]发现31 ℃处理(间歇性)显著降低法氏囊指数的结果类似;而试验第14天,31 ℃处理只显著降低法氏囊指数,说明长期的偏热处理能够持续影响到法氏囊的生长发育。但是显然随着偏热处理时间的延长,其作用也在逐渐削弱,一方面可能是随着肉仔鸡的生长法氏囊会逐渐退化;另一方面可能跟肉仔鸡产生了适应性有关,甄龙等[10]在研究偏热处理对生产性能的影响时亦有类似的发现。另有报道称,热处理激活了下丘脑-垂体-肾上腺(HPA)轴,糖皮质激素分泌上升,导致对其敏感的肉仔鸡免疫功能的抑制,引发了免疫器官的退化[18-19],不同生长时期其反应的程度不一。因此本试验中2种不同偏热处理(26和31 ℃)对免疫器官发育的影响不一致,可能是由于肉仔鸡日龄和对不同程度的热刺激适应力不同所致。总之,不同持续偏热处理对肉仔鸡的免疫器官发育有着不同的影响,且随着温度的升高影响程度越大。
3.2 持续偏热处理对肉仔鸡小肠形态结构的影响
肠道既是消化和吸收营养的重要器官,又是保持机体内部环境稳定的先天性屏障[20]。小肠良好的机械屏障——肠道黏膜形态结构及其功能的完整性,对保持家禽健康及维持正常生产性能具有重要意义[21]。小肠绒毛高度和隐窝深度等形态学参数是衡量小肠吸收功能和机械屏障的重要指标[22-24]。较长的绒毛可以扩大与肠道内食糜的接触面积,进而增强小肠对营养物质的吸收能力,保障机体健康。隐窝深度反映了小肠细胞生成率,较浅的隐窝表明成熟上皮细胞数量上升,分泌消化液的能力增强,消化功能也随之加强。
诸多研究表明高温热应激会对家禽的小肠黏膜造成损伤。张灿菲[25]研究表明39 ℃热应激显著损伤蛋鸡十二指肠和空肠绒毛。Mitchell等[26]对肉仔鸡进行2周35 ℃慢性热应激处理发现,空肠绒毛高度、湿重和干重分别降低了19%、26%和31%。宁章勇等[27]对肉仔鸡施加高温处理(32 ℃以上)结果发现,处理前3天,绒毛排列比较整齐,绒毛有顶端破裂的现象;处理3~7 d,肠绒毛出现水肿、断裂,有些区域显著变短;处理7 d后,肠绒毛断裂加剧,出现成片缺失现象;对空肠和回肠的影响依次减弱。由此可见,不同程度热应激对小肠的损伤程度不一。本试验发现,相对于21 ℃,持续偏热处理(26和31 ℃)均显著降低空肠和回肠绒毛高度,且2偏热处理间差异显著;31 ℃显著增加空肠隐窝深度,26和31 ℃显著增加回肠隐窝深度。这与Burkholder等[28]在研究热应激(持续30 ℃)对肉仔鸡肠道形态结构时,得出的结果(显著增加回肠的隐窝深度,但对回肠绒毛高度没有显著影响)不一致,差异结果的形成可能是由于采用了不同的处理方式——急性热处理。然而Song等[29]对肉仔鸡施加持续3周的33 ℃高温处理,结果显著降低空肠绒毛高度和绒毛高度/隐窝深度,这与本试验结果相一致。本试验结果似乎可以为甄龙等[10]报道的生产性能下降(持续26和31 ℃处理14 d肉鸡平均体重分别为2.37和2.23 kg,平均日采食量分别为151.04和125.99 g,平均日增重分别为76.53和51.65 g,持续31 ℃处理料重比为2.49)作出解释——由于小肠黏膜形态的破坏,营养物质消化吸收过程受到阻碍,导致一系列生产性能的下降。由此可见,持续的偏热处理会加深对肉仔鸡小肠形态结构的损伤,进而影响到机体的健康。
3.3 持续偏热处理对肉仔鸡小肠黏膜免疫指标的影响
小肠不但是营养物质的消化吸收器官,同样被认为是发挥免疫功能的重要场所。小肠黏膜在抵抗病原体入侵过程中发挥着重要的作用,相关的淋巴组织和免疫活性细胞共同构成了黏膜免疫系统[30]。SIgA作为黏膜表面免疫排斥和抗原的有效因子,在上皮屏障中通过选择性的黏附小肠淋巴Peyer氏结的M细胞起着免疫平衡的作用[31],是免疫应答主要的效应分子,机体抗感染的第一道防线[32]。免疫球蛋白含量的高低是判定免疫功能强弱的重要指标[14,33]。
研究表明,高温热应激会影响家禽小肠黏膜免疫功能。张灿菲[25]研究得出,39 ℃超高温显著降低了蛋鸡十二指肠中SIgA分泌细胞的含量。费东亮等[34]报道,35-30 ℃高温应激模式显著降低小肠中SIgA的含量。康磊等[35]在研究发现,热应激处理(35-30 ℃循环高温)显著降低小肠肉仔鸡SIgA含量,且21、28、35和42日龄均有相同的规律。本研究结果与上述结果并不一致,试验第1天31 ℃偏热处理显著降低十二指肠和空肠SIgA含量,急性偏热处理导致小肠黏膜免疫功能快速下降;试验第7天时,偏热处理(26和31 ℃)只对十二指肠SIgA含量有影响;试验第14天偏热处理对小肠上段SIgA含量影响不显著,且试验全期回肠中SIgA含量变化不显著。由此可见,随着偏热刺激的持续,肉仔鸡可能会逐渐适应,对于不同温度的处理产生免疫耐受性。这可能是区别于较强高温热应激的一大特点。同时研究发现,小肠不同部位对偏热刺激的反应程度不一样,越接近小肠后端敏感度越低。具体的机制仍需在后续研究中深入探讨。
4 结 论
① 与21 ℃相比,31 ℃持续处理显著降低肉仔鸡试验第7天脾脏和法氏囊器官指数,使试验第14天空肠和回肠的绒毛高度显著降低、隐窝深度显著增加,试验第1、7天十二指肠SIgA的含量显著下降。
② 与21 ℃相比,26 ℃持续处理对肉仔鸡试验全期免疫器官指数无显著影响,使试验第14天空肠和回肠的绒毛高度显著降低,试验第14天回肠隐窝深度显著增加,试验第7天十二指肠SIgA的含量显著下降。
③ 持续偏热(26和31 ℃)处理不同程度地影响肉仔鸡免疫器官的发育,损伤小肠形态结构,降低小肠黏膜免疫功能。
[1] MAY J D,LOTT B D,SIMMONS J D.The effect of environmental temperature and body weight on growth rate and feed:gain of male broilers[J].Poultry Science,1998,77(4):499-501.
[2] AL-FATAFTAH A R A,ABU-DIEYEH Z H M.Effect of chronic heat stress on broiler performance in Jordan[J].International Journal of Poultry Science,2007,6(1):64-70.
[3] 呙于明,刘彩霓,周毓平.高温应激对肉仔鸡的影响及补铬的效果研究[J].畜牧兽医学报,1998,29(4):339-344.
[4] TOGHYANI M,ZARKESH S,SHIVAZAD M,et al.Immune responses of broiler chicks fed chromium picolinate in heat stress condition[J].The Journal of Poultry Science,2007,44(3):330-334.
[5] 韩爱云.热应激对肉鸡淋巴细胞钙信号转导的影响及铬的调控作用[D].博士学位论文.北京:中国农业科学院,2010.
[6] DHABHAR F S,SAUL A N,DAUGHERTY C,et al.Short-term stress enhances cellular immunity and increases early resistance to squamous cell carcinoma[J].Brain,Behavior and Immunity,2010,24(1):127-137.
[7] QUINTEIRO-FILHO W M,RIBEIRO A,FERRAZ-DE-PAULA V,et al.Heat stress impairs performance parameters,induces intestinal injury,and decreases macrophage activity in broiler chickens[J].Poultry Science,2010,89(9):1905-1914.
[8] QUINTEIRO-FILHO W M,GOMES A V S,PINHEIRO M L,et al.Heat stress impairs performance and induces intestinal inflammation in broiler chickens infected withSalmonellaEnteritidis[J].Avian Pathology,2012,41(5):421-427.
[9] 尤玉双.鸡舍环境控制对生产性能影响的研究[D].博士学位论文.北京:中国农业大学,2005.
[10] 甄龙,石玉祥,张敏红,等.持续偏热环境对肉鸡生长性能、糖脂代谢及解偶联蛋白mRNA表达的影响[J].动物营养学报,2015,27(7):2060-2069.
[11] 胡春红,张敏红,冯京海,等.偏热刺激对肉鸡休息行为、生理及生产性能的影响[J].动物营养学报,2015,27(7):2070-2076.
[12] 张敏红,苏红光,冯京海,等.采集用于建立肉鸡生活环境舒适性评价模型数据的方法和专用装置:中国,CN103404447A[P].2013-11-27.
[13] 魏凤仙.湿度和氨暴露诱导的慢性应激对肉仔鸡生长性能、肉品质、生理机能的影响及其调控机制[D].博士学位论文.杨凌:西北农林科技大学,2012.
[14] 彭翔,孙全友,李杰,等.抗菌肽和姜黄素对1~21日龄肉仔鸡生长性能和免疫功能的影响[J].动物营养学报,2014,26(2):474-481.
[15] 杨汉春.动物免疫学[M].2版.北京:中国农业大学出版社,2003.
[16] 韩杰,张飞,边连全.刺五加多糖对免疫应激断奶仔猪免疫器官指数、粪便微生物菌群数量和胃肠道pH的影响[J].动物营养学报,2014,26(8):2314-2319.
[17] 张乐萃,刘世华,王述柏,等.热应激对肉鸡免疫器官形态学影响的研究[J].中国兽医杂志,1998,24(7):24-25.
[18] POST J,REBEL J M,TER HUURNE A A.Physiological effects of elevated plasma corticosterone concentrations in broiler chickens.An alternative means by which to assess the physiological effects of stress[J].Poultry Science,2003,82(8):1313-1318.
[19] SHINI S,KAISER P,SHINI A,et al.Biological response of chickens (Gallusgallusdomesticus) induced by corticosterone and a bacterial endotoxin[J].Comparative Biochemistry and Physiology Part B:Biochemistry and Molecular Biology,2008,149(2):324-333.
[20] 呙于明,刘丹,张炳坤.家禽肠道屏障功能及其营养调控[J].动物营养学报,2014,26(10):3091-3100.
[21] 王圣,李绍钰.家禽肠道黏膜形态结构及其调控的研究进展[J].动物营养学报,2013,25(4):699-704.
[22] WU Y B,RAVINDRAN V,THOMAS D G,et al.Influence of method of whole wheat inclusion and xylanase supplementation on the performance,apparent metabolisable energy,digestive tract measurements and gut morphology of broilers[J].British Poultry Science,2004,45(3):385-394.
[23] TOUCHETTE K J,CARROLL J A,ALLEE G L,et al.Effect of spray-dried plasma and lipopolysaccharide exposure on weaned pigs:Ⅰ.Effects on the immune axis of weaned pigs.[J].Journal of Animal Science,2002,80(2):494-501.
[24] 任永军,雷岷,邝良德,等.复合芽孢杆菌制剂对肉兔肠道发育和免疫功能的影响[J].动物营养学报,2014,26(1):144-152.
[25] 张灿菲.精氨酸对急性热应激鸡肠道黏膜免疫的影响[D].硕士学位论文.武汉:华中农业大学,2008.
[26] MITCHELL M A,CARLISLE A J.The effects of chronic exposure to elevated environmental temperature on intestinal morphology and nutrient absorption in the domestic fowl (Gallusdomesticus)[J].Comparative Biochemistry and Physiology Part A:Physiology,1992,101(1):137-142.
[27] 宁章勇,刘思当,赵德明,等.热应激对肉仔鸡呼吸、消化和内分泌器官的形态和超微结构的影响[J].畜牧兽医学报,2003,34(6):558-561.
[28] BURKHOLDER K M,THOMPSON K L,EINSTEIN M E,et al.Influence of stressors on normal intestinal microbiota,intestinal morphology,and susceptibility toSalmonellaEnteritidis colonization in broilers[J].Poultry Science,2008,87(9):1734-1741.
[29] SONG J,XIAO K,KE Y L,et al.Effect of a probiotic mixture on intestinal microflora,morphology,and barrier integrity of broilers subjected to heat stress[J].Poultry Science,2014,93(3):581-588.
[30] Mayer L.Mucosal immunity and gastrointestinal antigen processing[J].Journal of Pediatric Gastroenterology and Nutrition,2000,30(1):S4-S12.
[31] 王定越,徐盛玉,宋洁,等.分泌性免疫球蛋白A与肠道黏膜免疫的关系及其分泌的营养调控[J].动物营养学报,2012,24(10):1854-1860.
[32] ROUND J L,MAZMANIAN S K.The gut microbiota shapes intestinal immune responses during health and disease[J].Nature Reviews Immunology,2009,9(5):313-323.
[33] 何颖,赵武,秦毅斌,等.NS复合乳酸菌制剂对断奶仔猪免疫水平的影响[J].动物医学进展,2011,32(12):51-56.
[34] 费东亮,王宏军,苏禹刚,等.牛磺酸对热应激肉鸡肠道SIgA和细胞因子的影响[J].饲料研究,2014(13):33-35.
[35] 康磊,李文立,姜建阳,等.谷氨酰胺对热应激肉鸡S-IgA、血液内毒素和细胞因子的影响[J].中国兽医学报,2012,32(4):609-614.
*Contributed equally
**Corresponding author, professor, E-mail:zmh66@126.com
(责任编辑 陈 燕)
Effects of Continuous Partial Heat Treatment on Immune Organ Indexes, Small Intestinal Morphology and Mucosal Immunity Indexes of Broiler Chickens
ZHANG Shaoshuai1ZHEN Long1,2*FENG Jinghai1HU Chunhong1PENG Qianqian1,2CHANG Yu1ZHOU Ying1ZHANG Minhong1**
(1.StateKeyLaboratoryofAnimalNutrition,InstituteofAnimalSciences,ChineseAcademyofAgriculturalSciences,Beijing100193,China; 2.CollegeofAgriculture,HebeiUniversityofEngineering,Handan056021,China)
This experiment was conducted to study the effects of different continuous partial heat (26 and 31 ℃) treatments on immune organ indexes, small intestinal morphology and mucosal immunity indexes of broiler chickens. One hundred and forty-four 22-day-old Arbor Acres (AA) broiler chickens were assigned to three environment chambers (treatments), each chamber contained six cages (replicates) with eight birds per cage (with four males and four females). The pre-test period lasted for 7 days and broiler chickens were kept at 21 ℃ and 60% relative humidity. When broiler chickens were 29-day-old, the temperatures of each environmental chamber were gradually regulated to 21, 26 and 31 ℃, respectively, while maintaining the relative humidity at 60% and both kept constant until the end of the experiment. The trial period lasted for 14 days. The results showed as follows: compared with 21 ℃ treatment, 1) temperature treatments had no significant effect on the thymus index of broiler chickens (P>0.05). On day 7, 31 ℃ treatment significantly reduced the spleen index (P<0.05). The 31 ℃ treatment significantly reduced the bursa index on days 7 and 14 (P<0.05). 2) The 26 and 31 ℃ treatments significantly reduced the villus height of jejunum and ileum on day 14 (P<0.05). The 31 ℃ treatment significantly increased crypt depth of jejunum on day 14 (P<0.05). The 26 and 31 ℃ treatments significantly increased the crypt depth of ileum on day 14 (P<0.05). 3) The 31 ℃ treatment significantly reduced the secretory immunoglobulin A (SIgA) content of duodenum on day 1. The 26 and 31 ℃ treatments significantly reduced SIgA content of duodenum on day 7. The 31 ℃ treatment significantly reduced SIgA content of jejunum on day 1. In conclusion, compared with 21 ℃ treatment, the partial heat (26 and 31 ℃) treatments can affect the development of immune organs, damage small intestinal morphology and reduce immune function of intestinal mucosa to varying degrees.[ChineseJournalofAnimalNutrition, 2015, 27(12):3887-3894]
partial heat treatment; broiler chickens; immune organ indexes; small intestinal morphology; mucosal immunity
10.3969/j.issn.1006-267x.2015.12.030
2015-06-15
国家“十二五”科技支撑课题(2012BAD39B02);中国农业科学院科技创新工程(ASTIP-IAS07)
张少帅(1991—),男,河北沙河人,硕士研究生,研究方向为家禽营养与环境。E-mail: zss9587@126.com
S852.1;S831
A
1006-267X(2015)12-3887-08
*同等贡献作者
**通信作者:张敏红,研究员,博士生导师,E-mail: zmh66@126.com

