益生菌对军曹鱼幼鱼生长性能、消化酶和免疫酶活性的影响
何伟聪 董晓慧,2* 谭北平,2 杨奇慧 迟淑艳 刘泓宇 章 双
(1.广东海洋大学水产学院水产动物营养与饲料实验室,湛江524088;2.南海生物资源开发与利用协同创新中心,广州510006)
益生菌对军曹鱼幼鱼生长性能、消化酶和免疫酶活性的影响
何伟聪1董晓慧1,2*谭北平1,2杨奇慧1迟淑艳1刘泓宇1章 双1
(1.广东海洋大学水产学院水产动物营养与饲料实验室,湛江524088;2.南海生物资源开发与利用协同创新中心,广州510006)
本试验旨在研究枯草芽孢杆菌、嗜酸乳杆菌单独或混合添加于饲料中对军曹鱼幼鱼生长性能、消化酶和免疫酶活性的影响。选取平均体重为(22.00±0.15) g的健康军曹鱼幼鱼840尾,随机分成7组(T0、T1、T2、T3、T4、T5、T6组),每组3个重复,每个重复40尾鱼。T0组为对照组,投喂基础饲料50 d;T1、T2和T3组前30天分别投喂含1×107CFU/g枯草芽孢杆菌、1×107CFU/g嗜酸乳杆菌、2×107CFU/g枯草芽孢杆菌与嗜酸乳杆菌混合物(枯草芽孢杆菌∶嗜酸乳杆菌=1∶1,质量比)的饲料,后20天投喂基础饲料;T4、T5和T6组分别投喂含1×107CFU/g枯草芽孢杆菌、1×107CFU/g嗜酸乳杆菌、2×107CFU/g枯草芽孢杆菌与嗜酸乳杆菌混合物的饲料50 d。结果显示:与对照组相比,T1、T2组的增重率(WGR)无显著差异(P>0.05),T3、T4、T5、T6组的WGR则显著升高(P<0.05),最大值出现在T6组,且显著高于其他各组(P<0.05)。特定生长率(SGR)的变化趋势与WGR类似。T2、T3、T4、T5、T6组的饲料系数(FCR)显著低于对照组(P<0.05),同时T4和T6组还显著低于其他益生菌添加组(P<0.05)。饲料中添加益生菌能显著提高肝脏淀粉酶及肝脏和肠道蛋白酶活性(P<0.05);对照组及T3和T4组肠道淀粉酶活性显著低于T5和T6组(P<0.05),显著高于T1和T2组(P<0.05)。各益生菌添加组血清溶菌酶活性均显著高于对照组(P<0.05)。持续投喂益生菌组(T4、T5、T6组)血清总超氧化物歧化酶活性显著高于对照组(P<0.05),且T6组还显著高于T4和T5组(P<0.05),非持续投喂益生菌组(T1、T2、T3组)中除T1组外均显著低于对照组(P<0.05)。与对照组相比,饲料中添加益生菌显著降低血清碱性磷酸酶活性(P<0.05);血清酸性磷酸酶活性除T2和T3组显著高于对照组(P<0.05)、T6与对照组无显著差异(P>0.05)外,其余各组均显著低于对照组(P<0.05)。本试验条件下,饲料中添加枯草芽孢杆菌、嗜酸乳杆菌或二者的混合物(质量比1∶1)均能够促进军曹鱼幼鱼的生长,提高免疫酶和消化酶活性,持续投喂效果优于非持续投喂,以持续投喂2种益生菌混合物的效果最佳。
军曹鱼;益生菌;生长性能;免疫酶;消化酶
军曹鱼(Rachycentroncanadum)隶属鲈形目(Perciformes),鲈亚目(Percoidei),军曹鱼科(Rachycentridae),军曹鱼属(Rachycentron),俗称海鲡、海龙鱼,具有个体大、生长快、营养丰富、肉质细腻、味道鲜美等特点,是当前我国南方海水网箱养殖的优良品种之一[1-2]。近年来,随着高密度集约化养殖模式的推广,养殖密度过大及养殖水体恶化等问题导致军曹鱼病害频发,为控制病害而大量使用的抗生素不仅破坏了养殖水体生态系统,而且因水产品中的药物残留带来食品安全问题。为了更好地解决养殖病害和食品安全等问题,确保水产养殖业的可持续健康发展,寻找绿色环保、安全高效的抗生素替代品成为目前的研究热点。由于在生产上通过在饲料中添加免疫增强剂来防止鱼类疾病的方法简单易行,且具有良好效果,因此越来越受到人们的关注。而免疫增强剂中的益生菌由于具有提高养殖动物生长性能、免疫力、抗病力作用且无残留、无毒副、对环境无不良影响,成为最有潜力的抗生素替代品。
益生菌是指在一定浓度范围内可以促进动物健康的活体微生物[3],主要有芽孢杆菌类、乳酸菌类、酵母菌和光合细菌等,我国已批准部分品种在养殖业和饲料业中应用。益生菌的作用机理主要为:自身富含蛋白质、维生素等营养物质;其在增殖的过程中分泌的酶类可促进宿主对营养物质的消化吸收;生长过程中通过竞争空间和营养物质而抑制致病菌的生长;自身的结构成分如肽聚糖等能刺激宿主免疫系统,进而提高免疫力[4-5]。研究发现,饲料中添加不同水平的益生菌可提高凡纳滨对虾(Litopenaeusvannamei)[6-7]、牙鲆(Paralichthysolivaceus)[8]、罗非鱼(Oreochromisspp.)[9]、金头鲷(Sparusauratus)[10-11]等的生长性能、相关酶活性和抗病力。饲料中添加益生菌对军曹鱼生长、免疫等指标影响的研究仅见于本实验室报道,而益生菌不同投喂方式对军曹鱼生长等指标影响的研究未见报道。因此,本试验旨在探讨持续与非持续投喂添加单一或复合益生菌的饲料对军曹鱼幼鱼生长性能、消化酶和免疫酶活性的影响,从而为益生菌在军曹鱼养殖中高效、合理地应用提供科学依据。
1 材料与方法
1.1 试验设计及饲料制作
以鱼粉、去皮豆粕为蛋白质源,鱼油、玉米油和大豆磷脂油为脂肪源,制成粗蛋白质含量46%、粗脂肪含量8%的基础饲料(表1),在基础饲料中分别添加枯草芽孢杆菌、嗜酸乳杆菌及二者的混合物(枯草芽孢杆菌∶嗜酸乳杆菌=1∶1,质量比),配制成有效活菌数分别为1.0×107、1.0×107、2.0×107CFU/g的3种试验饲料,上述菌种均购自广东省微生物菌种保藏中心(GIMCC)。饲料原料经粉碎后过60目筛,按照配方比例准确称重后混匀,微量组分以逐级扩大法添加混合,之后加入预先混匀的鱼油、大豆磷脂油和玉米油,搓散油脂颗粒后搅拌混合15 min,分别加入氯化胆碱溶液、一水合磷酸二氢钙溶液,继续搅拌5 min,然后按处理将不同的菌液添加水分稀释后加入到正在搅拌的饲料中,继续搅拌10 min,用F-26型双螺杆挤条机将搅拌均匀的饲料压制成粒径为3.0 mm的颗粒饲料,风干后用封口袋编号分装,于-20 ℃冰箱保存备用,并检测饲料样品中有效活菌数。
1.2 试验用鱼及饲养管理
养殖试验在广东省湛江市南三岛海域广东粤海饲料有限公司深水网箱系统中进行。试验用鱼购于海南省琼海市博鳌镇某鱼苗场。试验开始前,军曹鱼幼鱼先在网箱(3.0 m×3.0 m×4.5 m)中暂养2周,期间投喂商品饲料(广东粤海饲料有限公司产品,粗蛋白质含量44%),使其适应养殖环境和饲料。暂养期结束后,饥饿24 h后,挑选健壮无伤、规格一致[平均体重(22.00±0.15) g]的军曹鱼幼鱼随机分配到21个网箱(1.5 m×2.0 m×2.5 m)中,每个网箱放养40尾鱼。根据试验设计,将试验鱼分为7个组,每组3个重复(网箱)。对照组(T0组)投喂基础饲料;T1、T2和T3组在前30天分别投喂含枯草芽孢杆菌、嗜酸乳杆菌、枯草芽孢杆菌+嗜酸乳杆菌饲料,后20天投喂基础饲料;T4、T5和T6组分别持续投喂含枯草芽孢杆菌、嗜酸乳杆菌、枯草芽孢杆菌+嗜酸乳杆菌饲料50 d。每天投喂2次(07:00、17:00),日投喂量为体重的5%~10%,水温29.5~34.0 ℃,盐度16‰~20‰,溶解氧浓度≥6 mg/L,试验期50 d。
1.3 样品采集及分析方法
1.3.1 样品采集
养殖试验结束饥饿24 h后,将每个网箱中的军曹鱼全部捞出,用丁香酚(1∶10 000)麻醉后称重、计数。每个网箱随机选取6尾鱼心脏采血,采集的血样放入不含抗凝剂的1.5 mL的离心管中,在冰上静置4 h,然后4 ℃条件下4 000 r/min离心10 min,收集血清,分装后于-80 ℃冰箱保存待测。每个网箱再随机取5尾鱼解剖取肝脏、肠道(前、后肠),于-80 ℃超低温冰箱保存待测。

表1 基础饲料组成及营养水平(干物质基础)
1)维生素预混料为每千克饲料提供The vitamin premix provided the following per kg of the diet:VA 12 000 IU,VD 4 000 IU,VE 400 mg,VK340 mg,VB160 mg,VB2200 mg,VB640 mg,VB120.4 mg,泛酸钙 calcium pantothenate 280 mg,烟酸nicotinic acid 800 mg,生物素 biotin 6 mg,叶酸 folic acid 15 mg,肌醇 inositol 400 mg,对氨基苯甲酸 PABA 400 mg,β-胡萝卜素 β-carotene 12 mg。
2)矿物质预混料为每千克饲料提供The mineral premix provided the following per kg of the diet:KCl 953.47 mg,MgSO4·7H2O 1 024.44 mg,柠檬酸铁 ferric citrate 850.25 mg,ZnSO4·7H2O 353.57 mg,CuSO4·5H2O 59.84 mg,MnSO4·H2O 96.26 mg,CoCl2·6H2O 8.16 mg,Na2SeO34.47 mg。
3)测定值 Measured values。
1.3.2 指标测定
饲料常规成分测定:采用AOAC(2005)[12]中方法进行。其中,水分含量测定采用105 ℃烘干恒重法;粗蛋白质含量测定采用凯氏定氮法;粗脂肪含量测定采用索氏抽提法;粗灰分含量测定采用箱式电阻炉550 ℃灼烧法。
血清免疫酶活性测定:碱性磷酸酶(AKP)、酸性磷酸酶(ACP)、总超氧化物歧化酶(T-SOD)、溶菌酶(LZM)活性均采用南京建成生物工程研究所提供的试剂盒测定,样品前处理、试剂配制和测定步骤严格按照操作说明书执行。
肝脏及肠道淀粉酶(AMS)、蛋白酶(PRS)活性测定:称取适量组织,并记下其准确重量,按照组织样品与生理盐水1∶9的比例加入生理盐水,并在冰水浴条件下匀浆,制成10%组织匀浆液,4 ℃条件下2 500 r/min离心15 min,小心吸取上清液分装,进行测定。AMS活性测定严格按照南京建成生物工程研究所提供的试剂盒说明书执行,PRS活性测定采用福林酚试剂法[13],以每毫克组织蛋白质在37 ℃下每分钟水解酪蛋白生成1 μg酪氨酸作为1个酶活性单位。
1.4 计算公式
增重率(WGR,%)=100×
(末均重-初均重)/初均重;
特定生长率(SGR,%/d)=100×(ln末均重-
ln初均重)/饲养天数;
饲料系数(FCR)=摄食饲料总重/
(末均重-初均重);
成活率(SR,%)=100×终末尾数/
初始尾数。
1.5 统计分析
试验结果以平均值±标准差(mean±SD)表示。用SPSS 19.0软件对所有数据进行单因素方差分析(one-way ANOVA),当组间差异显著(P<0.05)时,进行Duncan氏法多重比较。
2 结 果
2.1 益生菌对军曹鱼幼鱼生长性能的影响
由表2可知,饲料中添加益生菌对军曹鱼幼鱼有促进生长的作用,其中持续投喂组(T4、T5、T6组)的WGR和SGR均显著高于对照组(P<0.05),同时T4和T5组间无显著差异(P>0.05),但均显著低于T6组(P<0.05)。非持续投喂组(T1、T2和T3组)间WGR和SGR无显著差异(P>0.05)。T1和T2组的WGR与对照组无显著差异(P>0.05),但T3组的WGR则显著高于对照组(P<0.05);T1组的SGR与对照组无显著差异(P>0.05),T2、T3组的SGR则显著高于对照组(P<0.05)。此外,与对照组相比,各益生菌添加组军曹鱼幼鱼的FCR均显著降低(P<0.05),连续投喂组的FCR均优于非连续投喂组,其中T4和T6组的FCR显著低于其他益生菌添加组(P<0.05)。各组的成活率无显著差异(P>0.05)。
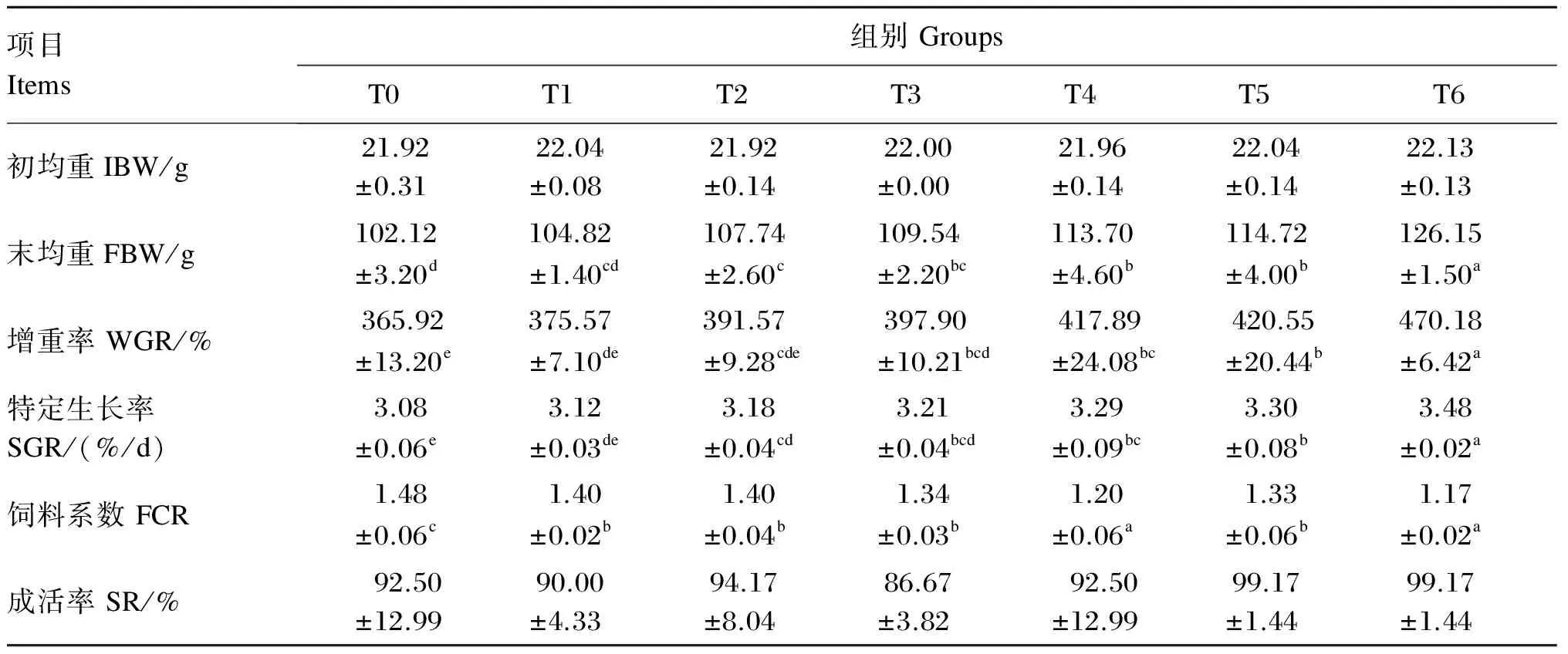
表2 益生菌对军曹鱼幼鱼生长性能的影响
同行数据肩标无字母或相同字母表示差异不显著(P>0.05),不同小写字母表示差异显著(P<0.05)。下表同。
In the same row, values with no letter or the same letter superscripts mean no significant difference (P>0.05), while with different small letter superscripts mean significant difference (P<0.05). The same as below.
2.2 益生菌对军曹鱼幼鱼肝脏及肠道消化酶活性的影响
由表3可知,与对照组相比,饲料中添加益生菌显著提高军曹鱼幼鱼肝脏AMS活性(P<0.05),其中T6组的肝脏AMS活性显著高于其他益生菌添加组(P<0.05),而其他益生菌添加组间无显著差异(P>0.05)。T5和T6组的前肠AMS活性显著高于对照组(P<0.05),而T1和T2组则显著低于对照组(P<0.05),T3、T4组则与对照组无显著差异(P>0.05)。T4组的后肠AMS活性显著高于对照组(P<0.05),且显著高于T1、T2、T5组(P<0.05),但与T3、T6组无显著差异(P>0.05)。此外,与对照组相比,各益生菌添加组的肝脏、前肠和后肠PRS活性显著提高(P<0.05),同时持续投喂组均显著高于非持续投喂组(P<0.05)。T6组的肝脏和前肠PRS活性与T5组无显著差异(P>0.05),但显著高于T4组(P<0.05);T6组的后肠PRS活性显著高于其他益生菌添加组(P<0.05),T4与T5组之间无显著差异(P>0.05)。
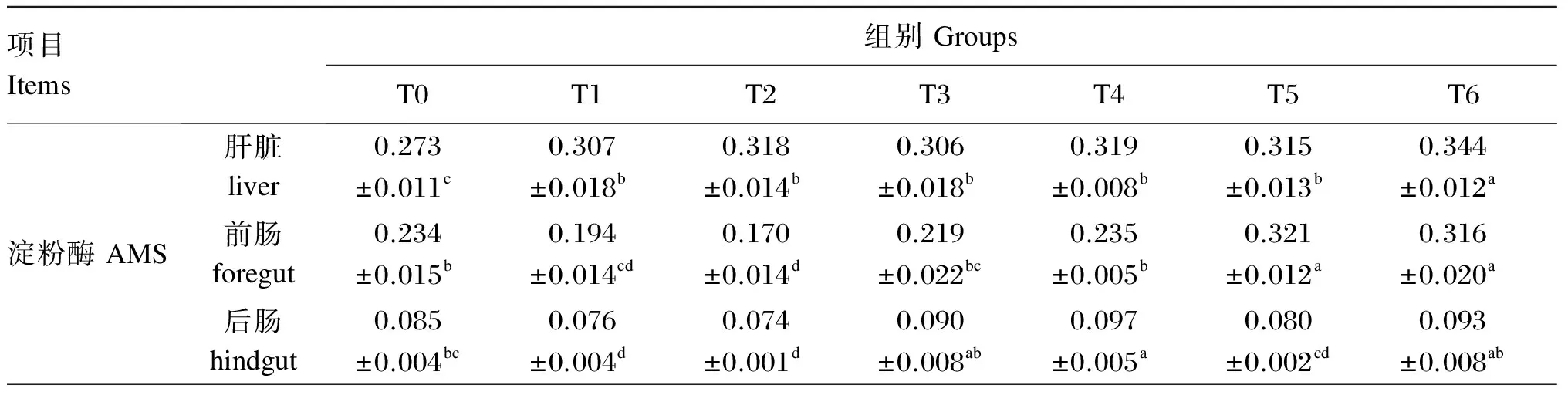
表3 益生菌对军曹鱼幼鱼肝脏及肠道消化酶活性的影响
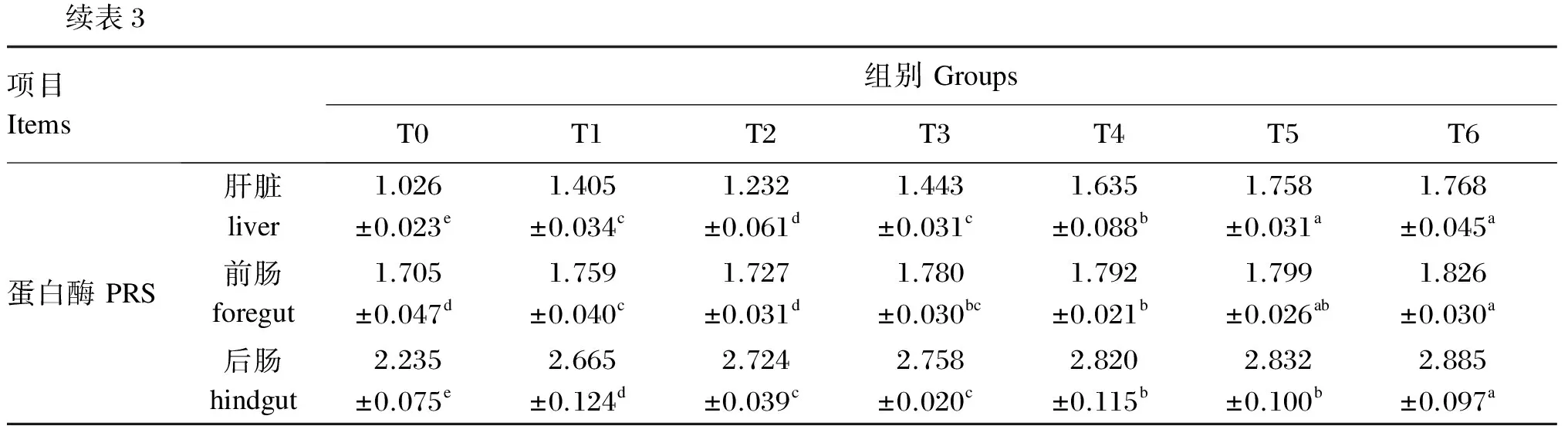
续表3项目Items组别GroupsT0T1T2T3T4T5T6蛋白酶PRS肝脏liver1.026±0.023e1.405±0.034c1.232±0.061d1.443±0.031c1.635±0.088b1.758±0.031a1.768±0.045a前肠foregut1.705±0.047d1.759±0.040c1.727±0.031d1.780±0.030bc1.792±0.021b1.799±0.026ab1.826±0.030a后肠hindgut2.235±0.075e2.665±0.124d2.724±0.039c2.758±0.020c2.820±0.115b2.832±0.100b2.885±0.097a
2.3 益生菌对军曹鱼幼鱼血清免疫酶活性的影响
由表4可知,与对照组相比,各益生菌添加组军曹鱼幼鱼血清LZM活性均显著提高(P<0.05),血清LZM活性在各组之间均具有显著差异(P<0.05),以T6组最高。与对照组相比,持续投喂组能显著提高血清T-SOD活性(P<0.05),且持续投喂复合益生菌组(T6组)显著高于持续投喂单一益生菌组(T4、T5组);血清T-SOD活性在非持续
投喂益生菌组中,T1组与对照组无显著差异(P>0.05),T2和T3组显著低于对照组(P<0.05)。与对照组相比,饲料中添加益生菌能显著降低血清AKP活性(P<0.05)。T3、T4和T5组血清ACP活性显著低于对照组(P<0.05),T1和T2组则显著高于对照组(P<0.05),T6组与对照组无显著差异(P>0.05)。
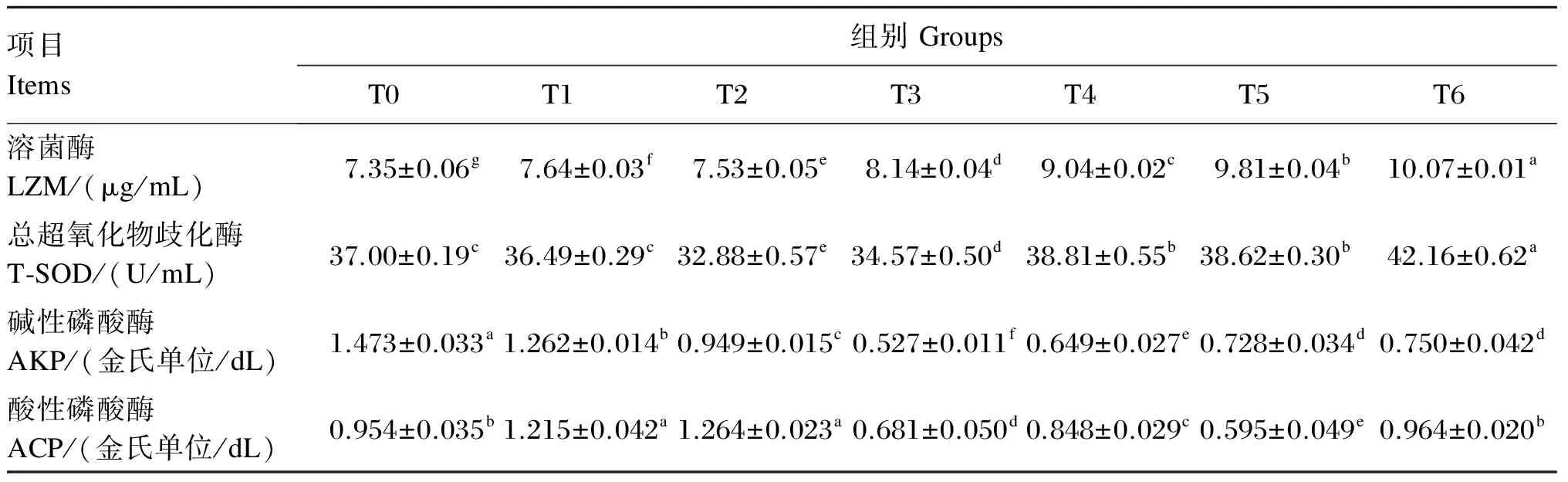
表4 益生菌对军曹鱼幼鱼血清免疫酶活性的影响
3 讨 论
目前益生菌已经以不同的方式(如拌料投喂、投入到水中、强化活饵等)运用到水产养殖业当中,Wang等[9]每隔4 d用1×107CFU/mL的粪肠球菌(Enteroccusfaecium)ZJ4处理罗非鱼(Oreochromisniloticus)养殖水体,结果表明,经益生菌处理的养殖水体中的罗非鱼体增重和日增重显著高于未处理的对照组。华雪铭等[14]发现,在饲料中添加芽孢杆菌(Bacillussp.)和硒酵母可显著促进异育银鲫(Carassiusauratusgibelio)的生长。在大菱鲆(Scophthalmusmaximus)[15]、草鱼(Ctenopharyngodonidellus)[16]、牙鲆[8,17]、青鱼(Mylopharyngodonpiceus)[18]、吉富罗非鱼(GIFT)[19]、斜带石斑鱼(Epinepheluscoioides)[20]等养殖对象饲料中添加不同益生菌的研究结果均表明益生菌能在一定程度上促进动物的生长,提高动物的WGR。本试验中,各益生菌添加组的WGR和SGR均优于对照组,从试验结果可以看出,持续投喂益生菌的效果优于非持续投喂,复合益生菌效果优于单一益生菌。连续投喂复合益生菌的T6组的WGR比对照组提高了28.49%,与上述研究结果相似。据报道,复合益生菌比单一益生菌更能提高大菱鲆的存活率及其生长性能[15]。Zokaeifar等[6]报道,2株枯草芽孢杆菌对凡纳滨对虾的WGR、SGR有显著提高,但不影响FCR。另有研究认为饲料中不同浓度的枯草芽孢杆菌对青鱼的体增重和FCR无显著影响[18],不同浓度的嗜酸乳酸菌不影响吉富罗非鱼的增重和FCR[19]。上述试验结果的不同可能源于益生菌的种类和添加量、试验动物种类和规格的不同,且益生菌的活性及其对水生动物作用还受到养殖环境如盐度、温度等因素的影响[21]。目前研究认为益生菌促进鱼体生长主要在于进入鱼体消化道的益生菌富含蛋白质,易被机体吸收,其次进入消化道的益生菌能够定植下来,抑制和排除有害菌,达到维持或恢复肠内菌群的平衡,使机体处于良好的状态,利于对饲料营养物质的消化吸收[22-23]。此外,肠道内的益生菌在增殖过程中会分泌代谢酶类,补充内源性酶或将鱼体不能消化的大分子物质分解成易被肠道细胞吸收的小分子物质,进而更利于鱼类的生长。
4 结 论
在本试验条件下,饲料中添加枯草芽孢杆菌、嗜酸乳杆菌或二者(质量比1∶1)的混合物均可提高军曹鱼幼鱼的生长性能、免疫力及消化酶活性,且持续投喂复合益生菌效果优于非持续或单一投喂益生菌,说明本试验选择的2种益生菌在消化道中具有协同作用。
[1] 艾春香.军曹鱼的养殖生物学特性及营养需求[J].饲料研究,2004(2):41-44 .
[2] 勾效伟,区又君,廖锐.我国军曹鱼研究现状[J].海洋渔业,2007,29(1):84-89.
[4] FULLER R.Probiotics in man and animals[J].Journal of Applied Bacteriology,1989,66(5):365-378.
[5] BOMBA A,NEMCOVR,MUDROOVD,et al.The possibilities of potentiating the efficacy of probiotics[J].Trends in Food Science & Technology,2002,13(4):121-126.
[6] ZOKAEIFAR H,BALCZAR J L,SAAD C R,et al.Effects ofBacillussubtilison the growth performance,digestive enzymes,immune gene expression and disease resistance of white shrimp,Litopenaeusvannamei[J].Fish & Shellfish Immunology,2012,33(4):683-689.
[7] 杨世平,吴灶和,简纪常.饲料中添加沼泽生红冬孢酵母对凡纳滨对虾消化酶及肠道微生物的影响[J].水产科学,2011,30(7):391-394.
[8] KIM J S,HARIKRISHNAN R,KIM M C,et al.Dietary administration ofZooshikellasp.enhance the innate immune response and disease resistance ofParalichthysolivaceusagainstSreptococcusiniae[J].Fish & Shellfish Immunology,2010,29(1):104-110.
[9] WANG Y B,TIAN Z Q,YAO J T,et al.Effect of probiotics,Enteroccusfaecium,on tilapia (Oreochromisniloticus) growth performance and immune response[J].Aquaculture,2008,277(3):203-207.
[10] VARELA J L,RUIZ-JARABO I,VARGAS-CHACOFF L,et al.Dietary administration of probiotic Pdp11 promotes growth and improves stress tolerance to high stocking density in gilthead seabreamSparusauratus[J].Aquaculture,2010,309(1/2/3/4):265-271.
[11] CEREZUELA R,GUARDIOLA F A,GONZLEZ P,et al.Effects of dietary Bacillus subtilis,Tetraselmischuii,andPhaeodactylumtricornutum,singularly or in combination,on the immune response and disease resistance of sea bream (SparusaurataL.)[J].Fish & Shellfish Immunology,2012,33(2):342-349.
[12] AOAC.Official methods of analysis of AOAC International[S].18th ed.Gaithersburg:AOAC International,2005.
[13] 白燕,王维新.刺参肠道蛋白酶、淀粉酶、脂肪酶与纤维素酶活性的测定方法[J].饲料工业,2012,33(20):28-32.
[14] 华雪铭,周洪琪,邱小琮,等.饲料中添加芽孢杆菌和硒酵母对异育银鲫的生长及抗病力的影响[J].水产学报,2001,25(5):448-453.
[15] 高凤祥,郭文,潘雷,等.几种益生菌对大菱鲆幼鱼生长及消化酶活性的影响[J].海洋科学,2011,35(1):10-16.
[16] 沈文英,李卫芬,梁权,等.饲料中添加枯草芽孢杆菌对草鱼生长性能、免疫和抗氧化功能的影响[J].动物营养学报,2011,23(5):881-886.
[17] HEO W S,KIM Y R,KIM E Y,et al.Effects of dietary probiotic,Lactococcuslactissubsp.lactis I2,supplementation on the growth and immune response of olive flounder (Paralichthysolivaceus)[J].Aquaculture,2013,376-379:20-24.
[18] 沈斌乾,陈建明,郭建林,等.饲料中添加枯草芽孢杆菌对青鱼生长、消化酶活性和鱼体组成的影响[J].水生生物学报,2013,17(1):48-53.
[19] 刘小玲,曹俊明,邝哲师,等.嗜酸乳酸菌对吉富罗非鱼生长、非特异性免疫酶活性和肠道菌群的影响[J].广东农业科学,2013,40(1):123-126.
[20] SON V M,CHANG C C,WU M C,et al.Dietary administration of the probiotic,Lactobacillusplantarum,enhanced the growth,innate immune responses,and disease resistance of the grouperEpinepheluscoioides[J].Fish & Shellfish Immunology,2009,26(5):691-698.
[21] 程远,黄凯,黄秀芸,等.饲料中添加枯草芽孢杆菌对吉富罗非鱼幼鱼生长性能、免疫力和抗氧化功能的影响[J].动物营养学报,2014,26(6):1503-1512.
[22] 郭升伟.益生素对仔猪生长性能、血液生化指标及免疫功能的影响[D].硕士学位论文.福州:福建农林大学,2010.
[23] 刘波.益生素对异育银鲫消化酶活性、肠道菌群及生产性能的影响[D].硕士学位论文.南京:南京农业大学,2004.
[24] 江永明,付天玺,张丽,等.微生物制剂对奥尼罗非鱼生长及消化酶活性的影响[J].水生生物学报,2011,35(6):998-1004.
[25] 陈南南.饵料中添加芽孢杆菌对草鱼生长的影响及机理探讨[D].硕士学位论文.杭州:浙江大学,2010.
[26] 刘小刚,周洪琪,华雪铭,等.微生态制剂对异育银鲫消化酶活性的影响[J].水产学报,2002,26(5):448-452.
[27] 刘阳.地衣芽孢杆菌KL6对鲤鱼生产性能及消化酶活性的影响[D].硕士学位论文.天津:天津师范大学,2012.
[28] SUN Y Z,YANG H L,MA R L,et al.Effect of dietary administration ofPsychrobactersp.on the growth,feed utilization,digestive enzymes and immune responses of grouperEpinepheluscoioides[J].Aquaculture Nutrition,2011,17(3):e733-e740.
[29] SÖGAARD H,SUHR-JESSEN T.Microbials for feed:beyond lactic acid bacteria[J].Feed International,1990,11(1):32-34,36-38.
[30] 付天玺,魏开建,许国焕.芽孢杆菌在水产养殖中的研究和应用概况[J].水利渔业,2007,27(3):102-104.
[31] 张春晓,王玲,孙鸣,等.枯草芽孢杆菌对凡纳滨对虾生长和免疫的影响[J].饲料研究,2010(12):55-58.
[32] CHIU C H,CHENG C H,GUA W R,et al.Dietary administration of the probiotic,SaccharomycescerevisiaeP13,enhanced the growth,innate immune responses,and disease resistance of the grouper,Epinepheluscoioides[J].Fish & Shellfish Immunology,2010,29(6):1053-1059.
[33] SUN Y Z,YANG H L,MA R L,et al.Probiotic applications of two dominant gutBacillusstrains with antagonistic activity improved the growth performance and immune responses of grouperEpinepheluscoioides[J].Fish & Shellfish Immunology,2010,29(5):803-809.
[34] HARIKRISHNAN R,BALASUNDARAM C,HEO M S.Effect of probiotics enriched diet onParalichthysolivaceusinfected with lymphocystis disease virus (LCDV)[J].Fish & Shellfish Immunology,2010,29(5):868-874.
[35] GIRI S S,SUKUMARAN V,OVIYA M.Potential probioticLactobacillusplantarumVSG3 improves the growth,immunity,and disease resistance of tropical freshwater fish,Labeorohita[J].Fish & Shellfish Immunology,2013,34(2):660-666.
[36] 李桂英,宋晓玲,孙艳,等.几株肠道益生菌对凡纳滨对虾非特异免疫力和抗病力的影响[J].中国水产科学,2011,18(6):1358-1367.
[37] SALINAS I,ABELLI L,BERTONI F,et al.Monospecies and multispecies probiotic formulations produce different systemic and local immunostimulatory effects in the gilthead seabream (SparusaurataL.)[J].Fish & Shellfish Immunology,2008,25(1/2):114-123.
[38] 刘晓勇,张颖,齐茜,等.枯草芽孢杆菌对杂交鲟幼鱼生长性能、消化酶活性及非特异性免疫的影响[J].中国水产科学,2011,18(6):1315-1320.
[39] 李小梅,杨丽冬,张家学,等.一种复合益生菌对斜带石斑鱼生长及免疫特性影响研究[J].饲料工业,2015,36(2):30-33.
[40] SUN Y Z,YANG H L,MA R L,et al.Effect ofLactococcuslactisandEnterococcusfaeciumon growth performance,digestive enzymes and immune response of grouperEpinepheluscoioides[J].Aquaculture Nutrition,2012,18(3):281-289.
[41] SUN Y Z,YANG H L,HUANG K P,et al.Application of autochthonousBacillusbioencapsulated in copepod to grouperEpinepheluscoioideslarvae[J].Aquaculture,2013,392-395:44-50.
[42] 袁丰华,林黑着,李卓佳,等.凝结芽孢杆菌对尖吻鲈的生长、消化酶及非特异性免疫酶的影响[J].上海海洋大学学报,2010,19(6):792-797.
[43] 林黑着,袁丰华,李卓佳,等.光合细菌PS2对尖吻鲈的生长、消化酶及非特异性免疫酶的影响[J].南方水产,2010,6(1):25-29.
*Corresponding author, professor, E-mail: dongxiaohui2003@163.com
(责任编辑 菅景颖)
Effects of Probiotics on Growth Performance, Digestive Enzyme and Immune Enzyme Activities of Juvenile Cobia (Rachycentroncanadum)
HE Weicong1DONG Xiaohui1,2*TAN Beiping1,2YANG Qihui1CHI Shuyan1LIU Hongyu1ZHANG Shuang1
(1.LaboratoryofAquaticAnimalNutritionandFeed,FisheriesCollege,GuangdongOceanUniversity,Zhanjiang524088,China; 2.SouthChinaSeaBio-ResourceExploitationandUtilizationCollaborativeInnovationCenter,Guangzhou510006,China)
This experiment was conducted to study the effects ofBacillussubtilisandLactobacillusacidophilusas separate or mixed in diets on the growth performance, digestive enzyme and immune enzyme activities of juvenile cobia (Rachycentroncanadum). Eight hundred and forty healthy juvenile cobia with an initial body weight of (22.00±0.15) g were randomly divided into 7 groups (groups T0, T1, T2, T3, T4, T5 and T6, respectively) with 3 replicates per group and 40 fish per replicate. The group T0 was used as control group, and fish in this group were fed a basal diet for 50 days; the fish in groups T1, T2 and T3 were fed diets containing 1×107CFU/gB.subtilis, 1×107CFU/gL.acidophilusand 2×107CFU/gB.subtilisandL.acidophilusmixture (mass ratio ofB.subtilisandL.acidophilus=1∶1) for 30 days and then 20 days switched to basal diet, respectively; the fish in groups T4, T5 and T6 were fed diets containing 1×107CFU/gB.subtilis, 1×107CFU/gL.acidophilusand 2×107CFU/gB.subtilisandL.acidophilusmixture for 50 days, respectively. The results showed as follows: compared with control group, the weight gain rate (WGR) in groups T1 and T2 had no significant difference (P>0.05), but the WGR in groups T3, T4, T5 and T6 was significantly increased (P<0.05), and the group T6 had the maximum value which was significantly higher than that in other groups (P<0.05). The specific gain rate (SGR) had a similar changing trend to WGR. The feed conversion ratio (FCR) in groups T2, T3, T4, T5 and T6 was significantly lower than that in control group (P<0.05), meanwhile, the FCR in groups T4 and T6 was significantly lower than that in other probiotics supplemental groups (P<0.05). Diets with supplementation of probiotics could significantly enhance the activities of amylase and protease in liver (P<0.05), and improve the activity of protease in intestine (P<0.05). The activity of amylase in intestine in control goup, groups T3 and T4 was significantly lower than that in groups T5 and T6, and significantly higher than that in groups T1 and T2 (P<0.05). Diet with supplementation of probiotics could significantly improve the activity of serum lysozyme (LZM) (P<0.05). The serum total superoxide dismutase (T-SOD) activity in continuous feeding groups (groups T4, T5 and T6) was significantly higher than that in control group (P<0.05), and the serum T-SOD activity in group T6 was significantly higher than that in groups T4 and T5 (P<0.05). However, the serum T-SOD activity in non-continuous feeding groups (groups T1, T2 and T3) was significantly lower than that in control group except group T1 (P<0.05). Compared with the control group, the serum alkaline phosphatase (AKP) activity in probiotics supplemental groups was significantly decreased (P<0.05). The serum acid phosphatase (ACP) activity in groups T2 and T3 was significantly higher than that in control group (P<0.05), and group T6 had no significant difference with control group (P>0.05), while that in other groups was significantly lower than that in control group (P<0.05). These results indicate that supplementation ofB.subtilisandL.acidophilusas separate or mixed (1∶1, mass ratio) in diets can promote the growth, and increase the activities of immune enzymes and digestive enzymes of juvenile cobia. Continuous feeding is better than non-continuous feeding and the mixed probiotics has the best effect.[ChineseJournalofAnimalNutrition, 2015, 27(12):3821-3830]
cobia (Rachycentroncanadum); probiotic; growth performance; immune enzyme; digestive enzyme
10.3969/j.issn.1006-267x.2015.12.022
2015-06-24
广东省科技攻关项目(2012B020307005);广东省教育厅科技攻关项目(2013KJCX0096);广东省基金项目(S2013010014729)
何伟聪(1989—),男,广东河源人,硕士研究生,研究方向为水产动物营养与饲料。E-mail: gerryhe1988@163.com
*通信作者:董晓慧,教授,硕士生导师,E-mail: dongxiaohui2003@163.com
S963
A
1006-267X(2015)12-3821-10

