奈达铂联合紫杉醇同步三维适形放疗治疗进展期食管癌的临床观察
路逵 柯军 成国建
奈达铂联合紫杉醇同步三维适形放疗治疗进展期食管癌的临床观察
路逵 柯军 成国建
目的 探讨奈达铂联合紫杉醇同步三维适形放疗治疗进展期食管癌的疗效及毒性。方.36例进展期食管癌患者, 随机分为奈达铂联合紫杉醇同步放化疗组(TP组)18例和顺铂联合氟尿嘧啶同步放化疗组(DF组)18例, 两组放疗均采用三维适形放疗, 常规分割, 照射剂量60~66 Gy。对比两组临床疗效.1年生存率及不良反应。结果 TP组完全缓解8例, 部分缓解8例, 有效率88.9%;DF组完全缓解4例,部分缓解6例, 有效率55.6%, 两组比较差异有统计学意义(P<0.05)。TP组Ⅱ度以上白细胞下降占55.6%,明显高于DF组的16.7%(P<0.05), TP组Ⅲ度血小板下降2例, DF组无Ⅲ度血小板下降病例。两组Ⅱ~Ⅲ度放射性食管炎发生率比较差异无统计学意义(37.5% V.32.0%, P>0.05)。结论 奈达铂联合紫杉醇同步三维适形放疗治疗进展期食管癌近期疗效较好, 骨髓抑制加重但可耐受。
进展期食管癌;放射治疗;奈达铂
多数食管癌患者一经诊断即为进展期, 失去手术机会,予以姑息性放疗及化疗, 目前NCCN指南已将同步放化疗作为进展期食管癌的治疗规范。顺铂联合氟尿嘧啶 ( DF 方案 )是食管癌同步放化疗的标准方案。但多数患者疗效并不理想,为提高进展期食管癌患者治疗的疗效和耐受性.2008年1月~2010年12月本院治疗进展期食管癌36例, 采用奈达铂联合紫杉醇同步三维适形放疗18例, 与同期顺铂联合氟尿嘧啶同步放疗18例相比, 现报告如下。
1 资料与方法
1.1 一般资料 入组标准:36例食管癌患者, 经食管镜检查组织学病理都为鳞状细胞癌, 均行同步放化疗, 随机分为两组, 奈达铂联合紫杉醇(TP)组18例:男13例, 女5例,中位年龄61岁;其中T3N0M0 6例, T3N1M.5例, T4N0M.4例, T4N1M.3例。顺铂联合氟尿嘧啶(DF)组18例:男12例, 女6例, 中位年龄62岁, T3N0M0 7例, T3N1M.5例, T4N0M.5例, T4N1M.1例。36例患者均KPS评分≥80分,心肺功能基本正常, 能进半流质饮食, 无声带麻痹, 无胸腔积液, 治疗前血常规、肝肾功能正常;均为初次治疗。两组患者一般资料比较差异无统计学意义(P>0.05), 具有可比性。
1.2 治疗方法
1.2.1 定位 患者取仰卧位, 以真空负压袋固定体位, 激光定位系统确定标记点并标记于皮肤平坦处, 以减少摆位误差并以此作为计划的坐标参考点。16排CT强化扫描, 层厚5 mm。扫描范围:环甲膜至肾上极。定位结束后将CT图像数据通过网络传输至ADAC Pinnacle3 TPS计划系统中, 进行三维重建。
1.2.2 靶区勾画 大体肿瘤体积( gross tumor volume, GTV)包括食管原发肿瘤和CT可见最短径≥10 mm的区域肿大淋巴结。 T1~2患者的临床靶区( clinical target volume, CTV)在GTV基础上外放5 mm, T3~4患者的CTV在GTV基础上外放
7 mm, 并预防照射食管旁、2 区、4区、5 区、7 区的淋巴引
流区;计划靶区(planning target volume, PTV)将CTV边界外扩适当的范围获得: CTV边界头脚方向外放40 mm, 其余方向外放5 mm作为PTV, 区域淋巴结GTV边界外扩10 mm作为PTV。将肺、心脏、气管和脊髓作为危及器官(organ at risk, OAR)分别勾画。
1.2.3 放射治疗 利用ADAC Pinnacle3 TPS计划系统制定计划。全部患者均选用直线加速器6MV X线照射。95%的PTV作为处方剂量.2.0 Gy/次.5次/周, DT 60~66 Gy。
1.2.4 化学治疗 两组患者均于放疗第1天开始行第1周期化疗, TP组化疗方案 :紫杉醇150 mg/m2于第1天静脉滴注,用药前常规预处理 , 即用药前12 h 、 6 h 分别口服地塞米松片10 mg, 用药前30 min静脉滴注西咪替丁300 mg, 肌内注射苯海拉明25 mg, 防止过敏反应, 奈达铂(奥先达, 江苏奥赛康公司生产)80 mg/m2, 加入0.9%氯化钠注射.500 ml 中第2天缓慢静脉滴注。每4周为1个周期, 放疗期间完成2周期。DF组化疗方案:顺铂20 mg/m2+5-F.500 mg/m2第1~3天, 每4 周为1个周期, 放疗期间完成2周期。治疗期间定期监测血象、肝肾功能及心电图等, 必要时给予G-CSF及相关对症支持治疗。化疗前给予5-羟色胺受体拮抗剂预防呕吐。治疗期间所有患者常规监测血常规1次/周, 中性粒细胞<1.5×109/L、血小板<50×109/L者注射粒细胞刺激因子、白介素-11(距奈达铂使用前、结束后至少24 h)。出现Ⅱ度及以上血小板减少症、Ⅱ度以上粒细胞减少症患者停用化疗;对于Ⅱ度及以上放射性食管炎进食疼痛患者, 给予对症输液支持治疗。
1.3 近期疗效和毒副反应评价 所有患者在同步放化疗后3个月进行近期疗效评价。以体检及B超、CT、食道钡餐等结果按WHO实体瘤疗效评价标准评定。完全缓解(CR):肿块全部消失, 食管黏膜基本正常;部分缓解(PR):肿块缩.50%以上;无变化(NC):病变无增大, 无明显好转;进展(PD):病灶扩大或出现远处转移。CR+PR 为有效。不良反应按WHO 抗癌药物毒性反应标准进行评价, 放疗不良反应按RTOG标准进行评价。观察两组患者1年生存率。
1.4 统计学方法 采用SPSS13.0软件进行统计分析。计数资料以率(%)表示, 采用χ2检验。P<0.05表示差异具有统计学意义。
2 结果
2.1 放疗完成情况 TP组:1例患者DT30 Gy/15次时出现Ⅲ度放射性食管炎, 经对症治疗, 效果不显, 放弃同步化疗。1例DT36 Gy/18次时出现Ⅲ度血小板减少症停止同步化疗.3例出现Ⅱ度粒细胞减少症致使放疗疗程延.3~7 d, 余16例均顺利完成放疗。DF组:1例患者分别在照射至36 Gy/18次时放弃治疗, 另3例因胃肠道反应终止第2次化疗.2例放疗疗程延长时间为3~4 d。
2.2 近期疗效 TP组有效率明显高于DF组, 差异有统计学意义(χ2=8.38, P<0.05)。见表1。
2.3 不良反应 TP组Ⅱ度以上白细胞下降10例(55.6%), DF组有2例(16.7%), 两组差异有统计学意义(χ2=8.00, P<0.05)。TP组Ⅱ~Ⅲ度血小板下降7例, DF组无Ⅱ度血小板下降。TP组和DF组肝肾功能损伤及Ⅱ~Ⅲ度放射性食管炎发生率比较差异无统计学意义(P>0.05)。见表2。

表1 两组近期疗效比较(n, %)
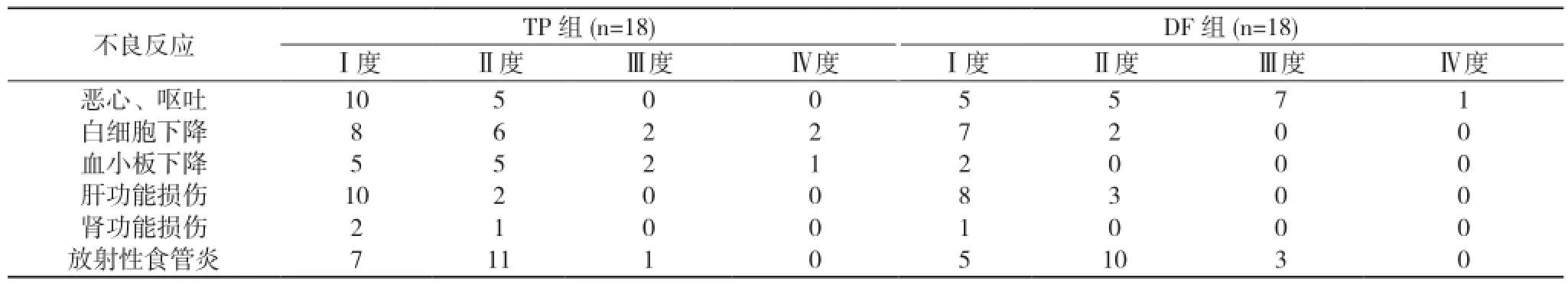
表2 两组急性不良反应比较(n)
2.4 1年生存率 随访至2011年12月, TP组1年生存率为44.4%(8/18), DF组为27.8%(5/18)。
3 讨论
进展期食管癌单纯手术或放疗预后差, 局部复发或未控为治疗失败主要原因, 其次为淋巴结及远处转移。食管癌单纯放.5 年生存率多.10%左右[1]。文献[2]报道同步放化疗可提高局部控制率及远期生存率, 可达到高的无瘤生存率(DFS),目前已被NCCN指南推荐为局部进展期食管癌的标准治疗手段。顺铂联合氟尿嘧啶是食管癌同步放化疗的基本化疗方案。但由于顺铂具有消化道、肾毒性等不良反应, 多数患者不能耐受, 本研究中的DF组亦有4例未完成原定计划。
目前多采用紫杉醇联合铂类的方案, 紫杉醇是红豆杉属植物中的一种复杂的次生代谢产物, 可以促进微管聚合和稳定已聚合微管。奈达铂作为第二代铂类抗肿瘤制剂, 进入肿瘤细胞后, 甘醇酸脂基上醇性氧与铂之间的键断裂, 水与铂结合, 导致离子型物质(活性物质或水合物)的形成。然后,断裂的甘醇酸脂基配基变得不稳定并被释放, 产生多种离子型物质, 与核苷反应生成核苷-铂结合物, 并与DNA结合,抑制DNA复制[3]。抗癌作用机制与顺铂类似, 但其溶出浓度约是 DDP的10倍。Inaba等[4]研究认为, 奈达铂治疗食管癌比顺铂更有效, 而且胃肠道毒性更低[5]。徐瑞华等[6]进行的奈达铂的Ⅱ期临床研究显示联合5-Fu治疗食管癌的有效率为32.1%, 优于DDP联合5-Fu, 两者比较差异有统计学意义(P<0.05)。
奈达铂使用时无需水化, 其主要不良反应为骨髓抑制,白细胞及血小板下降明显增多, 但Ⅲ度白细胞及血小板下降并不多见, 无Ⅳ度白细胞及血小板下降, 且血液毒性反应均为一过性, 经粒细胞刺激因子及血小板生成素治疗后得到恢复, 患者能够耐受。而且消化道反应及肾毒性较低, 患者治疗的依从性较高, 耐受性好, 对其生活质量影响不大, 在化疗的同时, 可提高放疗敏感性[7,8]。国外Ⅱ期临床试验研究报道其过敏反应发生率约0.1%~5.0%[9]。国内亦有文献报道使用奈达铂后发生过敏反应[10], 建议在使用前给予地塞米松5 mg静脉推注, 以防过敏。
在制定放射治疗计划时, 一般选择三野(一前、两后斜),这样既使食管肿瘤靶区有较满意的剂量分布, 又使肺、脊髓等剂量降低, 减少放射性脊髓损伤及肺损伤的发生, 更重要的是降低了纵隔照射的剂量, 三维适形放疗由于靶区更精确,减少了对食管周围大血管的照射, 使血液学毒性减轻, 保证了同步放化疗的实施。本项目观察结果显示, 奈达铂联合紫杉醇同步放疗其总有效率及1年生存率比顺铂联合氟尿嘧啶高, 虽然血液学毒性较后者严重, 但消化道毒性及肾功能损害均较后者轻, 说明奈达铂联合紫杉醇治疗食管癌疗效确切,不良反应轻, 值得临床推广应用。
[1] 殷蔚伯, 余子豪, 徐国镇, 等.肿瘤放射治疗学.第4版.北京:中国协和医科大学出版社.2008:555-556.
[2] Yamashita H, Okuma K, Seto Y. A retrospective comparison of clinical outcomes and quality of life measures between definitive chemoradiation alone and radical surgery for clinical stageⅡ~Ⅲesophageal carcinoma. J Surg Oncol.2009.100(6):435-441.
[3] Desoize Badoulet C. Particular aspects of platinum compounds used at present in cancer tretrnent. Crit Rev Oned Hematol.2002.42(3):317-325.
[4] Inaba H, Tsuda T, Miyazaki A, et al. Clinical study of the combination of small amount of nedaplatin(CDGP)/5-Fu with radiation for the treatment of esophageal cancer. Nippon Shokakibyo GakkaiZasshi.2002, 99(10):1191-1196.
[5] Hirata S, Yatsuyanagi E, Yamazaki H, et al. Neoadjuvant chemotherapy for esophageal cancer by administration of nedaplatin alone. Gan To Kagaku Ryoho.2000.27(2):221-226.
[6] 徐瑞华, 史艳侠, 管忠震, 等. 国产奈达铂治疗食管癌的Ⅱ期临床试验报告.癌症.2006.25(12):1565-1568.
[7] Kato H, Fukuchi M, Manda R, et al. Efficacy and toxicity of nedaplatin an.5 FU with radiation treatment for advanced esophageal carcinomas. Anticancer Res.2003.23(4):3493-3498.
[8] Hartmann JT, Lipp HP. Toxicity of platinum Compounds. Expert Opin pharmacother.2003.4(6):889-901.
[9] Kamoto T, Fukada, Ando T, et al. Evaluation of a combinationchemotherapy with nedaplatin an.5 Fu for oral cancer. Gan To Kagknryoho.1996(23):379-383.
[10] 袁小凤.奈达铂注射液致过敏反应2例.中华医学实践杂志.2006(4):449-450.
10.14163/j.cnki.11-5547/r.2015.01.088
2014-09-17]
225599 泰州市第二人民医院肿瘤科(路逵 柯军);南通市肿瘤医院放疗科(成国建)

