金带细鱼肉蛋白酶解物水解度与其抗氧化性和功能特性间的相互关系
卢 彬,王忠合,傅 力,王 军,邹 敏
(1.新疆农业大学食品科学与药学学院,新疆乌鲁木齐 830052;2.韩山师范学院生物系,广东潮州 521041)

卢 彬1,王忠合2,*,傅 力2,王 军2,邹 敏1
(1.新疆农业大学食品科学与药学学院,新疆乌鲁木齐 830052;2.韩山师范学院生物系,广东潮州 521041)
采用胰蛋白酶水解金带细鲹鱼肉蛋白制备不同水解度(10.8%、14.9%、19.0%和21.7%)的酶解产物,研究水解度与酶解产物抗氧化性和功能特性的关系。抗氧化性分析表明,低水解度处理显著增大了酶解物清除羟基自由基的能力、清除DPPH自由基的能力和螯合亚铁离子的能力(p<0.05),而高水解度处理则增强了酶解产物的金属还原力(p<0.05)。功能特性结果表明:随着水解度的增大,酶解产物的溶解度逐渐增大,而乳化活性和乳化稳定性逐渐降低,起泡性和泡沫稳定性也降低。同时,随着pH的增加,酶解物的溶解性和乳化稳定性呈先下降后上升的趋势,而起泡性和泡沫稳定性则随着pH的增加而降低。上述分析表明,适当的酶解处理对改善金带细鲹鱼肉蛋白的功能特性及抗氧化活性具有一定的作用。
金带细鲹,蛋白水解物,水解度,功能特性,抗氧化性
蛋白质的功能特性,包括溶解性、乳化性、起泡性等,直接影响加工食品的品质,但是天然蛋白的功能特性无法满足食品工业的需求,因而常采用酶解法进行修饰改性。研究表明,酶水解蛋白不仅可以改善蛋白质的功能特性,如增大溶解性、提高热稳定性、增强乳化性或起泡性等,而且还可以改善其营养价值和生物活性[1-4]。另一方面,还可采用酶解蛋白制备生物活性肽,Ahn等[5]通过采用不同蛋白酶水解鲑鱼加工副产物获得具有较强抗氧化性的多肽。Eckert等[6]研究发现大麦蛋白酶解物可促进Ca2+等金属离子的溶解性,并提高这些矿物质的生物利用率。酶法水解蛋白的过程中,提高其功能特性和制备生物活性肽的关键是要控制水解度,一定程度的酶解可改变分子的大小和构象,从而增强其功能性,但是水解度过高则会对产物产生不利的影响,甚至丧失功能性,因而深入探讨水解度与酶解产物特性的关系至关重要。
低值鱼和小杂鱼在海洋捕捞产量中历年占有较大的比重,但主要用于生产一些低附加值产品,甚至作为废物直接丢弃,不仅导致资源浪费,而且还造成海洋或陆地环境的污染。利用酶水解低值鱼类及水产副产品来改善其功能特性及生物活性,获得一系列高附加值的产品,是低值鱼类深度开发利用的重要方向[7-9]。金带细鲹(Selaroidesleptolepis)为鲹科细鲹属的鱼类,俗名木叶鲹,是一种未充分利用的低价鱼,相关的研究报道较少。本文采用胰蛋白酶水解金带细鲹鱼肉蛋白,研究酶解物水解度与其抗氧化活性和功能特性的关系,旨在为金带细鲹的高值化利用提供一定的理论依据。
1 材料与方法
1.1 材料与仪器
材料:金带细鲹购于当地市场,去除鱼头和内脏,洗净沥干后用搅碎机搅成肉糜,用保鲜袋分装(每袋100g)后,贮存于-20℃冰箱备用。大豆色拉油,购于当地市场。
试剂:菲洛嗪(ferrozine,3-(2-吡啶基)-5,6-二苯基-1,2,4-三嗪-4′,4″-二磺酸一钠盐);1,1-二苯基-2-三硝基苯肼(DPPH);2,4,6-三硝基苯磺酸(TNBS) 购于美国sigma公司;胰蛋白酶(3000~3500NFU/mg) 生工生物工程(上海)有限公司;其他试剂均为国产分析纯。
UV-2800型紫外可见分光光度计 尤尼科(上海)仪器有限公司;FD-1D-50冷冻干燥机 北京博医康实验仪器有限公司;2-16P离心机 美国Sigma有限公司;IKA T18 basic高速分散器 德国ULTRA TURRAX公司;PHSJ-4A型pH计 上海仪电科学仪器股份有限公司;B056028型电子恒温水浴锅 国华(深圳)仪器。
1.2 实验方法
1.2.1 金带细鲹鱼肉蛋白酶解工艺 取鱼糜按质量比1∶3的比例与水混合均质后,调节溶液pH和温度至胰蛋白酶的最适条件(pH为7.0,温度为50℃),加入1%的胰蛋白酶(E/S=1∶100)酶解不同时间后取样,在100℃灭酶10min,将酶解液在10000r/min下离心10min,取上清液冷冻干燥,备用。
1.2.2 TNBS测定法水解度(DH) 取样液125μL,加入2.0mL 0.2125mol/L的磷酸盐缓冲液(pH 8.2)和1.0mL 0.01%的TNBS溶液,混匀,置于50℃水浴中暗处反应30min。反应后加入2.0mL 0.1mol/L的亚硫酸钠终止反应,室温下冷却15min,于420nm处测定吸光度A2。以同样条件下测定未水解样品的吸光度A1。将鱼肉用一定量的6mol/L HCl在120℃下完全水解24h后测定游离氨基的总吸光度Amax。以L-亮氨酸为标样绘制标准曲线,分别求得氨基的含量,按照下式[10]计算水解度DH:
式中:Lmax、L2、L1分别为总游离氨基酸含量、水解前和水解后样液中游离氨基酸含量。
1.2.3 功能特性测定
1.2.3.1 溶解性测定 采用氮溶解指数(Nitrogen Solubility Index,NSI)来评价蛋白质的溶解性,取0.2g样品与20mL去离子水混合,用1mol/L HCl或1mol/L NaOH溶液调节pH为3~9,回旋振荡0.5h后,6000r/min离心30min,采用微量凯氏定氮法[11]测定样品和上清液中蛋白质的含量。按照下式计算氮溶指数NSI。
式中:A、B分别为上清液和水解样品中蛋白的含量。
1.2.3.2 乳化性测定 取3mL 1%样品溶液,用1mol/L HCl或1mol/L NaOH溶液调节溶液pH为3、5、6、7、9。加入1mL大豆色拉油,高速分散器(15600r/min)中均质1min,立即于容器底部取样50μL,与5.0mL 0.1%SDS溶液混匀,在波长500nm处测定吸光度,以0.1% SDS溶液作空白。室温放置10min后再取样测定,分别按照下式[12]计算乳化活性(Emulsifying Activity Index,EAI)和乳化稳定性(Emulsion Stability Index,ESI):
式中:A0为初始乳化液的吸光度;A10为10min后的吸光度;m为蛋白质量,g。
1.2.3.3 起泡性测定 取20mL 0.5%样品分别调整pH为3、5、6、7、9,然后用高速分散器(15600r/min)均质2min,分别测定均质操作停止时泡沫体积和液体体积之和V0以及分散操作停止10min后的泡沫和液体总体积V1。分别按照下式[7]计算起泡性(Foaming Capacity,FC)和泡沫稳定性(Foaming Stability,FS):
1.2.4 抗氧化性测定
1.2.4.1 亚铁离子螯合力的测定 分别取不同浓度(2、3、4、5、6mg/mL)的样品溶液各1mL,加入1.85mL去离子水和0.05mL 2mmol/L的FeCl2溶液,混合均匀,再加入0.1mL 5mmol/L的菲洛嗪溶液,室温下静置10min,3000r/min离心5min后于562nm处测定其吸光度As;以1mL去离子水代替样液,其余操作同上,测定其在562nm处的吸光度值Ab,按照下式[13]计算螯合力:

1.2.4.2 清除DPPH自由基能力的测定 称取一定量的DPPH,用无水乙醇配制成0.15mmol/L的DPPH溶液。分别取2mL不同浓度(1.5、2.0、2.5、3.0、3.5mg/mL)的样品溶液,加入2mL DPPH溶液,混合均匀,室温放置30min后,5000r/min离心10min。取上清液于517nm处测定吸光度。样品对DPPH自由基的清除率用下式[13]计算:
式中:A0为对照溶液吸光度值;A1为样品溶液吸光度值;A2为样品溶液本底吸光度值。
1.2.4.3 羟自由基清除能力的测定 分别取不同浓度(1.5、2.0、2.5、3.0、3.5mg/mL)的样品溶液1mL,加入0.25mL 9mmol/L FeSO4和0.25mL 9mmol/L水杨酸-乙醇溶液,然后加入1.5mL pH 7.4的磷酸盐缓冲液。最后加1mL H2O2启动反应,在37℃反应30min,以蒸馏水为参比,510nm下测定各样液的吸光度。按下式[14]计算羟自由基清除率:
式中:A0为对照溶液吸光度值;A1为样品溶液吸光度值;A2为样品溶液本底的吸光度。
1.2.4.4 总还原力的测定 在10mL离心管中分别加入0.2mol/L pH6.6的磷酸盐缓冲液2mL和不同浓度(4、6、8、10、12mg/mL)的溶液2mL,加入2mL 1%铁氰化钾,混合均匀后于50℃反应20min。取出后加入2mL 10%三氯乙酸终止反应,5000r/min离心10min。取上清液2mL,加入2mL蒸馏水和0.5mL FeCl3,混匀后静置10min,在700nm处检测吸光度[15]。
1.3 数据分析
实验重复测定3次,结果表示为平均值±标准偏差(SD)。数据统计分析采用SPSS 19.0软件进行一维方差分析(one-way ANOVA),差异显著性采用Duncan(邓肯)检验,检验水平p<0.05。
2 结果与讨论
2.1 组分分析及水解度测定
金带细鲹鱼肉中粗蛋白的含量较高,占干物质总量的68.4%±0.75%,是蛋白质的良好来源,可作为制备蛋白酶解物和多肽的良好原料,是一种非常值得开发利用的优质蛋白质资源。文中分别采用胰蛋白酶在最适pH 7.0和最适温度50℃下分别水解0.5、1.5、2.8、8.0h后测定水解度分别为10.8%、14.9%、19.0%、21.7%。
2.2 水解度对酶解物功能特性的影响
2.2.1 水解度与pH对酶解物溶解性的影响 溶解性是蛋白质主要的功能特性之一,也是蛋白质生理功能特性及其他加工功能特性的前提和基础,图1表示了不同水解度的酶解物在pH3~9的范围内的变化曲线。在整个pH变化范围内,溶解性曲线呈先下降后上升的趋势,并且随着水解度的增大,样品的溶解性也增大,水解度为21.7%的样品NSI值最高达到了88.6%。这可能是蛋白质在水解过程中断裂成小分子肽和氨基酸,这些小分子肽含有较多的极性基团,能与水形成氢键,从而增加了溶解性[16]。pH显著影响酶解物的溶解性(p<0.05),特别是当水解度较低时的样品的溶解性受pH的影响较大。同时,酶解物的溶解性在pH为4时达到最低,这是因为在等电点附近时,蛋白质或肽类分子以两性离子形式存在,其分子净电荷为零(即正负电荷相等),此时分子颗粒在溶液中因没有相同电荷的相互排斥,分子相互之间的作用力减弱,其颗粒极易碰撞、凝聚而产生沉淀,所以在等电点时,其溶解度最小,最易形成沉淀物[17]。
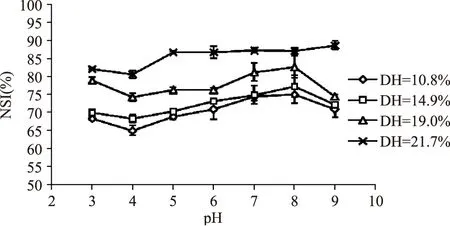
图1 水解度对酶解物溶解性的影响Fig.1 Effect of degree of hydrolysis on solubility of hydrolysates
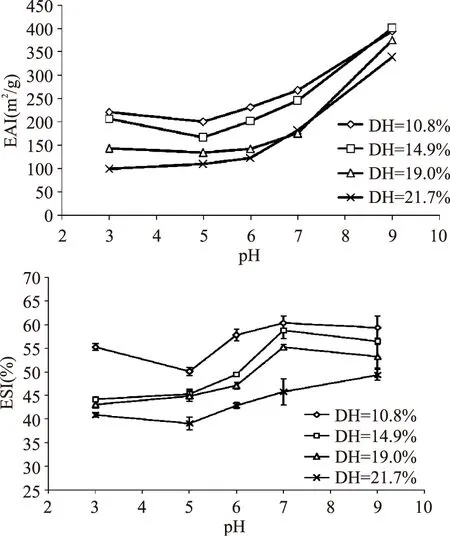
图2 不同水解度的酶解物的乳化活性(A)和乳化稳定性(B)Fig.2 Effect of degree of hydrolysis on emulsifying activity index(A)and emulsion stability index(B)of hydrolysates
2.2.2 乳化活性及乳化稳定性 由图2可知,随着水解度的增大,酶解物的乳化活性和乳化稳定性呈现逐渐降低的趋势,这主要是因为蛋白质经轻度水解后,蛋白质的结构发生变化,原来包裹在蛋白质分子中的疏水基团暴露出来,蛋白质在油/水界面和吸附的能力增强,界面张力降低,增强了蛋白质的乳化能力,但是当水解程度过大时,蛋白质分子被水解的程度大,形成的小分子肽和氨基酸增多,而小分子肽链和氨基酸降低表面张力的效率很低,不能像大分子肽那样能在油-水界面展开,亲水/亲油性不足以体现较好的乳化性。
在整个pH变化范围内,酶解物乳化活性呈现先下降后上升的趋势,在pH为9时,乳化活性和乳化稳定性达到最高值,在pH为3~5处于酶解物的等电点附近,乳化活性和乳化稳定性均达到最低,这可能是因为在等电点处酶解物溶解性低,表面静电荷为零,影响了肽到达油-水界面的速度,肽的吸附、扩散能力减弱,从而影响乳化活性和乳化稳定性[12]。
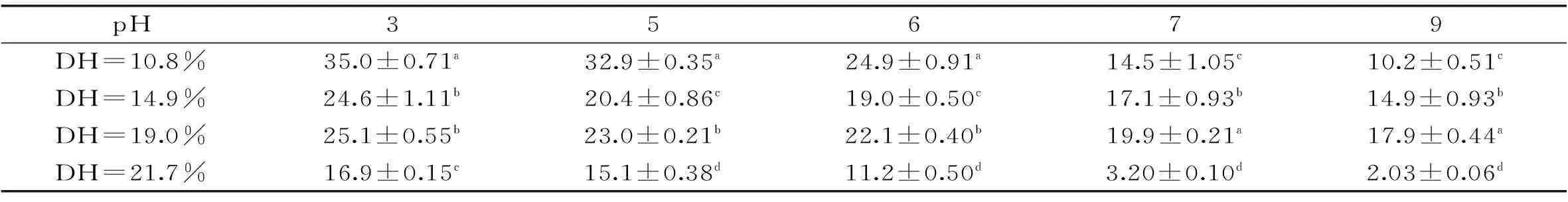
表1 水解度对酶解物起泡性的影响
注:表中数据以平均值±标准偏差表示;同一列中标记不同小写字母表示差异显著,p<0.05,表2同。

表2 水解度对酶解物泡沫稳定性(%)的影响
2.2.3 起泡性及泡沫稳定性 由表1和表2可知,在相同的pH下,不同水解度样品的起泡性和泡沫稳定性差异显著(p<0.05)。随着pH的逐渐增大,各个水解度样品的起泡性和泡沫稳定性逐渐减弱,这说明水解度和pH是影响酶解物起泡性和泡沫稳定性的主要因素。适度的水解处理有利于疏水基团的暴露和多肽链的交联,可形成足够强度的黏层,使泡沫的稳定性增加。但进一步的水解会降低泡沫稳定性,这是由于小分子肽没有能力控制泡沫的稳定性[1,10]。同时,在较高的pH下可能由于肽类通过离子排斥的斥力降低了泡沫稳定性,因而不同水解度的样品在不同pH下的泡沫稳定性变化无明显规律。
2.3 水解度对抗氧化活性的影响
2.3.1 亚铁离子螯合力 金属离子如亚铁离子和铜离子能够参与人体内许多氧化反应,通过催化各种活性氧产生自由基,如羟自由基和超氧阴离子自由基等,尤其是亚铁离子通过Fenton反应生成羟自由基,从而加速脂质过氧化链式反应。此外,亚铁离子还能催化分解脂质过氧化物,导致反应生成烷氧自由基和挥发性氧化产物[18]。因此,金属离子的螯合作用往往有助于减少脂质氧化。不同水解度的酶解物对亚铁离子的螯合能力如图3所示。
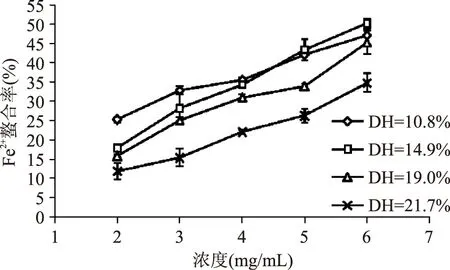
图3 水解度对酶解物螯合Fe2+能力的影响Fig.3 Influence of degree of hydrolysis on Fe2+-chelating ability of hydrolysates
由图3可知,酶解物螯合Fe2+的能力随着浓度的升高而增强(p<0.05),这是因为酶解物浓度越高,就有越多的氨基和羧基螯合Fe2+。而水解度对其螯合Fe2+的能力有不利的影响,较低水解度的样品表现出较强的Fe2+螯合力,水解度为14.9%的样品Fe2+螯合率最高达到50.2%±1.20%。水解度为10.8%、14.9%和19.0%的样品,螯合Fe2+能力显著大于水解度为21.7%样品螯合Fe2+能力,且不同水解度的样品间螯合Fe2+能力差异显著(p<0.05)。酸性或碱性氨基酸残基对酶解物的螯合力影响至关重要,主要是由于这些氨基酸的羧基和氨基参与了螯合金属离子,所以随着水解度的增加,酶解产物中游离的具有Fe2+螯合能力的氨基酸含量增加,与亚铁离子配位,从而减少了游离态的亚铁离子的含量[6]。具体的螯合机理和螯合部位还有待进一步的研究。
2.3.2 DPPH自由基清除能力 由图4可知,酶解物对DPPH自由基的清除率随着浓度的升高而增强(p<0.05),水解度为10.8%的样品在浓度为3.5mg/mL时表现出了最强的清除能力(p<0.05),达到了61.2%±0.62%。但是随着水解度的增大,酶解物清除DPPH自由基的能力不断减弱,而在相同浓度下水解度分别为14.9%、19.0%和21.7%的样品清除DPPH自由基的能力无显著差异(p>0.05)。从实验的结果来看,金带细鲹鱼肉酶解物能作为良好的电子供体,与自由基反应终止对人体造成伤害的自由基链式反应。

图4 水解度对酶解物清除DPPH自由基能力的影响Fig.4 Influence of degree of hydrolysis on DPPH radical-scavenging ability of hydrolysates
2.3.3 羟自由基清除能力 在主要的活性氧自由基中,羟基的反应活性是最强的,几乎能与细胞内的所有物质发生反应,对细胞造成巨大的生物损伤。针对人体的各种疾病,去除羟自由基是最有效的防御机制之一。不同水解度的酶解物对羟自由基的清除能力如图5所示。

图5 水解度对酶解物清除羟自由基的影响Fig.5 Influence of degree of hydrolysis on hydroxyl radical-scavenging activity of hydrolysates
由图5可知,不同水解度的酶解物具有较强的清除羟自由基的活性,并且随着浓度的升高而增强(p<0.05),水解度为10.8%的样品在浓度为3.5mg/mL表现出了最强的清除能力(p<0.05),清除率达到了62.9%±0.26%,这是因为具有抗氧化作用的活性肽段酶解后不断的暴露出来,抗氧化作用增强。但是随着水解度增加其清除率逐渐减弱,这可能是由于随着水解度的增大活性肽被进一步水解,抗氧化作用逐渐减弱[7,14]。
2.3.4 还原力 还原力的测定通常被用来评价天然抗氧化剂的供电子或氢的能力,样品如果具有较高的还原能力则说明具有较强的供电子或氢的能力[15]。由图6可知,不同水解度的酶解物都具有一定的供电子或氢的能力,并且随着浓度的增大样品的还原力也增加。水解度为21.7%的样品在浓度为12.0mg/mL时表现出了较强的还原能力(p<0.05),吸光度为0.54±0.04。同时,随着水解度的增加,酶解物的还原力呈现增大的趋势,这表明在适当的水解度下,可能有较多的活性氨基酸或肽类被释放,具有较强的供氢或供电子的能力。

图6 水解度对酶解物还原力的影响Fig.6 Influence of degree of hydrolysis on reducing power of hydrolysates
3 结论
金带细鲹鱼肉酶解物的功能特性及抗氧化活性,受到水解度、pH和溶液浓度等因素的影响。具体结果如下:
随着水解度的增大,样品的溶解性增大,而酶解物的乳化活性和乳化稳定性逐渐降低,起泡性和泡沫稳定性也在降低,水解度为10.8%样品的起泡性显著高于其他水解度样品的起泡性(p<0.05)。
在整个实验pH范围内,酶解物的溶解性和乳化稳定性呈先下降后上升的趋势,且在等电点附近酶解物的溶解性和乳化稳定性均达到最低。酶解物的乳化活性随着pH的增加逐渐增大,而起泡性和泡沫稳定性则降低。
酶解物的抗氧化性随着溶液浓度的增大而变强,且水解度对其抗氧化性的影响差异较大。水解度为10.8%的酶解物对DPPH自由基和羟自由基的清除率最好,分别达到了61.2%±0.62%和62.9%±0.26%。而水解度为14.9%的酶解物螯合亚铁离子能力最高,达到了50.2%±1.20%。水解度为21.7%的酶解物表现出最强的还原能力。
[1]Kristinsson H G,Rasco BA. Fish protein hydrolysates:production,biochemical,and functional properties[J]. Critical Reviews in Food Science and Nutrition,2000,40(1):43-81.
[2]Miedzianka J,Pęksa A,Pokora M,et al. Improving the properties of fodder potato protein concentrate by enzymatic hydrolysis[J]. Food Chemistry,2014,159(9):512-518.
[3]Pacheco-Aguilar R,Mazorra-Manzano MA,Ramírez-Suárez JC. Functional properties of fish protein hydrolysates from Pacific whiting(Merlucciusproductus)muscle produced by a commercial protease[J]. Food Chemistry,2008,109(4):782-789.
[4]Je J-Y,Park P-J,Kim S-K. Antioxidant activity of a peptide isolated from Alaska pollack(Theragrachalcogramma)frame protein hydrolysate[J]. Food Research International,2005,38(1):45-50.
[5]Ahn C-B,Kim J-G,Je J-Y. Purification and antioxidant properties of octapeptide from salmon byproduct protein hydrolysate by gastrointestinal digestion[J]. Food Chemistry,2014,147(3):78-83.
[6]Eckert E,Bamdad F,Chen L. Metal solubility enhancing peptides derived from barley protein[J]. Food Chemistry,2014,159(9):498-506.
[7]Thiansilakul Y,Benjakul S,Shahidi F. Compositions,functional properties and antioxidative activity of proteinhydrolysates prepared from round scad(Decapterusmaruadsi)[J].Food Chemistry,2007,103(4):1385-1394.
[8]Jiang H,Tong T,Sun J,et al. Purification and characterization of antioxidative peptides from round scad(Decapterusmaruadsi)muscle protein hydrolysate[J]. Food Chemistry,2014,154(7):158-163.
[9]陈彦,王明蓉,沈洁.低值鱼蛋白的酸酶复合水解工艺研究[J].食品科学,2006,27(8):200-204.
[10]Jamdar S,Rajalakshmi V,Pednekar M,et al. Influence of degree of hydrolysis on functional properties,antioxidant activity and ACE inhibitory activity of peanut protein hydrolysate[J]. Food Chemistry,2010,121(1):178-184.
[11]黄晓钰,刘邻渭主编.食品化学综合实验[M].北京:中国农业大学出版社,2002.
[12]Liu Q,Kong B,Xiong YL,et al. Antioxidant activity and functional properties of porcine plasma protein hydrolysate as influenced by the degree of hydrolysis[J]. Food Chemistry,2010,118(2):403-410.
[13]Sabeena Farvin K,Andersen LL,Nielsen HH,et al. Antioxidant activity of Cod(Gadusmorhua)protein hydrolysates:Invitroassays and evaluation in 5% fish oil-in-water emulsion[J].Food Chemistry,2014,149(4):326-334.
[14]Je J-Y,Lee K-H,Lee MH,et al. Antioxidant and antihypertensive protein hydrolysates produced from tuna liver by enzymatic hydrolysis[J]. Food Research International,2009,42(9):1266-1272.
[15]He R,Ju X,Yuan J,et al. Antioxidant activities of rapeseed peptides produced by solid state fermentation[J]. Food Research International,2012,49(1):432-438.
[16]Intarasirisawat R,Benjakul S,Visessanguan W,et al. Antioxidative and functional properties of protein hydrolysate from defatted skipjack(Katsuwonouspelamis)roe[J]. Food Chemistry,2012,135(4):3039-3048.
[17]Liu Y,Li X,Chen Z,et al. Characterization of structural and functional properties of fish protein hydrolysates from surimi processing by-products[J]. Food Chemistry,2014,151(5):459-465.
[18]Moon J-K,Shibamoto T. Antioxidant assays for plant and food components[J]. Journal of Agricultural and Food Chemistry,2009,57(5):1655-1666.
Correlation between degree of hydrolysis and antioxidative activity or functional properties of Yellow Stripe Trevally meat protein hydrolysates
LU Bin1,WANG Zhong-he2,*,FU Li2,WANG Jun2,ZOU Min1
(1.College of Food Science and Pharmaceutical Sciences,Xinjiang Agricultural University,Urumqi 830052,China;2.Department of Biology,Hanshan Normal University,Chaozhou 521041,China)
Antioxidative activity and functional properties of hydrolysates from Yellow Stripe Trevally(Selaroidesleptolepis)meat protein,hydrolyzed by trypsin with different degree of hydrolysis(DH,10.8%,14.9%,19.0% and 21.7%),were investigated. Results showed that hydrolysis at lower DH significantly improved the hydroxyl radical-scavenging activity,Fe2+-chelating ability and DPPH radical-scavenging activity(p<0.05). However,hydrolysates at higher DH showed better metal reducing power(p<0.05). Hydrolysis treatment improved the solubility of the hydrolysates,while emulsifying activity and foaming capacity of the hydrolysates decreased as degree of hydrolysis increased. Moreover,solubility and emulsifying properties of the hydrolysates firstly declined then rised as pH increased. However,foaming capacity and foaming stability of the hydrolysates decreased as pH increased. Thus,the above results revealed that appropriate hydrolysis provided an approach to significantly enhance functional properties and antioxidant activity of Yellow Stripe Trevally meat proteins.
yellow stripe trevally;protein hydrolsate;degree of hydrolysis;functional properties;antioxidant activity
2014-06-13
卢彬(1989- ), 男, 硕士, 研究方向:食品加工技术。
广东省自然科学基金项目(S2013040015478);广东省高校优秀青年创新人才培养计划项目(2013LYM0056);韩山师范学院青年基金项目(LQ201202);韩山师范学院博士启动项目(QD20130516 & QD20140324);韩山师范学院一般项目(LY201306);潮州市科技计划项目(2013X05 & 2013X06)资助。
TS254.1
A
1002-0306(2015)07-0088-06
10.13386/j.issn1002-0306.2015.07.009
*通讯作者:王忠合(1980- ), 男, 博士, 讲师, 研究方向:食品加工与安全控制。

