大麦虫蛋白质对运动小鼠肌肉、血液指标和运动耐力的影响
史 亮,杨 伟,杨春平,杨 桦,王南溪,易 锐
(四川农业大学,林学院,森林保护省级重点实验室,四川雅安 625014)
大麦虫蛋白质对运动小鼠肌肉、血液指标和运动耐力的影响
史 亮,杨 伟*,杨春平,杨 桦,王南溪,易 锐
(四川农业大学,林学院,森林保护省级重点实验室,四川雅安 625014)
本研究采用大麦虫蛋白质作为补充蛋白源,对运动后的小鼠进行定量蛋白质补充;连续处理30d后测定相关指标。结果表明:大麦虫蛋白质作为补充蛋白时,高剂量组小鼠体重增长率最高;实验小鼠腿肌粗蛋白含量随补充剂量增加而升高,高剂量组显著高于空白对照;血液指标中血红蛋白(HGB)、血清蛋白(ALB)、血清总蛋白(TP)、血清尿素氮(BUN)均随补充剂量增加而升高;中剂量组和高剂量组爬杆时间增加显著;而力竭游泳时间各剂量组均显著高于空白对照。说明小鼠运动后适当补充大麦虫的蛋白质可以促进机体合成相应的功能性蛋白,并提高机体运动耐力。
大麦虫蛋白质,KM小鼠,肌肉指标,血液指标,运动耐力
大麦虫(Zophobasmorio),属昆虫纲(Insecta),鞘翅目(Coleoptera),拟步甲科(Tenebrionidae),主要分布于中美洲、南美洲、西印度群岛以及拉丁美洲等地区[1-2];驯化后成为大规模人工饲养的资源昆虫之一。Mark Finke等[3]在研究以昆虫和节肢动物作为受伤动物康复者的保健食品时,测定了部分大麦虫幼虫营养成分,其中水分含量为57.9%,粗蛋白含量为19.1%,粗脂肪含量为17.6%,其外还有多种微量元素;与家蝇(Muscadomestica)、黄粉虫幼虫(Tenebriomolitor)、蟋蟀(Achetadomesticus)、蚕蛹(Bombyxmori)等比较,大麦虫的蛋白质含量最高。目前对大麦虫的开发利用主要是幼虫活体作为龙鱼的饲料[4]。此外,也有将大麦虫蛋白粉替代鱼粉等运用于南美白对虾幼体开口饵料和黑豚饲料中[5-6],或将大麦虫蛋白质提取分离后做抗氧化物质的研究[7],但将大麦虫蛋白质作为功能性补充蛋白进行的研究却鲜见报道。
蛋白质是机体必不可少的营养元素之一,具有极其重要的生物学功能,它参与机体构成和各种生命活动[8],是生命活动中最重要的物质基础。机体的活动,如肌肉的收缩、血液中氧的运输等,都离不开蛋白质[9]。有大量文献表明,补充蛋白质能够保证运动过程中身体对蛋白质的需求,提供肌肉构建材料,促进肌肉纤维损伤的修复[10-11],从而促使肌肉生长,同时加快营养代谢,促使ATP-CP代谢旺盛[12-13],相关血液指标也有明显变化[8,14-16]。
本文将大麦虫蛋白质作为补充蛋白,对运动后的小鼠进行定量补充,以观察大麦虫蛋白质对运动小鼠肌肉、血液指标和运动耐力的影响,从而为大麦虫蛋白质作为补充蛋白的开发利用提供参考。
1 材料与方法
1.1 材料和仪器
大麦虫 四川农业大学林学院森林保护实验室提供。大麦虫蛋白粉制样前将大麦虫老熟幼虫饥饿24h,样品洗净后置于70±1℃烘箱中干燥12h,取出冷却后研磨成粉末,采用索氏提取法去除脂肪后,制成大麦虫蛋白粉;采用凯氏定氮法测定大麦虫蛋白粉粗蛋白含量为82.167%。
清洁级雄性KM小鼠80只 体重18~22g,由四川农业大学教学实习农场实验动物中心提供;小鼠分为2批,每批40只,第1批供测定相关血液指标、腿肌粗蛋白含量,第2批进行爬杆实验和力竭游泳测试。
JA2003A电子天平 上海精天电子仪器有限公司;DHG-9240A电热恒温鼓风干燥箱 上海精宏实验设备有限公司;SXT-06索氏提取器 上海华睿仪器有限公司;W501恒温水浴锅 上海申胜生物技术有限公司;UDK142凯氏定氮仪 意大利VELP公司;JRJ-300-I剪切乳化搅拌机 上海标本模型厂;游泳箱50cm×50cm×40cm 定做;Abacus junior vet5全自动血常规分析仪 奥地利Diatron公司;AUTOLAB PM4000全自动血生化分析仪 意大利罗马AMS公司;富华800电动离心机 金坛市富华仪器有限公司。
1.2 实验方法
1.2.1 剂量分组 根据运动员蛋白质参考摄入量为1.2~2.0g·kg-1bw·d,平均参考摄入量为1.6g·kg-1bw·d;本实验设置低、中、高3个剂量组,即1.67、3.33、6.66g·kg-1bw·d,相当于人体推荐剂量的1、2、4倍,同时设置一个空白对照组(灌胃等量的蒸馏水);每批分为4组,每组各10只雄性小鼠。各组小鼠分笼饲养,自由取食饮水。
1.2.2 小鼠游泳训练 小鼠每日在游泳箱(直径90cm,高45cm)中(水深30cm,水温(25±1)℃)下进行无负重强制游泳训练,每天训练30min。如果小鼠漂浮在水面,四肢不动,可以用小木棒在小鼠的周围轻轻搅动,强迫其继续游动;若出现溺水现象,立刻将小鼠捞出,休息5min后继续训练,累计达到30min后停止;游泳训练结束后,把每只小鼠身上的水擦干后放回饲养笼中;游泳训练共计30d。
1.2.3 小鼠灌胃 按照测定的粗制大麦虫蛋白粉的蛋白质含量用蒸馏水分别配制上述剂量浓度的营养液,在剪切乳化搅拌机中匀浆,得到均匀的大麦虫蛋白质营养液。每日游泳训练结束后,对小鼠进行营养液灌胃,以相同剂量的蒸馏水作为对照组;灌胃次数共计30次。
1.2.4 小鼠血液、肌肉指标的测定 第1批小鼠游泳训练和灌胃结束后,小鼠自由采食和饮水。次日取血测定前,先将小鼠饥饿12h,并称重、摘除眼球取血;取后腿肌肉组织,检测血红蛋白(HGB)、血清白蛋白(ALB)、血清总蛋白(TP)、血清尿素氮(BUN)、腿肌粗蛋白含量。相关血液检测利用全自动血常规分析仪和全自动血生化分析仪进行分析,腿肌粗蛋白含量利用凯氏定氮法检测。
1.2.5 小鼠爬杆实验和力竭游泳实验 第2批小鼠游泳训练和灌胃结束后,小鼠自由采食和饮水,次日进行爬杆实验和力竭游泳测试。
爬竿实验步骤:用长25cm,直径1cm的有机玻璃棒,经打磨后,固定于板上制成爬杆架,玻璃棒下端距地面30cm,下方放置2cm后的木屑防止小鼠摔伤,将小鼠放在有机玻璃棒上端,使其肌肉处于静力紧张状态,开始计时,记录小鼠由于肌肉疲劳而从有机玻璃棒上跌落到木屑中的时间,当小鼠第3次跌落至木屑中时终止实验,累计3次的时间作为小鼠的爬杆时间。
力竭游泳实验步骤:将爬杆实验后休息12h的小鼠尾根部负荷5%体重的铅皮,放入游泳箱中(水深30cm,水温(25±1)℃),开始计时,记录小鼠开始游泳至力竭时间,作为小鼠负重游泳时间,力竭判断的标准为:小鼠沉入水中过10s且放在平面上无法完成翻正反射[17]。在实验过程中,如果有小鼠漂浮在水面,四肢不动,可以用小木棒在小鼠的周围轻轻搅动。
1.3 数据统计
所有实验数据采用SPSS17.0软件进行统计分析。利用Duncan’s新复极差法分析法比较不同蛋白质剂量下小鼠肌肉、血液指标和运动耐力差异;实验前、后,大麦虫蛋白质对小鼠体重的比较采用配对T-检验。
2 结果与分析
2.1 大麦虫蛋白质对运动小鼠体重、体重增长率的影响
大麦虫蛋白质对运动小鼠体重的影响见表1。在各个剂量组中,实验后小鼠体重明显重于实验前(p<0.05)。补充大麦虫蛋白质的各组间体重增长率随大麦虫蛋白质补充剂量增加而增加,其中高剂量组体重增长率最高,达到73.53%,显著高于低剂量组(p<0.05)。

表2 大麦虫蛋白质对运动小鼠腿肌粗蛋白含量的影响(Mean±SD,n=10)
注:表中数据位平均值±标准差,同行数据后具不同小写字母表示差异显著(p<0.05),表4、表5同。

表3 大麦虫蛋白质对运动小鼠相关血液指标的影响(Mean±SD,n=10)
注:表中数据位平均值±标准差,同列数据后具不同小写字母表示差异显著(p<0.05)。

表4 大麦虫蛋白质对运动小鼠爬杆时间的影响(Mean±SD,n=10)

表5 大麦虫蛋白质对运动小鼠力竭游泳时间的影响(Mean±SD,n=10)
2.2 大麦虫蛋白质对运动小鼠腿肌粗蛋白含量的影响
大麦虫蛋白质对运动小鼠腿肌粗蛋白含量的影响见表2。小鼠腿肌粗蛋白含量随补充大麦虫蛋白质的剂量增加而增加。高剂量组小鼠腿肌粗蛋白含量最高,达到22.880%,显著高于空白对照(p<0.05)。低剂量组、中剂量组与空白对照之间差异不显著(p>0.05)。
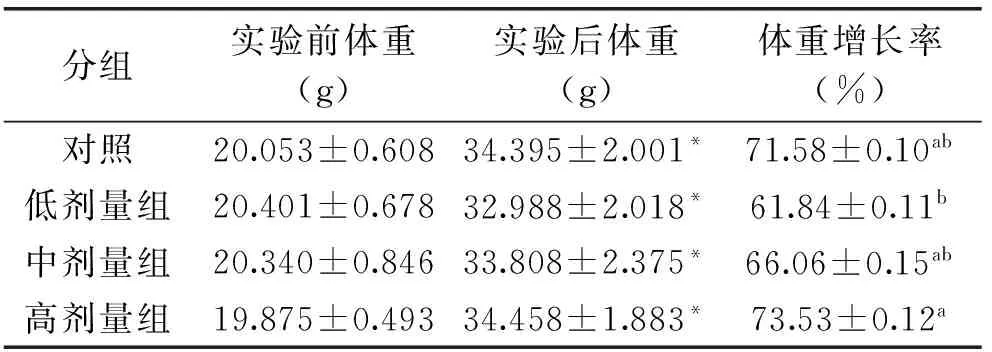
表1 大麦虫蛋白质对运动小鼠体重的影响(Mean±SD,n=10)
注:表中数据为平均值±标准差,同列数据后具不同小写字母表示差异显著(p<0.05,Duncan’s比较);*p<0.05表示实验前和实验后体重经t-检验差异显著。
2.3 大麦虫蛋白质对运动小鼠相关血液指标的影响
大麦虫蛋白质对运动小鼠相关血液指标的影响见表3。随着大麦虫蛋白质补充剂量的增加,小鼠HGB、ALB、TP和BUN含量逐渐增加。其中高剂量组的HGB含量(178.500g/L)、ALB含量(29.001g/L)、TP含量(65.900g/L)和BUN含量(7.046mmol/L)都显著高于空白对照(p<0.05)。而低剂量组的4种血液指标均与空白对照无显著性差异(p>0.05)。
2.4 大麦虫蛋白质对运动小鼠运动耐力的影响
大麦虫蛋白质对运动小鼠爬杆时间的影响见表4。小鼠爬杆时间随着大麦虫蛋白质补充剂量的增加而逐渐增加,其中高剂量组(431.92s)、中剂量组(275.62s)均显著高于空白对照(p<0.05),而低剂量组与空白对照无显著性差异(p>0.05)。
大麦虫蛋白质对运动小鼠力竭游泳时间的影响见表5,在补充了不同剂量的大麦虫蛋白质后,小鼠力竭游泳时间变化明显。其中高剂量组为(755.15s),显著高于其他剂量(p<0.05),而3个剂量组均显著高于空白对照(p<0.05)。
3 讨论
机体运动后能量大量消耗,蛋白质的分解代谢也随之加快;而蛋白质的更新取决于物质代谢的强度,在进行体育运动或训练时,机体代谢明显增加,蛋白质的需要量也明显增加,则需要适当补充蛋白质,以满足机体的需要[18]。实验小鼠在运动后补充不同剂量的大麦虫蛋白质,实验小鼠体重与补充剂量相关性较弱,但补充大麦虫蛋白质各组实验小鼠体重增长率随补充剂量增加而增加。这表明在长期定量游泳运动条件下对小鼠补充大麦虫蛋白质,其对于体重没有明显改变作用;但补充一定量的大麦虫蛋白质能增加小鼠体重增长率。
游泳是一项全身肌肉参与较多的耐力型运动,因此游泳对于肌肉蛋白也有一定程度的影响。运动时,骨骼肌蛋白的分解代谢增强,会导致骨骼肌蛋白含量下降;但运动后及时补充蛋白质,可以为骨骼肌的修复提供充足的底物[16]。实验小鼠在补充大麦虫蛋白质后,与对照组相比,随着补充大麦虫蛋白质剂量的增加,腿肌粗蛋白含量有逐渐升高的趋势,但仅高剂量组与对照组存在显著差异。段卫杰[19]认为:不同运动方式之间对蛋白质的利用也不尽相同,力量型运动中,蛋白质营养供给肌肉的增长和力量的增长,耐力型运动中,蛋白质营养供给大量机体耗能。相比于耐力型运动,进行力量型运动锻炼后补充蛋白质,可以更明显的观测到骨骼肌的变化水平。因此本实验中,实验小鼠在进行游泳训练后补充大麦虫蛋白质,低剂量组和中剂量组较空白对照腿肌粗蛋白含量上升不显著,仅高剂量组较空白对照显著上升。
HGB是高等生物体内负责运载氧的一种蛋白质;ALB具有结合和运输内源性与外源性物质,维持血液胶体渗透压,清除自由基,抑制血小板聚集和抗凝血等生理功能;二者在生命过程中都有着重要的意义,在一定程度上对于机体运动能力和运动后恢复能力有着重要作用。TP是各种蛋白的复杂混合物。实验小鼠HGB、ALB和TP都随着补充大麦虫蛋白质剂量的增加而上升,且部分组与对照组对比存在显著差异;这都说明运动后补充的大麦虫蛋白质在一定程度上为HGB、ALB和TP的合成提供了丰富的原料,促使HGB、ALB和TP的升高,有助于提高小鼠的运动耐力和运动后恢复能力。BUN是蛋白质代谢的主要终末产物,因此,BUN的增高可以在一定程度上表示机体蛋白质分解代谢加强。本实验中,中、高剂量组BUN与空白对照比较显著上升,说明在补充一定量的大麦虫蛋白质后,机体的蛋白质分解显著加强。
运动耐力的提高是抗疲劳能力加强的最直接表现[20],爬杆实验可以测试小鼠的静态耐力,游泳实验既可反映小鼠的运动能力,又能反映其抗疲劳能力或耐力[21]。随着大麦虫蛋白质补充剂量的增加,实验小鼠爬杆时间和力竭游泳时间均增加,且爬杆实验中,中剂量组和高剂量对比空白对照增加显著;力竭游泳实验中,补充大麦虫蛋白质的实验小鼠游泳时间与空白对照比较均显著增加。结果表明补充一定剂量的大麦虫蛋白质能提高小鼠的耐力水平,证明了在补充大麦虫蛋白质后,实验小鼠血液中HGB、ALB和TP的升高,有助于提高小鼠的运动耐力。
4 结论
本文将大麦虫蛋白质作为补充蛋白,对每天游泳运动后的小鼠进行定量补充,结果显示:将大麦虫蛋白质作为补充蛋白,可以增加游泳训练小鼠的体重增长率,其中高剂量组体重增长率达到73.53%,显著高于低剂量组;表明大麦虫蛋白质可以供给机体的物质合成。
游泳训练小鼠腿肌粗蛋白含量随补充大麦虫蛋白质的剂量增加而增加,高剂量组的腿肌粗蛋白含量达22.88%,显著高于空白对照;表明大麦虫蛋白质为骨骼肌的修复提供了充足的底物。
游泳训练小鼠HGB、ALB、TP含量都随补充大麦虫蛋白质的剂量增加而增加,且高剂量组HGB含量达178.500g/L,ALB含量达29.001g/L,TP含量达65.900g/L,均显著高于空白对照;表明运动后,适当补充大麦虫的蛋白质为HGB、ALB、TP合成提供了原料,促进了运动小鼠机体合成相应的功能性蛋白。
游泳训练小鼠BUN含量随补充大麦虫蛋白质的剂量增加而增加,且中剂量组达6.907mmol/L,高剂量组达7.046mmol/L,显著高于空白对照;表明适当补充大麦虫蛋白质后,机体的蛋白质分解代谢显著加强。
游泳训练小鼠爬杆时间随着大麦虫蛋白质补充剂量的增加而增加,中剂量组达275.62s,高剂量组431.92s,均显著高于空白对照;在力竭游泳实验中,3个剂量组的小鼠力竭游泳时间均显著高于空白对照,且高剂量组达755.15s,显著高于其他剂量组;表明补充一定剂量的大麦虫蛋白质能提高游泳训练小鼠的抗疲劳能力和运动耐力。
综上所述,大麦虫蛋白质作为运动机体的补充蛋白,可以为运动机体提供物质合成和修复底物,并促进合成相应的功能性蛋白,使机体蛋白质分解代谢加强,并提高机体抗疲劳能力和运动耐力。
[1]SpilmanT J. A few rearrangements in the Tenebrionidae,with a key to the genera of the Ulomini and Tenebrionini of America,North of Mexico(Coleoptera)[J]. The Coleopterists Bulletin,1962,16(2):57-63.
[2]Tschinkel W R.Zophobasatratus(Fab.)andZ.rugipesKirsch(Coleoptera:Tenebrionidae)are the same species[J]. The Coleopterists Bulletin,1984,38(4):325-333.
[3]Finke M,Winn D. Insects and Related Arthropods:A Nutritional Primer for Rehabilitators[J]. Journal of Wildlife Rehabilitation,2004,27(3-4):14-27.
[4]常政西. 龙鱼最好的饵料-大麦虫[J]. 农业知识:科学养殖,2007(9):36.
[5]赵海运,赵斌,张玲,等. 大麦虫蛋白粉在南美白对虾幼体开口饵料中的应用[J]. 天津农学院学报,2011,18(4):20-23.
[6]唐灵雪,潘红平,杨明柳,等. 大麦虫粉替代鱼粉对黑豚生长性能的影响[J]. 安徽农业科学,2012(25):12544-12545.
[7]郭倩,张建新,何桂梅,等. 大麦虫蛋白质的提取分离及抗氧化性研究[J]. 西北农业学报,2011,20(2):188-192.
[8]吴海寰,赵进喜,刘继鹏. 游泳对不同蛋白质负荷大鼠蛋白质代谢的影响[J]. 中国运动医学杂志,1997,16(4):247-251.
[9]杨世娣,邓九斤. 运动员的运动能力和脂类,蛋白质的关系[J]. 淮南职业技术学院学报,2005,5(4):26-27.
[10]魏守刚,杨则宜,高红. 不同运动训练方式和补剂对大鼠肌糖原生物合成的影响[J]. 中国运动医学杂志,2003,22(1):35-40.
[11]李世成,李跃纲,王启荣,等. 补充活性肽对大鼠 1 次离心运动后骨骼肌微细损伤作用的形态学研究[J]. 中国运动医学杂志,2006,25(1):31-36.
[12]冯炜权. 运动训练生物化学[M]. 北京体育大学出版社,1998.
[13]van Loon L J,Saris W H,Kruijshoop M,et al. Maximizing postexercise muscle glycogen synthesis:carbohydrate supplementation and the application of amino acid or protein hydrolysate mixtures[J]. The American journal of clinical nutrition,2000,72(1):106-111.
[14]张云龙,魏冰,王文莹,等. 补充蛋白棒对训练过程中男性士兵血清相关指标和运动能力的影响[J]. 中国运动医学杂志,2008,27(1):105-107.
[15]叶志兵. 火麻仁蛋白粉提高运动员营养指标值的临床研究[J]. 时珍国医国药,2010,12:150.
[16]牛程麟,王新颖,金丽,等. 蛋白强化的营养制剂对高运动量人员骨骼肌含量及营养状况的影响[J]. 肠外与肠内营养,2010,17(4):217.
[17]熊正英,唐量. 芦荟对运动训练小鼠血清酶活性和血尿素氮,血糖及血红蛋白含量的影响[J]. 陕西师范大学学报:自然科学版,2004,32(2):90-92.
[18]佐热古丽·热依木. 人体运动能力及蛋白质的载体作用[J]. 新农村,2010(6):165-166.
[19]段卫杰. 蛋白粉在田径各项目的作用[J]. 读写算:教育教学研究,2010(34):115.
[20]张青,吕波,王雨,等. 生姜对小鼠运动疲劳的对抗作用[J]. 西安交通大学学报:医学版,2012(1):34.
[21]林立,高波,孔令斌,等. 混配农药对小鼠运动能力及抗疲劳能力的影响[J]. 中国全科医学,2007,10(12):983-983.
Effect ofZophobasmorioprotein on muscle,blood indexes and exercise tolerance in sports training mice
SHI Liang,YANG Wei*,YANG Chun-ping,YANG Hua,WANG Nan-xi,YI Rui
(Forestry College of Sichuan Agricultural University,Provincial Key Laboratory of Forest Protection,Ya’an 625014,China)
In this research,Zophobasmoriowas used as source of supplementary protein to mice after excersise. The administration was carried out every day on quantitatively lavaged subjects over a total period of 30d,then related indexes were determined. The result indicated that the use ofZ.morioprotein,as a protein supplement,the highest body weight growth rate came from the group in which the highest dose were used. The crude protein content in the leg muscle of mice increased as the increase of supplement dose;compared with the control group,a significant increase was showed in the high dose group. Levels of hemoglobin(HGB),serum albumin(ALB),serum total protein(TP)and serum urea nitrogen(BUN)in blood were also raised as the increase of supplement dose. The pole-climbing time was significantly increased in both high and medium dose groups. The exhaustive swimming time of each protein used group was longer than control group significantly. In all,supply ofZ.morioprotein to mice after exercise was good for the form of the corresponding functional protein,and endurance was increased at the same time.
Zophobasmorioprotein;KM mice;muscle indexes;blood indexes;exercise tolerance
2014-06-30
史亮(1989-),男,硕士研究生,研究方向:资源昆虫开发与利用。
*通讯作者:杨伟(1964-),男,博士,教授,研究方向:森林保护学。
四川农业大学“211”工程双支计划项目(00370101)。
TS201.4
A
1002-0306(2015)07-0359-05
10.13386/j.issn1002-0306.2015.07.067

