脂肪酶固定化工艺优化及其酶学性质研究
王华,王莹,詹长娟,王翼,徐伟,陈海燕
(1.南京理工大学泰州科技学院化工学院,江苏泰州225300;2.江苏农牧科技职业学院动物药学院,江苏泰州225300)
脂肪酶(EC 3.1.1.3)广泛地用于催化水解[1]、醇解[2]、酯化[3]和转酯反应[4],是继蛋白酶、糖基水解酶之后,销量最大的食品和工业用酶类,具有广阔的市场空间和经济价值[5]。研究人员尝试了利用多种载体来固定脂肪酶,如水滑石[6]、多孔玻璃珠[7]等无机材料,天然高分子材料壳聚糖[8]、海藻酸钠[9],聚偏氟乙烯膜[10]、芳香聚酰胺中空纤维膜[11]及珠状环氧乙烷丙烯酸类多孔树脂[12]等有机载体。通过吸附法、交联吸附、共价结合及包埋法等对南极假丝酵母脂肪酶B(Candida antarctica B,CAL.B)、柱状假丝酵母脂肪酶(Candida rugosa lipase,CRL)和猪胰脂肪酶(Porcine pancreatic lipase,PPL)等常见脂肪酶进行固定化。
本文以黑曲霉脂肪酶(Aspergillus niger lipase)为研究对象,采用大孔树脂为载体,通过物理吸附固定化脂肪酶,并对固定化脂肪酶的性质进行探讨,为脂肪酶的固定化和应用提供参考。
1 材料与方法
1.1 试剂及仪器
脂肪酶(>20 000 U/g):宁夏和氏璧;牛白蛋白(BR):国药集团;考马斯亮蓝-G250(BR):上海强顺化学;橄榄油(CR):国药集团;聚乙烯醇(1750±50):国药集团;S-8、AB-8、D101大孔树脂(孔径 25 nm~28 nm,粒度0.3 mm~1.25 mm):国药集团;其余试剂均为市售分析纯。
PHS-25型精密pH计、UV754N型紫外可见分光光度计:上海精密科学仪器;AL104型电子天平:梅特勒-托利多;78-1型磁力加热搅拌器、SHA-8型双功能水浴恒温振荡器:金坛市杰瑞尔电器。
1.2 脂肪酶的固定化
用0.1 mol/L磷酸缓冲液(PBS)配制20 mg/mL的脂肪酶溶液。在150 mL的锥形瓶中加入5 g预处理好的大孔树脂和适量酶液,一定温度下振荡数小时。抽滤,用磷酸缓冲液冲洗,得固定化脂肪酶。
收集滤液,用考马斯亮蓝法测出其中的酶蛋白含量,并计算脂肪酶的固定化率[13]。
脂肪酶固定化率/%=(加入酶的总量-滤液中酶量)/加入酶的总量×100。
1.3 脂肪酶的活力测定
1.3.1 酶活的定义
在40℃、pH为7.5的条件下,1 s水解产生1 mol脂肪酸所需的脂肪酶酶量定义为一个活力单位(kat)。
1.3.2 NaOH滴定法测酶活
将聚乙烯醇与橄榄油(体积比=3∶1)在磁力搅拌器的搅拌下配制成乳化液,将磷酸缓冲溶液和橄榄油乳化液(体积比=5∶4)加入锥形瓶中混匀,在40℃水浴中预热5 min,加入适量游离或固定化脂肪酶,40℃反应15 min后,立即加入15 mL 95%乙醇以终止脂肪酶的催化反应。脂肪酶能将乳化的橄榄油水解成脂肪酸和甘油,用标准NaOH溶液和酚酞指示剂对脂肪酸进行酸碱滴定至粉红色。由消耗的NaOH的体积求出脂肪酶的酶活[14]。
固定化脂肪酶的活力回收率/%=固定化脂肪酶活力/(加入游离酶的总活力-滤液中脂肪酶活力)×100。
1.4 大孔树脂的筛选
取3只150 mL锥形瓶,各加入5 g经预处理的S-8、AB-8和D-101大孔树脂和10 mL脂肪酶溶液(pH 7.5 PBS配制,20 mg/mL),40℃,振荡 2 h。分别测定不同大孔树脂作为载体的固定化脂肪酶的固定化率和固定化脂肪酶活力回收率。
1.5 固定化脂肪酶性质研究
1.5.1 最适反应温度
分别取1 mL脂肪酶液和0.2 g固定化脂肪酶各9份,pH 7.5,在 30、32、34、36、38、40、42、44、46 ℃的条件下,测算游离和固定化脂肪酶的相对酶活。
1.5.2 最适反应pH
分别取1 mL脂肪酶液和0.2 g固定化脂肪酶各7份,40 ℃,在 pH 为 6.0、6.5、7.0、7.5、8.0、8.5、9.0 下,测定游离和固定化脂肪酶的相对酶活。
1.5.3 热稳定性
分别取1 mL肪酶液和0.2 g固定化脂肪酶各7份,在 20、30、40、50、60、70、80 ℃的条件下水浴振荡 1 h,在40℃、pH 7.5的条件下,测定游离和固定化脂肪酶的相对酶活。
1.5.4 酸碱稳定性
取0.2 g固定化脂肪酶7份,在pH为6.0、6.5、7.0、7.5、8.0、8.5、9.0 的条件下水浴振荡 1 h,过滤后,在40℃、pH 7.5的条件下,测定游离和固定化脂肪酶的相对酶活。
2 结果与讨论
2.1 大孔树脂的选择
分别以S-8、AB-8、D-101为载体制备的固定化脂肪酶的固定化率和固定化脂肪酶活力回收率见表1。

表1 不同大孔树脂的固定化脂肪酶的效果Table 1 Effect of various macroporous resin on the activity of lipase
根据表1可以看出载体的类型对脂肪酶的固定化率尤其是活力回收率影响较大,以极性大孔树脂S-8为载体制备的固定化脂肪酶固定化率和活力均为最低。其原因可能是,脂肪酶有较强的疏水性[15-16],能较好地吸附于弱极性的AB-8树脂和非极性的D-101树脂的表面及内部孔道[17]。基于相同的原因,AB-8树脂和D-101树脂对非极性底物橄榄油存在较强的吸附作用力,增加了固定化脂肪酶与底物的接触面积,从而使固定化酶具有相对高的活力[18]。其中,非极性大孔树脂D-101在固定化脂肪酶固定化率及活力回收率效果最佳,因此,本文选择D-101为脂肪酶固定化的载体。
2.2 响应曲面法对固定化脂肪酶技术的研究
2.2.1 脂肪酶固定化响应曲面实验的设计与结果
在预试验的基础上,以固定化脂肪酶活力回收率(Y)为指标,考察pH、温度、时间及给酶量等因素对D-101大孔树脂固定化脂肪酶的影响,并采用Box-Benhnken试验设计法对脂肪酶的固定化工艺进行进一步优化[19]。分析因素及水平编码表见表2,试验方案及结果见表3。
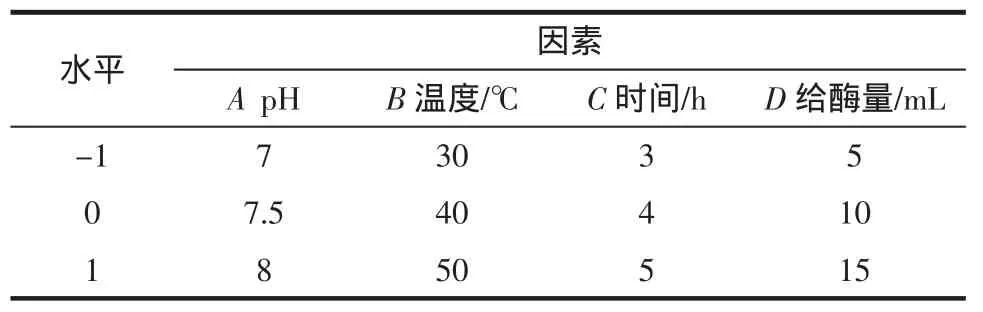
表2 脂肪酶固定化因素水平表Table 2 Assigned concentrations of variables at different levels in Box-Behnken design for the immobilization of lipase

表3 脂肪酶固定化Box-Behnken试验方案与结果Table 3 Experimental design and results of Box-Behnken design for the activity recovery ratio of lipase
对表3中的试验数据进行回归分析,得到活力回收率与pH、温度、时间、给酶量之间的二次多元回归方程:
固定化脂肪酶活力回收率/%=100.41+1.85A-2.71B+2.92C-1.59D+0.67AB+1.87AC-0.63AD-2.92BC+1.74BD+0.020CD-5.10A2-14.88B2-6.21C2-4.51D2
2.2.2 二次多元回归模型方差分析
活力回收率试验回归方程方差分析结果见表4。

表4 活力回收率回归方程系数估计及方差分析Table 4 Analysis of regression coefficient
方程模型的显著性P<0.000 1属极显著范畴,pH、温度、时间和给酶量的影响均为极显著,二次项BC 以及 A2、B2、C2、D2亦为极显著,AC、BD 的影响为显著。回归模型的决定系数R2=0.982 8,校正决定系数R2(Adj)=0.965 6,表明该回归方程可很好地描述pH等因素与响应值活力回收率之间的相应关系。
2.2.3 固定化脂肪酶活力回收率曲面分析
固定化脂肪酶活力回收率曲面分析见图1。
从图1(A~F)中可以知道:6个响应曲面图均为开口向下的凸形曲面,响应值Y随着每个因素的改变而发生变化,其中温度对试验结果的影响最大,表现为曲面最陡。这是因为酶蛋白长时间在相对高温的环境中,可能会发生变性,导致酶活下降。图 1(B)、1(D)和1(F)中等高线呈椭圆形,表明pH和温度、给酶量和温度、时间和温度的交互作用比较明显,与方差分析一致。


图1 不同因素及其交互作用对固定化脂肪酶活力回收率的影响Fig.1 Curved surface plots(A~F)for reciprocal effect of each two factors on the activity recovery ratio of lipase
经Design-Expert 8.0.6软件分析,大孔树脂固定化脂肪酶的最优条件为pH 7.62、38.72℃、4.30 h、给酶量为8.92 mL,固定化脂肪酶活力回收率的预测结果为101.417%。考虑到试验操作的可控性,在条件为pH7.6、温度为39℃、时间为4.3 h、给酶量为9.0 mL的条件进行3组重复性验证试验,其实际测得的固定化脂肪酶平均固定化率为95.11%,活力回收率为101.36%,与预测值较为接近,验证了响应面法回归模型的合理性。
2.3 固定化脂肪酶性质讨论
2.3.1 最适反应温度的测定
最适反应温度的测定见图2。

图2 游离酶和固定化脂肪酶反应最适温度Fig.2 Effect of temperature on lipase activity
由图2可知,游离脂肪酶的最佳反应温度为38℃,而固定化脂肪酶的最佳反应温度为40℃。温度低于40℃时,固定化酶的相对活力较游离酶低,这是因为脂肪酶吸附于D-101树脂孔道中,脂肪酶分子的尺寸为几个到十几个纳米,D-101大孔树脂的孔径为25nm~28 nm,底物橄榄油的扩散速度受到影响[20-21],随着温度的升高,橄榄油分子运动速度加快,表现出酶活力迅速增大。温度继续升高,固定化脂肪酶酶的活力下降比游离酶慢,这是因为吸附于D-101树脂孔道中的脂肪酶空间构象相对稳定,在一定程度上提高了脂肪酶的耐热性,使脂肪酶能够在更广的温度范围内催化反应。
2.3.2 最适pH的测定
最适pH的测定见图3。
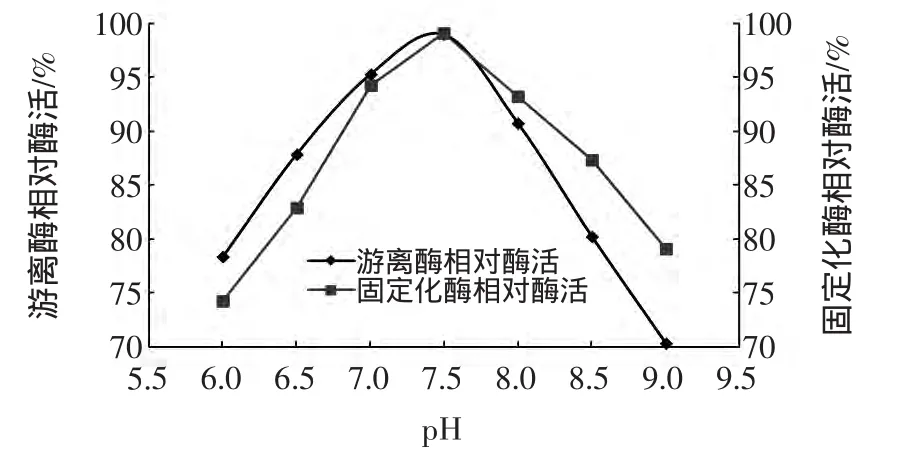
图3 游离酶和固定化脂肪酶反应最适pHFig.3 Effect of pH on lipase activity
由图3可知,在pH<7.5时,固定化脂肪酶相对酶活由酸碱度引起的变化比游离酶大,在pH>7.5时,固定化脂肪酶相对酶活由酸碱度引起的变化比游离酶小。橄榄油水解产生的脂肪酸受到树脂孔道的扩散限制。当固定化酶位于酸性环境中时,脂肪酶周围微环境中短时间内积累较多的脂肪酸,酶活受到抑制,当固定化酶位于碱性环境中时,产生的脂肪酸可被快速中和,故固定化后,脂肪酶在偏碱性环境下表现出较强的催化活性[22]。
2.3.3 脂肪酶的热稳定性
脂肪酶的热稳定性见图4。

图4 脂肪酶酶的热稳定性比较Fig.4 The plots of thermal stability of the immobilized and free lipase
图4显示,在较低的温度中(<40℃),游离脂肪酶和固定化脂肪酶的活力都很高,但随着保温温度的提高(>50℃),游离脂肪酶的相对酶活骤然下降。说明游离脂肪酶的热稳定性差,固定化脂肪酶热稳定性更好。这是因为酶经固定化后,脂肪酶分子被吸附于大孔树脂中,酶分子整体运动受阻,活性中心的稳定性增加。
2.3.4 脂肪酶的酸碱稳定性
脂肪酶的酸碱稳定性见图5。
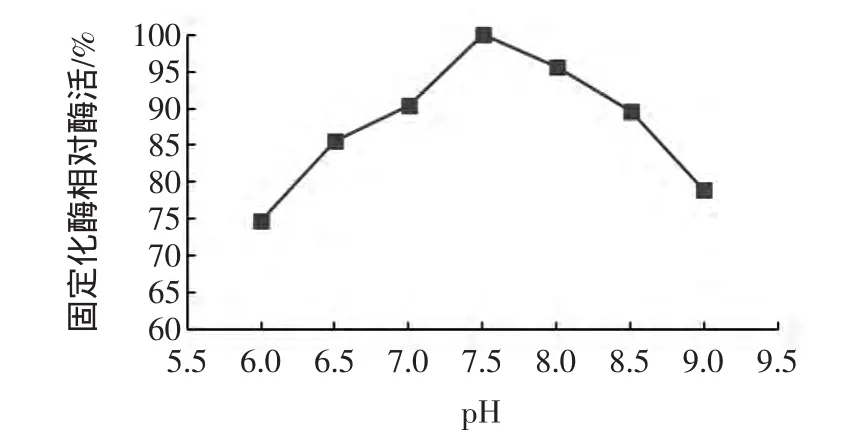
图5 脂肪酶的酶酸碱稳定性Fig.5 The plots of pH stability of the immobilized and free lipase
固定化脂肪酶在不同pH条件下保存1 h后,相对酶活力均维持在70%以上(见图5),酸碱稳定性较好。
3 结论
本文以D-101大孔树脂为载体,采用物理吸附法制备了固定化脂肪酶。通过Box-Benhnken原理设计了四因素三水平的响应曲面试验,优化的脂肪酶固定化工艺为:pH 7.6、温度39℃、时间4.3 h、给酶量为9.0 mL(20 mg/mL),在此条件下,固定化脂肪酶平均固定化率为95.11%,活力回收率为101.36%。固定化脂肪酶的最适温度提高2℃和pH无明显变化,向碱性方向偏移,热稳定性较游离酶有所提高(>50℃),酸碱稳定性好。
以价格低廉、性质稳定的D-101大孔树脂为载体,制备的固定化脂肪酶,工艺简单,固定化率和酶活回收率高,稳定性好,具有较好的工业前景。
[1] Chowdary G V,Ramesh M N,Prapulla S G.Enzymic synthesis of isoamyl isovalerate using immobilized lipase from Rhizomucor miehei:multivariate analysis[J].Process Biochem,2001,36(4):331-339
[2] Rao P,Divakar S.Lipase catalyzed esterification of a-terpineol with various organic acids:application of the Plackett-Burman design[J].Process Biochem,2001,36(11):1125-1128
[3] Zhang L Q,Zhang Y D,Xu L,et al.Lipase catalyzed synthesis of RGDdiamidein aqueous water-miscibleorganic solvents[J].Enzyme Microb Technol,2001,29(2):129-135
[4] Weber N,Klein E,Mukerjee K D.Long chain acyl thioesters prepared by solvent free thioesterification and transesterification catalyzed by microbial lipases[J].Appl Microbiol Biotechnol,1999,51(3):401-404
[5] 刘光.黑曲霉脂肪酶的分离纯化及其性质研究[D].广州:华南理工大学,2013
[6] Sagiroglu A.Conversion of sunflower oil to biodiesel by alcoholysis using immobilized lipase[J].Artificial Cells Blood Substitutes and Biotechnology,2008,36(2):138-149
[7] 罗文,谭天伟,袁振宏,等.多孔玻璃珠固定化脂肪酶及其催化合成生物柴油[J].现代化工,2007,21(11):40-42
[8] 吴茜茜,吴克,刘斌,等.壳聚糖固定化德氏根霉脂肪酶的研究[J].工业微生物,2003,33(4):9-13
[9] López Serrano P,Cao L,van Rantwijk F,et al.Cross-linked enzyme aggregates with enhanced activity:application to lipases[J].Biotechnology Letters,2002,24(16):1379,1383
[10]Tsai S W,Shaw S S.Selection of hydrophobic membranes in the lipase-catalyzed hydrolysis of olive oil[J].Journal of Membrane Science,1998,146(1):l-8
[11]Sakaki K,Giorno L,Drioli E.Lipase-catalyzed optical resolution of racemic naproxen in biphasic enzyme membrane reactors[J].Journal of Membrane Science,2001,184(1):27-38
[12]Vaidya B K,Ingavle G C,Ponrathnam S,et al.Immobilization of Candida rugosa lipase on poly(allyl glycidyl ether-co-ethylene glycol dimethacrylate)macroporous polymer particles[J].Bioresource Technology,2008,99(9):3623-3629
[13]王华,王安明,周成,等.微波辐射高效共价固定青霉素酰化酶[J].化学学报,2008,66(2):271-275
[14]中华人民共和国国家质量监督检验检疫总局,中国国家标准化管理委员会.GB/T 23535-2009脂肪酶制剂[S].北京:中国标准出版社,2009
[15]波莱纳J,麦凯布A.P.工业酶——结构、功能与应用[M].北京:科学出版社,2010
[16]徐坚,王玉军,骆广生,等.膜材料的亲疏水性对固定化脂肪酶的影响[J].高校化学工程学报,2006,20(3):395-400
[17]万容兵.载体表面化学组成对蛋白质吸附行为的影响[D].浙江理工大学,2010
[18]刘汝宽.脂肪酶固定化技术研究[D].郑州:河南工业大学,2007
[19]徐向宏,何明珠.试验设计与Design-Expert、SPSS应用[M].北京:科学出版社,2010
[20]贾佳,尹德忠,张宝亮,等.大孔树脂固定木瓜蛋白酶的研究[J].材料导报,2013,27(22):88-91
[21]曹林秋.载体固定化酶-原理、应用和设计[M].北京:化学工业出版社,2008
[22]罗贵明.酶工程[M].北京:化学工业出版社,2003

