吡柔比星对膀胱癌EJ 细胞增殖及Livin 和Caspase-3表达的影响
李鹏程,李 飞,宋亚辉,廖 然,周 理,葛 波
0 引 言
膀胱癌是泌尿系统最常见的恶性肿瘤之一,占全部恶性肿瘤的3.2%。男性膀胱癌的发病率位居全身恶性肿瘤的第7 位,女性排在第10 位,且发病率呈逐年升高趋势[1-2]。吡柔比星作为一种广谱抗肿瘤药,具有很强的抗肿瘤活性,通过阻断癌细胞的细胞分裂周期,进而杀灭癌细胞。近年来研究显示Livin、Caspase-3 参与某些肿瘤的发生、发展,与肿瘤的生物学行为关系密切[3-4]。随着基因治疗作为综合治疗的一个重要手段在临床中受到越来越多的关注,探讨与膀胱癌发生发展相关的分子机制具有重要的意义。本研究采用吡柔比星诱导膀胱癌EJ 细胞株,观察吡柔比星对人膀胱癌细胞株EJ 增殖情况、细胞周期的影响,及对相关基因Livin、Caspase-3 表达的影响,探讨其可能的分子机制,为吡柔比星在临床膀胱癌辅助化疗中的应用提供实验依据。
1 材料与方法
1.1 实验材料 人膀胱癌细胞EJ 细胞株购于南京凯基细胞公司;吡柔比星为深圳万乐药业有限公司产品;1640 培养基为GIBICOL 公司产品;胎牛血清购于GIBICOL 公司;RT-PCR 反应体系购于北京康为世纪生物科技有限公司;Livin、Caspase-3 及β-action 引物购于博士德生物技术有限责任公司;抗Caspase-3 一抗(兔源性)、抗β-action 一抗(兔源性)及二抗(山羊抗兔)均为博士德生物技术有限责任公司。
1.2 细胞培养 人膀胱癌EJ 细胞株置于含10%胎牛血清、1%双抗的RPMI1640 培养基中,37 ℃、5%CO2培养箱中传代培养。
1.3 倒置显微镜下观察细胞形态 将传代的膀胱癌EJ 细胞接种于6 孔板中,接种密度为1×105个/孔,置于37 ℃、5%CO2恒温培养箱中,培养24 h后,按0、0.1、1、10 μg/mL 的终浓度加入吡柔比星,继续培养24 h,用倒置显微镜观察细胞生长状态。
1.4 细胞增殖-毒性检测实验 吡柔比星浓度分为0、0.1、1、10 μg/mL。取对数期膀胱癌EJ 细胞,按2000 个/孔细胞接种于96 孔板中,培养24 h 后,分别加入上述不同浓度吡柔比星干预,0 μg/mL 吡柔比星中加入等量的培养液作为对照,每组设5 个平行孔。继续在恒温培养箱中培养,分别于24、48、72 h进行处理,每孔加入10 μL CCK-8 试剂,培养箱中继续培养1 h,应用酶联免疫检测仪测定450 nm波长处各孔的吸光度(A 值),计算增殖抑制率,公式如下:
增殖抑制率(%)=(对照A 值-各浓度吡柔比星A 值)/对照A 值×100%
1.5 RT-PCR 检测Livin、Caspase-3 mRNA 的表达取对数生长期EJ 细胞,按照实验分组加药培养后,用Ultrapure RNA Kit(超纯RNA 提取试剂盒)提取总RNA 后测定RNA 的浓度和纯度,使用SuperRT cDNA Kit(SuperRT cDNA 第一链合成试剂盒)进行逆转录合成cDNA(20 μL 反应体系),使用2×Taq MasterMix(含染料)试剂进行扩增(50 μL 反应体系)。Livin 上游引物:5'-GGCTTCTTCCACACAGGC-3',下游引物:5'-CTCCTGCACACTGTGGAC-3';Caspase-3 上游引物:5'-CTGCCGTGGTACAGAACT-3',下游引物:5'-AGGTGCTGTGGAGTATGC-3';β-actin 上 游 引 物:5'-CCTGGGCATGGAGTCCTGTG-3',下游引物:5'-TCTTCATTGTGCTGGGTGCC-3'。测定各个条带的灰度值,Livin、Caspase-3 条带的灰度值与其相应的内参β-actin 条带的灰度值的比值,作为各组间相互比较的参数。
1.6 Western blot 检测Livin、Caspase-3 蛋白以明确目标产物 将不同浓度的吡柔比星(0、0.1、1、10 μg/mL)干预处理EJ 细胞24 h 后,收集培养细胞,估计细胞离心后的体积(PCV),每50 μL PCV 加入5 倍体积RIPA 裂解缓冲液(250 μL),冰浴放置10 min,反复吹打混匀,待细胞裂解充分后收集细胞蛋白产物,用BCA 蛋白浓度测定试剂盒进行蛋白定量。12%SDS 聚丙烯酰胺凝胶电泳分离,蛋白印迹转移法转至硝酸纤维素膜上,用含5%脱脂奶粉的PBST 溶液在室温下封闭2 h,1∶400 一抗4 ℃下孵育过夜,PBST 溶液洗涤后和浓度为1∶1000 的二抗(用HRP 标记)在室温下孵育1 h,用PBST 溶液洗涤,与发光试剂充分反应后,应用Kodak 化学发光成像系统曝光。
1.7 统计学分析 应用SPSS 13.0 软件进行统计分析,实验数据以均数±标准差()表示,多组间均数比较采用单因素方差分析。以P≤0.05 为差异有统计学意义。
2 结 果
2.1 不同浓度的吡柔比星作用后EJ 细胞形态变化 采用倒置显微镜下,对照组:膀胱癌EJ 细胞呈多边形,贴壁生长,细胞大小均一,轮廓清楚,核分裂象多见;0.1 μg/mL 的吡柔比星:膀胱癌EJ 细胞的生长受到了抑制,较对照组细胞稀疏,核分裂象减少,细胞尚饱满;1 μg/mL 的吡柔比星:膀胱癌EJ 细胞生长抑制作用明显,其贴壁状态比较差,细胞缩小变形,部分细胞变圆甚至凋亡;10 μg/mL 吡柔比星:膀胱癌EJ 细胞稀疏,细胞缩小变形明显,折光性变强,细胞萎缩、碎裂,形成有膜包围的含有核和细胞质碎片的凋亡小体,活细胞明显减少。见图1。
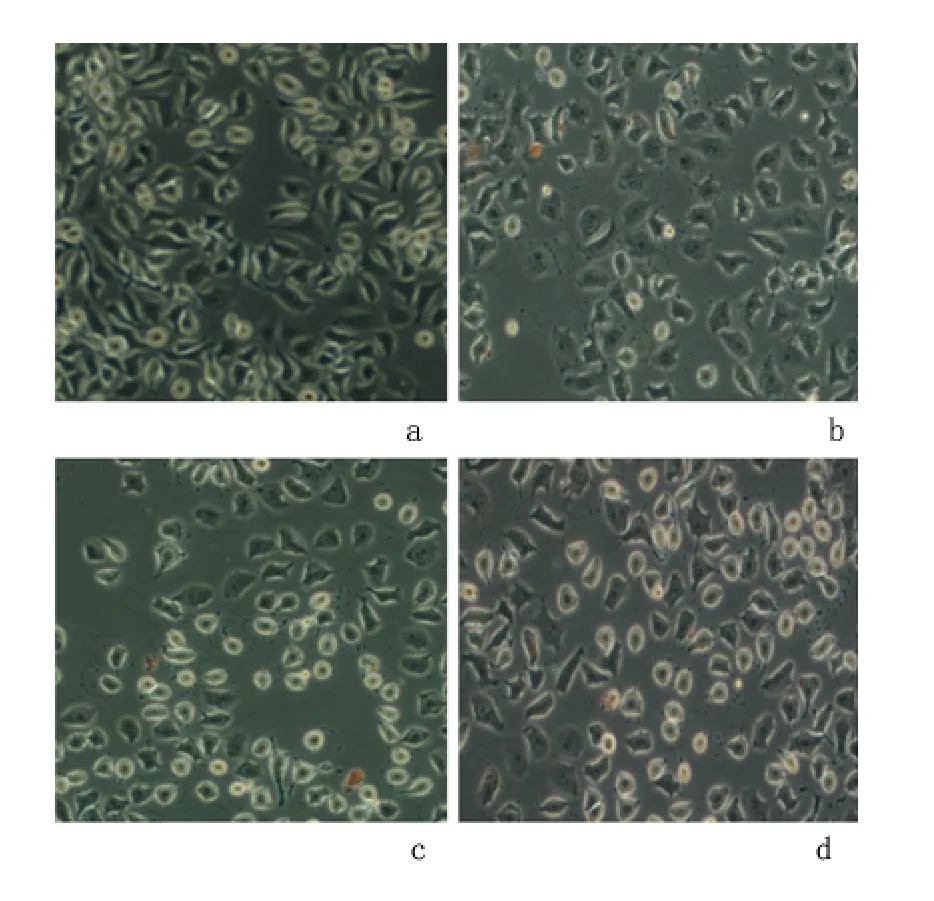
图1 倒置显微镜下观察不同浓度的吡柔比星作用后EJ 细胞形态(×400)Figure 1 The growth situation of the EJ cells which are influnced by different consistences of THP(×400)
2.2 不同浓度的吡柔比星对EJ 细胞增殖活性的影响 细胞增殖-毒性检测:①与0 μg/mL 吡柔比星比,0.1、1、10 μg/mL 吡柔比星干预膀胱癌EJ 细胞24、48、72 h 后,细胞的增殖活性受到明显的抑制,且各时间之间及各浓度之间A 值差异均有统计学意义(P <0.05)。见表1。②细胞增殖抑制率随药物浓度增加、作用时间延长而升高,有明显的时间-剂量效应关系(P <0.05)。其中10 μg/mL 的吡柔比星组作用于膀胱癌EJ 细胞72 h 后的增殖抑制率最高,为(89.1±2.6)%。见图2。
表1 不同浓度吡柔比星对膀胱癌EJ 细胞A 值的影响,n=5)Table 1 Influence of THP on absorbance value of EJ cells in different time points and concentrationsn=5)

表1 不同浓度吡柔比星对膀胱癌EJ 细胞A 值的影响,n=5)Table 1 Influence of THP on absorbance value of EJ cells in different time points and concentrationsn=5)
与0 μg/mL 吡柔比星比较,* P <0.05,与前一时间点比较,#P <0.05
吡柔比星A 值浓度(μg/mL)24 h 48 h 72 h 0 0.72±0.07 0.96±0.05 1.24±0.08 011 0.1 000...643 147±±±000...000 442***000...652 945±±±000...000 444***###000...861 014±±±000...000 654***###

图2 不同浓度的吡柔比星对EJ 细胞增殖抑制率的影响Figure 2 Influence of THP in different concentrations on inhibition rate of EJ cells
2.3 不同浓度吡柔比星对EJ 细胞周期的影响0.1、1、10 μg/mL 吡柔比星干预膀胱癌EJ 细胞24 h后,其G2/M 期细胞百分比[(18.11±2.33)%、(61.34±2.03)%、(89.07±2.95)%]较0 μg/mL吡柔比星明显增加(P <0.05)。见图3。
2.4 不同浓度吡柔比星对EJ 细胞Livin、Caspase-3 mRNA 表达水平的影响 0.1、1、10 μg/mL吡柔比星干预EJ 细胞24 h 后,Livin mRNA 表达水平较0 μg/mL吡柔比星明显降低(P <0.05),而Caspase-3 mRNA 表达水平较0 μg/mL 吡柔比星明显升高(P <0.05)。见图4,表2。
2.5 不同浓度吡柔比星对EJ 细胞Livin、Caspase-3蛋白表达水平的影响 0.1、1、10 μg/mL 吡柔比星干预EJ 细胞24 h 后,Livin 基因蛋白表达水平较0 μg/mL吡柔比星明显降低,而Caspase-3 蛋白表达水平则明显升高(P <0.05)。见图5,表2。

图3 吡柔比星对EJ 细胞的细胞周期的影响Figure 3 The influence of THP on cell cycle of EJ cells
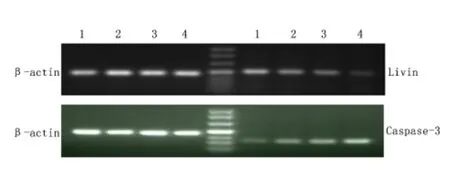
图4 RT-PCR 检测吡柔比星对Livin、Caspase-3 mRNA 表达的影响Figure 4 The influence of THP on the expressions of Livin and Caspase-3 by RT-PCR test

图5 Western blot 检测吡柔比星对Livin、Caspase-3 蛋白表达的影响Figure 5 Western blot tests the influence of THP to the expression of Livin and Caspase-3
表2 吡柔比星对Livin、Caspase-3 mRNA 及Livin、Caspase-3 mRNA 蛋白表达的影响Table 2 The influence of THP on the expressions of Livin and Caspase-3

表2 吡柔比星对Livin、Caspase-3 mRNA 及Livin、Caspase-3 mRNA 蛋白表达的影响Table 2 The influence of THP on the expressions of Livin and Caspase-3
与0 μg/mL 吡柔比星比较,*P <0.05
吡柔比星浓度RT-PCRWestern blot(μg/mL)Livin mRNA Caspase-3 mRNALivin 蛋白 Caspase-3蛋白0 0.84±0.07 0.12±0.13 0.74±0.03 0.22±0.02 0.1 0.63±0.09* 0.31±0.08* 0.43±0.08* 0.41±0.07*1 0.44±0.06* 0.52±0.04* 0.26±0.06* 0.62±0.03*10 0.21±0.02* 0.75±0.01* 0.11±0.01* 0.90±0.06*
3 讨 论
膀胱癌是泌尿系统最常见的恶性肿瘤之一,具有较高的复发率及局部侵袭力,其组织学类型多来源于上皮组织,鳞癌与腺癌所占比例较小[5-6]。大多数浅表性膀胱癌可经尿道切除术治愈,但术后50%~70%的患者容易复发,部分患者伴有恶性程度增加或浸润能力增强,在保留膀胱的膀胱癌术后进行膀胱灌注治疗是预防复发的重要措施。
吡柔比星是半合成蒽环类抗肿瘤药物,常用于膀胱灌注化疗,它能迅速进入癌细胞内,阻止核酸的合成,使肿瘤细胞终止增殖直至死亡,具有很强的抗癌活性,其抗癌谱较广,对移行上皮癌有易感性,对膀胱癌细胞的杀伤效应较强。研究证明吡柔比星比临床常用的同类药物疗效高、不良反应少,但目前对于其抗肿瘤的具体机制却不太明确[7-9]。
细胞凋亡是抑制肿瘤细胞增殖的主要方式,凋亡过程受到许多调节因子的控制,机体通过细胞凋亡来防止细胞过度增殖并清除有害细胞,以维持内环境的稳定和机体正常的生理功能。
Livin 是凋亡蛋白抑制因子家族成员之一,被认为与肿瘤的发生密切相关,研究证实Livin 在许多恶性肿瘤中呈高度表达,包括泌尿系肿瘤[10-12]。Livin有2 个剪切异构体,分别为Livin-α、Livin-β,相对分子质量分别为39 000 和37 000。Caspase 是一类介导细胞凋亡的重要蛋白家族,大多数刺激物是通过Caspase 的级联激活反应引起细胞的凋亡。有研究表明Caspase-3 是细胞凋亡中最重要的效应性蛋白裂解酶,大多数触发细胞凋亡的因素最终都需要Caspase-3 介导的信号转导途径而导致细胞凋亡[13-15]。Livin 直接或间接抑制Caspase-3 的表达,凋亡抑制与促进失衡,可能是导致肿瘤发生的重要原因之一,Livin 与Caspase-3 之间的关系或许是膀胱癌细胞凋亡信号传导通路网络中的重要一环。
本实验研究结果证实吡柔比星对膀胱癌EJ 细胞在增殖具有明显的抑制作用,并且存在明显的时间-剂量效应关系。流式细胞术检测结果表明吡柔比星可使膀胱癌EJ 细胞明显的阻滞于G2/M 期。RTPCR 结果表明,各实验组细胞中Livin 基因mRNA表达水平较对照组明显降低,而促进凋亡的Caspase-3 mRNA 表达水平较对照组明显升高,其作用具有明显的剂量关系。这可能与吡柔比星诱导膀胱癌EJ 细胞的凋亡密切相关,其分子机制可能是吡柔比星下调了膀胱癌EJ 细胞中Livin 蛋白的表达,上调Caspase-3蛋白的表达,通过Livin 与Caspase-3 之间的级联激活反应引起细胞的凋亡,而本实验随后的Western blot检测也证实了这一观点。Livin、Caspase-3 基因在膀胱癌的发生发展中起着一定的作用,或许可成为膀胱癌诊断与治疗研究的关键靶点之一。
综上所述,吡柔比星能有效地抑制膀胱癌EJ 细胞的增殖,诱导其凋亡,其作用机制可能是抑制了其中Livin 基因的表达,上调Caspase-3 基因的表达,使得膀胱癌EJ 细胞的增殖、侵袭能力下降。为吡柔比星应用于膀胱癌术后的灌注化疗,提供了初步的实验依据。
[1] 吴阶平.吴阶平泌尿外科学[M].济南:山东科学技术出版社,2005:921-980.
[2] 那彦群.中国泌尿外科疾病诊断治疗指南[M].人民卫生出版社,2013:20-58.
[3] Myung DS,Park YL,Chung CY,et al.Expression of Livin in colorectal cancer and its relationship to tumor cell behavior and prognosis[J].PLoS One,2013,8(9):e73262.
[4] Yoon TM,Kim SA,Lee DH,et al.Expression of Livin and the inhibition of tumor progression by Livin silencing in laryngohypopharyngeal cancer[J].In Vivo,2014,28(5):751-759.
[5] 崔殿生,熊治国,魏少忠,等.保留膀胱术后综合治疗肌层浸润性膀胱癌的临床疗效[J].武汉大学学报(医学版),2014,4:606-608.
[6] 程 文,徐 锋,刑潇潇,等.310 例膀胱癌综合治疗病例的临床分析[J].医学研究生学报,2013,26(12):1282-1285.
[7] Li Q,Xu T,Wang XF.Mechanism of intravesical instillation of pirarubicin for preventing recurrence of non-muscle invasive bladder Cancer[J].Zhonghua Zhong Liu Za Zhi,2009,31(12):904-907.
[8] Zheng SE,Xiong S,Lin F,et al.Pirarubicin inhibits multidrugresistant osteosarcoma cell proliferation through induction of G2/M phase cell cycle arrest[J].Acta Pharmacol Sin,2012,33(6):832-838.
[9] 欧俐苹,杜红飞,吕长坤,等.吡柔比星通过PLCε-Bcl-2 通路抑制膀胱癌细胞增殖[J].第二军医大学学报,2014,7:708-713.
[10] Chen X,Wang T,Yang D,et al.Expression of the IAP protein family acts cooperatively to predict prognosis in human bladder Cancer patients[J].Oncol Lett,2013,5(4):1278-1284.
[11] Lee DH,Yoon TM,Kim SA,et al.Relationship between expression of Livin and the biological behavior of human oral squamous cell carcinoma[J].Oncol Rep,2014,32(6):2453-2460.
[12] 李鹏程,葛 波.Livin 与泌尿系肿瘤的相关研究进展[J].医学研究生学报,2014,27(7):772-776.
[13] Dasmahapatra G,Almenara JA,Grant S.Flavopiridol and histone deacetylase inhibitors promote mitochondrial injury and cell death in human leukemia cells that overexpress Bcl-2[J].Mol Pharmacol,2006,69(1):288-298.
[14] Liu GH,Wang C,Ding ZY.Overexpression of the truncated form of Livin reveals a complex interaction with caspase-3[J].Int J Oncol,2013,42(6):2037-2045.
[15] Xu M,Xia LP,Fan LJ,et al.Livin and caspase-3 expression are negatively correlated in cervical squamous cell cancer[J].Eur J Gynaecol Oncol,2013,34(2):152-155.

