高分辨率熔解曲线分析法检测结直肠癌组织K-ras 基因突变及其临床意义
王 倩,顾 页,林 洁
0 引 言
结直肠癌是目前临床上常见的恶性肿瘤之一,随着生活水平的提高,饮食结构的改变,我国结直肠癌的发病率也越来越高。有研究表明,结直肠癌的发生发展是一个多基因作用的多阶段过程,目前发现与之相关的因素包括染色体不稳定性、微卫星不稳定及CpG 岛甲基化[1]。其中由染色体不稳定所致的大肠癌占85%,主要涉及APC、Kras 和P53基因的突变。其中K-ras 和APC 癌基因的突变激活是结直肠癌发生、发展的早期事件。在针对转移性结直肠癌的治疗当中,了解K-ras 基因的突变状态对于是否选择靶向药物进行治疗具有非常重要的临床意义。目前,检测K-ras 基因突变的方法有很多,其中,高分辨率熔解曲线分析法(high-resolution melting curve analysis,HRM)是一种最新的遗传学分析手段,它根据目标DNA 序列的长度、GC 含量及碱基的互补性差异,利用HRM 对样品的基因型进行分析,其分辨精度可测出单碱基差异,是在实时荧光定量PCR 基础上通过饱和燃料监控核酸的熔解曲线变化进行分析的新兴分子诊断技术。相比传统经典的直接测序法,它无需序列特异性探针、不受突变碱基位点和类型的局限,操作简单、快捷,高通量、低成本。本研究应用HRM 技术检测分析179 例结直肠癌组织K-ras 基因的突变情况,并探讨K-ras基因突变与临床病理参数的相关性,从而进一步评估HRM 法检测结直肠癌K-ras 基因突变的可行性,为结直肠癌患者临床检测突变提供更有效的方法和制定个体化治疗方案提供参考。
1 资料与方法
1.1 一般资料 选取2011 年1 月~2012 年12 月在南方医科大学南方医院手术切除的结直肠癌患者179 例。患者年龄15 ~89 岁,中位年龄60 岁,其中男性103 例,女性76 例;直肠癌71 例,结肠癌108例;腺癌179 例(高、中、低分化者分别为47、108、24例);Dukes 分期:A 期27 例,B 期96 例,C 期41 例,D 期15 例。
1.2 主要仪器和材料 Rotor-Gene Q 型HRM 分析仪(德国Qiagen)、QIAamp DNAFFPE Tissue Kit(德国Qiagen)、Type-it HRM PCR kit(德国Qiagen);Nanodrop 2000 紫外分光光度计(美国Thermo)。
1.3 方法 按QIAamp DNAFFPE Tissue Kit 说明书操作,提取手术切除后的石蜡包埋组织标本DNA,并保存在-20℃冰箱。DNA 浓度使用Nanodrop 2000 紫外分光光度计测定,DNA 质量经1.5%琼脂糖凝胶电泳鉴定。采用广州好芝生物科技有限公司生产的K-ras 基因突变检测试剂盒,按照说明书直接进行HRM 检测分析。使用Gene Scanning Software 分析HRM 的数据。
1.4 统计学分析 采用SPSS 19.0 软件进行统计分析。计数资料采用频数(百分比)表示,各组间率的比较采用χ2检验;探索K-ras 基因突变的影响因素先采用单因素分析,再进行多因素Logistic 回归分析。以P≤0.05 为差异有统计学意义。
2 结 果
2.1 HRM 分析结果 HRM 曲线结果显示K-ras基因突变率为43.02%(77/179);其余标本均为野生型,见图1。
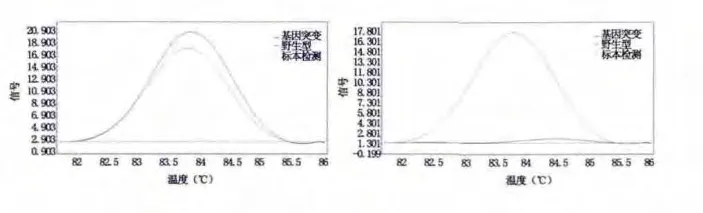
图1 K-ras 基因突变HRM 分析结果Figure 1 The result of K-ras gene mutation
2.2 影响K-ras 基因突变的单因素分析结果 结直肠癌患者K-ras 基因突变与患者年龄相关,但与患者性别、肿瘤分化程度、肿瘤部位及Dukes 分期无关,见表1。
2.3 影响K-ras 基因突变的多因素Logistic 回归分析结果 将单因素分析有统计学意义的因素最终纳入多因素Logistic 回归分析结果显示,年龄对K-ras 基因突变有显著影响(OR=1.506,95%CI:1.028 ~2.011)。
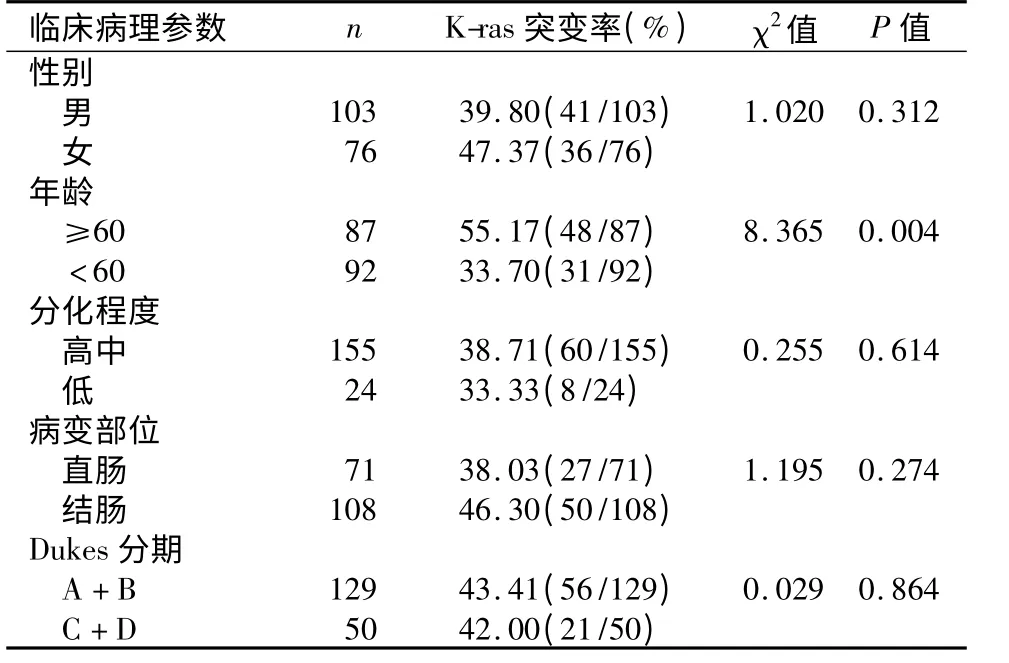
表1 结直肠癌患者K-ras 突变状态与临床病理特征关系Table 1 The relationship between K-ras mutations and clinicopathological features of colorectal cancer patients
3 讨 论
近年来,全球结直肠癌的发病率逐年增加,而K-ras 基因突变在结直肠癌发生、发展中发挥重要的作用已达成共识。而且结直肠癌K-ras 基因状态与抗EGFR 靶向治疗药物疗效有关,因此检测结直肠癌中K-ras 基因状态对指导临床治疗有重要意义。
本研究使用HRM 法检测179 例结直肠癌标本,结果显示K-ras 突变率为43.02%,与Guedes 等[11]研究经HRM 法发现201 例结直肠癌患者K-ras 基因突变率为44.1%的结果较为一致。低于Franklin 等[14]经HRM 法检测118 例结直肠癌样本的K-ras 基因突变率54%,高于其用直接测序法检测出的36%,上述结果也表明HRM 法相对比较灵敏。应用于基因突变检测的方法有很多种,有直接测序法、DxS kit 法、扩增阻碍突变系统(ARMS/S)法、HRM 等,各种方法均有其优缺点。直接测序法最为常用,因其可以直接检出具体碱基突变情况,是金标准。但其成本高,操作步骤多且需严格控制污染。本研究使用新的HRM在检测基因突变方面具有多种优势:无需设计探针、成本低、操作简单、灵敏度高、结果准确、简单快捷、成本低以及闭管操作等。还发现摸索PCR 反应条件、确定判断突变型的阈值是HRM 分析技术的关键,需经过多次优化实验才能产生稳定可靠检测结果。尽管HRM 法优点很多,但不足的是在检测出的突变基因中不能明确具体突变位点及突变类型,而且检测结果会受到一些因素的影响,比如DNA 纯度、镁离子浓度,而这些不足之处正在逐步解决和完善。HRM 法作为“后起之秀”很可能成为一种常用的临床检测手段。
除此之外,K-ras 基因突变与结直肠癌临床生物学行为的相关性也已成为国内外学者研究的热点,目前两者相关性尚无统一定论。在本研究中发现,≥60 岁年龄组结直肠癌患者的K-ras 基因突变率要高于<60 岁年龄组,说明K-ras 基因突变与年龄相关;未发现K-ras 基因突变与性别、肿瘤分布部位及分化程度相关。这些与部分文献报道的研究结果相一致[10-11]。刘伟等[10]研究显示,经基因直接测序280 例结直肠癌患者率为33.57%,低于本研究HRM 法的检测突变率,其中K-ras 基因突变与患者性别、年龄相关,在≥60 岁的女性人群中K-ras 基因具有更高的突变率,与肿瘤分化程度、浸润深度、TNM 分期无相关性。Guedes 等[11]研究发现K-ras基因突变与年龄、肿瘤部位相关,高龄及结肠的K-ras基因突变率较高,与性别及肿瘤分化程度无关。上述研究结果中均提到K-ras 基因突变与年龄相关,与肿瘤分化程度、分期无关,这与本研究结果结论一致。不同的是,本研究未得出K-ras 基因突变与性别、部位相关的结论。另外进行多因素logistic回归分析也提示年龄对K-ras 基因突变有显著影响。关于K-ras 基因突变与临床病理参数的关系,许多报道不尽相同,这可能与检测方法不同、样本量大小、标本存放条件与处理存在差异有关,也可能是因为地区人群的遗传和环境背景不同导致,故仍需大样本多中心的临床随访研究来进一步证实。
[1] Niv Y.Microsatellite instability and MLH1 promoter hypermethylationin colorectal cancer[J].World J Gastroenterol,2007,13(12):1767-1769.
[2] Siegel R,Naishadham D,Jemal A.Cancer statistics,2013[J].CA Cancer J Clin,2013,63(1):11-30.
[3] 刘丽琴,张海燕,吴小丽,等.高分辨率熔解曲线分析法检测非小细胞肺癌KRAS 和BRAF 基因突变[J].临床检验杂志,2012,18(4):253-255.
[4] Bokemeyer C,Bondarenko I,Hartmann JT,et al.Efficacy according to biomarker status of cetuximab plus FOLFOX-4 as firstline treatmentfor metastatic colorectal cancer:the OPUS study[J].Ann Oncol,2011,22(7):1535-1546.
[5] Van Cutsem E,Köhne CH,Hitre E,et al.Cetuximab and chemotherapy as initial treatment for metastatic colorectal cancer[J].N Engl J Med,2009,360(14):1408-1417.
[6] Mannan A,Hahn-Strömberg V.K-ras mutations are correlated tolymph node metastasis and tumor stage,but not to the growth patternof colon carcinoma[J].APMIS,2012,120(6):459-468.
[7] 杨瑞钦,杨春康,徐 可,等.K-ras 基因状态与结直肠癌临床病理特征的关系[J].临床与实验病理学杂志,2013,29(7):741-744.
[8] Poehlmann A,Kuester D,Meyer F,et al.K-ras mutation detection in colorectal cancer using the pyrosequencing technique[J].Pathol Res Pract,2007,203(7):489-497.
[9] Miyoshi Y,Nagase H,Ando H,et al.Somatic mutations of the APC gene in colorectal tumors:mutation cluster region in the APC gene[J].Hum Mol Genet,1992,1(4):229-233.
[10] 刘 伟,王 丽,余英豪,等.K-ras 基因在中国结直肠癌患者中的突变状态[J].世界华人消化杂志,2011,19(13):1367-1374.
[11] Guedes JG,Veiga I,Rocha P,et al.High resolution melting analysis of KRAS,BRAF and PIK3CA in KRAS exon 2 wild-type metastatic colorectal cancer[J].BMC Cancer,2013,13:169.
[12] 王摇漩,王建东,罗春英,等.结直肠癌中K-ras 基因突变的检测及其临床病理学意义[J].医学研究生学报,2013,26(1):19-22.
[13] Pinto P,Rocha P,Veiga I,et al.Comparison of methodologies for KRAS mutation detection in metastatic colorectal cancer[J].Cancer Genetics,2011,204(8):439-446.
[14] Franklin WA,Haney J,Sugita M,et al.Kras mutation:Comparison of testing methods and tissue sampling techniques in colon canner[J].Mol Diagn,2010,12(1):43-50.
[15] 胡 优,何宋兵,朱新国.MicroRNA 与Wnt/β-catenin 通路在大肠癌发生发展中的研究进展[J].医学研究生学报,2014,27(2):187-189.
[16] Patil H,Korde R,Kapat A,et al.KRAS gene mutations in correlation with clinicopathological features of colorectal carcinomas in Indian patient cohort[J].Med Oncol,2013,30(3):617.

