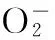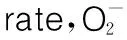杭白菊不同溶剂提取物的抗氧化活性研究
邝春林,吕 都,黄 霞,高 玮,申光辉,张志清
(四川农业大学食品学院,四川雅安 625014)
杭白菊不同溶剂提取物的抗氧化活性研究
邝春林,吕 都,黄 霞,高 玮,申光辉,张志清*
(四川农业大学食品学院,四川雅安 625014)
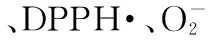
杭白菊,提取物,抗氧化活性,自由基
菊花为菊科植物菊(Chrysanthemummorifolium)的干燥头状花序,《神农本草经》将菊花列于上品,谓其“主风头眩,肿痛,皮肤死肌,目欲脱,恶风湿痹,久服利血气,轻身,耐老,延年”,朴实地载录了本品的重要主治病证及功效[1]。杭白菊主要产地是浙江省桐乡市,为“浙八味”之一,也是国家卫生部第一批批准的药食同源的道地药材之一[2],杭白菊是2010年版《中国药典》收载的正品菊花,是我国菊花的一个重要品种[3]。杭白菊的主要化学成分有挥发油、多酚类、黄酮类、多糖、氨基酸和微量元素等,国内外学者已对菊花的药理作用进行了大量的研究,证实菊花具有抗菌、抗病毒、降低血压、预防高血脂、抗衰老等多种药理活性,部分药理活性与它的抗氧化和清除自由基有关,其中黄酮类是菊花提取物中含量较多的有效成分,具有良好的清除自由基、抗氧化的功能[4]。
机体氧化反应可以产生自由基,在生理情况下自由基不断产生,也不断被清除,其浓度保持着动态平衡,但是过量的自由基对机体有损伤效应[5-7]。传统化学合成抗氧化剂的安全性问题越来越受到人们的重视,在使用上受到限制,很多研究已表明天然提取物有较强的抗氧化能力。Mehmet[8]发现薄荷提取物的清除DPPH自由基的活性优于阳性对照BHT。Masoumeh等[9]在研究艾菊提取物的抗氧化活性时发现其DPPH自由基清除活性比阳性对照 BHT好。叶汉侠等[10]研究表明杭白菊乙醇提取液对DPPH自由基的清除率高达93. 17%,其抗氧化能力是人工合成的TBHQ(叔丁基对苯二酚)的1/10。因此寻求人体容易吸收、能清除体内过量自由基的天然抗氧化剂具有非常重要的意义[11],但是天然抗氧化剂由于提取工艺落后,资源利用率低,我国天然植物的研究主要集中在其溶剂提取部位,对固体残渣的研究比较少;研究方法不全面,同时药理研究实验主要是体外实验,难以评价其体内功效;在有效成分的协同作用、抗氧化机理、构效关系等方面的研究也比较欠缺,加强这些方面研究可为天然植物开发抗氧化剂的应用奠定理论基础[12]。
前人对天然抗氧化剂的研究,多采用水、碱性水溶液、酸性水溶液、乙醇、各种浓度的稀乙醇、丙酮、轻汽油等进行提取,再用氯仿、苯、乙醚、甲醇、乙酸乙酯、石油醚、丁醇等进行萃取,很少直接用不同极性溶剂进行提取,而这种分段萃取的方法可能造成某些极性成分的浸出不完全[13]。本研究直接用不同极性的溶剂对杭白菊活性成分进行提取,避免了某些极性成分浸出不完全的问题。不同化学成分有不同的极性大小,根据相似相溶的原理,采用不同极性溶剂对其进行浸提,可获得具有不同溶解特性的菊花组分。另外前人对于菊花中抗氧化成分的研究主要还是针对某一种或几种成分的抗氧化能力进行分析,而对总提取物抗氧化活性的研究报道很少,而天然抗氧化剂发挥抗氧化活性作用的成分在种类和数量上都比较复杂,因此对总提取物的抗氧化活性的研究显得尤为重要。
1 材料与方法
1.1 材料与仪器
杭白菊 四川省茂源农业科技开发有限公司;1,1-二苯基-2-三硝基苯肼(DPPH)、Tris-HCl盐 Sigma公司;铁氰化钾 天津博迪化工股份有限公司;乙醇、石油醚、乙酸乙酯、无水乙醇、邻苯三酚、硫酸亚铁、三氯化铁、VC、水杨酸、三氯乙酸、磷酸二氢钠、磷酸氢二钠 成都科龙化工试剂厂;二甲基亚砜 天津科密欧化学试剂有限公司。
CP225D型电子天平 北京赛多利斯仪器系统有限公司;KQ5200DB型数控超声波清洗器 昆山市超声仪器有限公司;FW177中药粉碎机 天津市泰斯特仪器有限公司;SCIENTZ-12N冷冻干燥机 宁波新芝生物科技股份有限公司;RE-52AA旋转蒸发器 上海亚荣生化仪器厂;UV-3100紫外可见分光光度计 上海美普达仪器有限公司。
1.2 实验方法
1.2.1 杭白菊粗提物的制备 新鲜杭白菊置于鼓风干燥箱中,45 ℃干燥至恒重,粉碎,过100目筛,密封保存,备用。精确称取20 g杭白菊粉末4份,分别加入300 mL蒸馏水、80%乙醇、乙酸乙酯、石油醚,利用超声波提取3次,每次超声30 min,合并提取液,旋转蒸发浓缩回收溶剂,真空冷冻干燥后分别得到蒸馏水、80%乙醇、乙酸乙酯、石油醚4种溶剂的杭白菊提取物,密封保存备用[14]。
1.2.2 体外抗氧化活性研究
1.2.2.1 总还原能力的测定 分别适量称取杭白菊不同溶剂提取物,用二甲基亚砜溶液溶解,蒸馏水定容,配制成一系列质量浓度分别为 0.2、0.4、0.6、0.8、1.0 mg/mL的待测液,参照文献[15]的方法进行测定。
1.2.2.2 清除DPPH·能力的测定 参照文献[16]的方法,略有改动。取0.5 mL不同质量浓度的待测溶液,分别加入2.0 mL(0.2 mmol/L)DPPH-乙醇溶液,混匀,避光反应30 min,在波长517 nm处测定吸光度,调零用95%乙醇。对照组用2.0 mL 95%乙醇代替DPPH溶液,空白组为2.0 mL DPPH溶液与2.0 mL 95%乙醇混合,VC作为阳性对照,每样品重复实验3次,取平均值。按以下公式计算DPPH·清除率。
式中:I表示清除率(%);Ai为样品组吸光度;Aj为对照组吸光度;Ao为空白组吸光度。
1.2.2.4 清除·OH能力的测定 参照文献[18-19]的方法并略做改进。在10mL的试管中依次加入1.0mLFeSO4溶液(6mmol/L),不同质量浓度的待测溶液1.0mL,再加1.0mLH2O2溶液(6mmol/L),摇匀,静置10min,再加入6mmol/L的水杨酸溶液3.0mL,摇匀,37 ℃恒温水浴锅中反应30min后,于波长510nm处测吸光度,空白试剂代替水杨酸为对照组,空白试剂代替样品为空白组,以VC作为阳性对照,每个样品重复实验3次,取平均值。并按1.2.2.2中的公式计算·OH的清除率。
1.2.3IC50值的测定 以样品的不同浓度值为横坐标x,自由基清除率为纵坐标y进行方程拟合。根据拟合方程计算各提取物清除率的IC50值,即当方程中y取50%时,x对应的数值。
1.3 数据处理
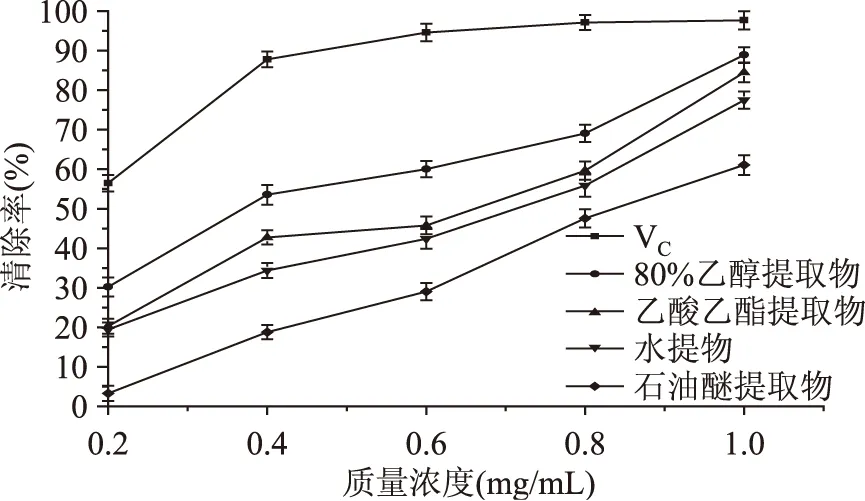
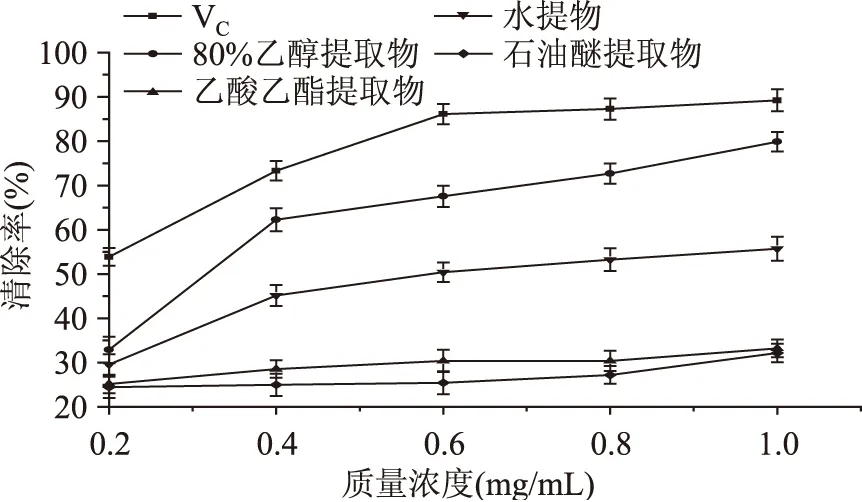
采用Origin8.1及SPSS软件对实验数据进行统计分析,0.01 2.1 杭白菊4种溶剂提取物总还原能力的测定 杭白菊不同溶剂提取物的总还原能力测定结果如图1。由图1可知,在所测定的质量浓度范围内,杭白菊不同溶剂提取物的还原能力随着质量浓度的增加而增强,但与同质量浓度的VC相比较,还原能力较弱。其能力强弱依次为80%乙醇提取物>乙酸乙酯提取物>水提取物>石油醚提取物,当提取物质量浓度为0.6mg/mL时,水提物和乙酸乙酯提取物的还原能力接近(p>0.05),差异不显著。当质量浓度达到1mg/mL时,80%乙醇提取物与乙酸乙酯提取物的还原能力相当,都具有较强的还原能力,差异不显著(p>0.05)。对同一溶剂提取物在不同质量浓度条件下的还原能力进行显著性分析,差异极显著(p<0.01),表明浓度是影响各提取物还原能力的因素。张东娣[20]等研究表明开封产的3种白色菊花不同溶剂提取物还原Fe3+的能力均是甲醇提取物>乙酸乙酯提取物>石油醚提取物,同一种菊花的甲醇提取物具有很好的还原铁离子的能力,而石油醚提取物几乎无活性。而本研究的杭白菊石油醚提取物有活性,可能是由原料本身或者提取方法的差异造成的。综上,杭白菊提取物的还原能力不仅与其提取溶剂有关还与质量浓度有关,原因是不同极性溶剂对抗氧化活性成分的溶解度不同,因此对抗氧化活性成分的提取程度不同;另外,随着提取物质量浓度增加抗氧化活性成分也相应增加,还原能力增强。 图1 杭白菊不同溶剂提取物总还原能力Fig.1 The total reduction abilities of different extracts of Chrysanthemum 2.2 杭白菊4种溶剂提取物对DPPH·的清除作用 由图2可知,杭白菊4种溶剂提取物都具有清除DPPH·的能力,且各提取物在质量浓度0.2~1.0 mg/mL范围内随着质量浓度的增加对DPPH·清除率也随之提高,但均低于同质量浓度的VC的清除率。当质量浓度为1.0 mg/mL时,80%乙醇提取物、水提物和乙酸乙酯提取物的清除率分别为90.47%、72.57%、73.67%,表现出良好的清除DPPH·能力。石油醚提取物的DPPH·清除率最低,在质量浓度为1.0 mg/mL时,清除率仅为27.58%。根据样品清除DPPH·的曲线方程分别计算其IC50值和相关系数r值,结果见表1。 图2 杭白菊不同溶剂提取物对DPPH·的清除作用Fig.2 The effects on scavenging DPPH· of different extracts of Chrysanthemum 由表1可知,80%乙醇提取物、乙酸乙酯提取物、水提物的清除DPPH·的IC50分别为0.33、0.56、0.57 mg/mL,根据IC50值评价杭白菊不同溶剂提取物清除DPPH·能力的强弱,IC50值越小,清除能力越好。DPPH·清除能力大小依次为80%乙醇提取物>乙酸乙酯提取物>水提物。水提物、乙酸乙酯提取物清除DPPH·的IC50分别为0.57、0.56 mg/mL,二者清除DPPH·能力差异不显著(p>0.05),与总还原能力结果一致。石油醚提取物在实验设定的质量浓度范围内清除DPPH·能力相对较弱,清除率小于50%,而VC的清除率均高于50%。周瑞等[21]研究黄参不同溶剂提取物抗氧化活性,结果表明4种溶剂提取物清除DPPH·作用的强弱顺序为:乙酸乙酯提取物>甲醇提取物>正己烷提取物>二氯甲烷提取物,用乙酸乙酯提取得到的提取物清除DPPH·自由基效果最好。原因可能是不同极性溶剂对清除DPPH·的有效成分的溶出不同,原料不同,有效成分的含量也有差异。根据表1的相关性分析可知,80%乙醇提取物、乙酸乙酯提取物、水提物、石油醚提取物的质量浓度与DPPH·清除率的相关系数分别为0.998、0.997、0.993、0.996,表明杭白菊不同提取物清除DPPH·能力与质量浓度之间有良好的相关性,呈剂量依赖性。 表1 杭白菊不同溶剂提取物对·、·OH清除能力的曲线方程、相关系数及IC50值 注:“-”表示样品清除率始终高于或低于50%。 图3 杭白菊不同溶剂提取物对·的清除作用Fig.3 The effects on scavenging · of different extracts of Chrysanthemum 2.4 杭白菊4种溶剂提取物对·OH的清除作用 图4 杭白菊不同溶剂提取物对·OH的清除作用Fig.4 The effects on scavenging·OH of different extracts of Chrysanthemum 朱尚彬等[26]研究黑灵芝不同溶剂提取物的抗氧化活性,结果表明乙酸乙酯提取物表现出最强的活性,其次是水提物。刘曦等[27]对蓝莓叶不同溶剂提取物抗氧化活性进行研究,表明蓝莓叶不同溶剂提取物的抗氧化活性存在较大差异,所得出的其抗氧化能力的顺序为水提取物﹥甲醇提取物﹥乙醇提取物﹥乙酸乙酯提取物﹥氯仿提取物﹥石油醚提取物。刘瑜新[28]对两种开封黄色菊花体外抗氧化活性进行考察发现,随着提取溶剂极性的增大,同种菊花不同溶剂提取物总的抗氧化活性逐渐增大,即甲醇提取物>乙酸乙酯提取物>石油醚提取物。这些差异的原因可能是原料不同抗氧化物质的种类和极性不同,导致不同溶剂提取液中抗氧化物质的种类和量均有所差异,最终在清除自由基能力的强弱上表现出来。秦卫东[29]研究发现,杭白菊抗氧化活性强弱与提取溶剂有关,其中,杭白菊的乙醇提取物抗氧化活性最强,与本研究结果一致。杨英士等[30]对不同溶剂对雪菊萃取效果的影响研究结果表明,不同溶剂对粗提物及雪菊黄酮含量的影响差异显著,甲醇和水的粗提物含量远高于其他几种溶剂提取的,分别为(420±1.63)mg/g和(500±2.94)mg/g;甲醇提取所得黄酮含量远高于其他溶剂,为(32.29±0.08)mg/g;水提取的粗提物含量虽高,但黄酮含量却远低于甲醇提取的,仅为(0.86±0.04)mg/g。因此在评价溶剂提取物时,不仅要考虑提取量,更要考虑有效成分的含量。 本研究结果表明杭白菊乙醇提取物有较强的抗氧化活性,其次是乙酸乙酯提取物,因此在研究天然抗氧化剂时应考虑不同极性萃取剂的提取效果,不能仅限于传统的水提。本研究可为深入探讨杭白菊提取物的抗氧化作用机制和合理开发利用杭白菊资源提供一定的理论依据。 [1]雷载权,张廷模.中华临床中药学[M].北京:人民卫生出版社,1998:321-322. [2]吴晓宁,余陈欢,包启年.杭白菊总黄酮抗炎作用及其机制初探[J].中国临床药理学与治疗学,2009,14(9):1000-1003. [3]孙淑芳.采收时期对4个杭白菊新品种主要活性成分的影响[D].临安:浙江农林大学,2012. [4]查芳芳,高学玲,邹敏亮,等.黄山贡菊高效液相色谱指纹图谱的建立[J].食品科学,2011,32(20):146-150. [5]李君珂,姜子涛,李荣,等.首乌叶黄酮抗氧化性能及清除自由基能力的研究[J].中国食品添加剂,2012(2):69-74. [6]谭冰,严焕宁,廖慧娴,等.广西茉莉花叶总黄酮的提取及对羟自由基的清除作用研究[J].食品科技,2012,37(6):244-246. [7]袁建梅,郭伟云,汪应灵.合欢花中总黄酮的提取工艺及对羟自由基清除作用的研究[J].中国食品添加剂,2012(1):87-91. [8]Mehmet O.Anticholinesterase and antioxidant activities of Savoury(Satureja thymbra L.)with identified major terpenes of the essential oil[J].Food Chemistry,2012,134:48-54. [9]Masoumeh F,Zahra T,Ali S.Essential oil composition and antioxidant of the various extracts of Tanacetum sonbolii Mozaff. (Asteraceae)from Tran[J].Nature Product Research,2012,26(23):2204-2207. [10]叶汉侠,王甫才.18种中草药抗氧化活性的比较研究[J].浙江万里学院学报,2004,17(5):111-113. [11]Vladimiro C,Thaddao W,Maria T,et al. Antioxidant and prooxidant activity behavior of phospholipids in stripped soy bean oil-in-water emulsions[J]. Journal of the American Oil Chemists Society,2011,88(9):409-1416. [12]张桂芝,耿莎,杨海燕,等.植物抗氧化成分的研究进展[J].食品科学,2007,28(12):551-553. [13]曹光明.中药浸提物生产工艺学[M].北京:化学工业出版社,2008:51. [14]张宁.从天然植物金银花叶中提取化妆品防腐剂[D].无锡:江南大学,2008. [15]岳金玫,蒲彪,陈安均,等.不同分子质量块菌多糖的体外抗氧化活性[J].食品科学,2013,34(13):127-131. [16]Fagerlund A,Sunnerheim K,Dimberg L H. Radical-scavenging and antioxidant activity of avenanthramides[J].Food Chemistry,2009,113(2):550-556. [17]高义霞,周向军,杨声,等.不同溶剂提取乳苣的抗氧化作用研究[J].食品工业科技,2012,33(1):85-87. [18]涂宗财,寇玉,王辉,等.荷叶多糖的超声波辅助提取和抗氧化活性[J].食品科学,2013,34(16):108-112. [19]姚兴存,舒留泉,盘赛昆,等.条斑紫菜蛋白提取与抗氧化活性[J].食品科学,2012,33(20):113-118. [20]张东娣,康文艺,刘瑜新,等.开封产3种白色菊花提取物的抗氧化活性[J].精细化工,2009,26(5):464-467. [21]周瑞,田呈瑞,高春燕,等.黄参不同溶剂提取物抗氧化活性研究[J].食品研究与开发,2012,33(8):58-61. [22]Yuan H,Zhang W,Li X,et al. Preparation andinvitroantioxidant activity of kappa-carrageenan oligosaccharides and their oversulfated,acetylated,and phosphorylated derivatives[J]. Carbohydrate Research,2005,340(4):685-692. [23]李姝,周劲帆,吴妮妮,等.玫瑰花、金银花、茉莉花、菊花不同溶剂组分的抗氧化活性研究[J].现代中药研究与实践,2014,28(4):28-31. [25]郭刚军,彭春秀,何享,等.云南普洱茶不同溶剂提取物抗氧化活性研究[J]. 热带作物学报,2013,34(1):151-156. [26]朱尚彬,聂少平,朱盼,等.黑灵芝不同溶剂提取物抗氧化活性比较研究[J].食品科学,2009,30(17):98-101. [27]刘曦,祝连彩,王伯初.蓝莓叶不同溶剂提取物抗氧化活性研究[J].食品工业科技,2013,34(12):101-104. [28]刘瑜新,常星,康文艺.两种开封产黄色菊花的体外抗氧化活性[J].食品工业科技,2009,30(12):85-87. [29]秦卫东.杭白菊提取物抗氧化性能的研究[J].中国食品添加剂,2000,1(4):21-23. [30]杨英士,陈伟,杨海燕,等.昆仑雪菊中2个黄酮类化合物的分离鉴定及其抗氧化活性评价[J].南京农业大学学报,2014,37(4):149-154. Research of the antioxidant activity ofChrysanthemumMorifolium’sextracts with different solvents KUANG Chun-lin,LV Du,HUANG Xia,GAO Wei,SHEN Guang-hui,ZHANG Zhi-qing* (College of Food Science,Sichuan Agricultural University,Ya’an 625014,China) Chrysanthemum;extracts;antioxidant activity;free radical 2015-02-09 邝春林(1989-),女,硕士,研究方向:功能性食品,E-mail:chunlinkuang@163.com。 *通讯作者:张志清(1976-),男,博士,教授,研究方向:粮油副产物开发利用,E-mail:zqzhang721@163.com。 宝兴县-四川农业大学校县合作项目。 TS201.2 A 1002-0306(2015)21-0083-06 10.13386/j.issn1002-0306.2015.21.0082 结果与分析




3 讨论
4 结论