蔗梢多酚类化合物抗氧化与抗肿瘤活性研究
何雪梅,孙 健,,*,李 丽,盛金凤,赵谋明
(1.广西农业科学院农产品加工研究所,广西南宁 530007;2.广西作物遗传改良生物技术重点实验室,广西南宁 530007;3.华南理工大学轻工与食品学院,广东广州 510640)
蔗梢多酚类化合物抗氧化与抗肿瘤活性研究
何雪梅1,2,孙 健1,2,3,*,李 丽1,2,盛金凤1,2,赵谋明3
(1.广西农业科学院农产品加工研究所,广西南宁 530007;2.广西作物遗传改良生物技术重点实验室,广西南宁 530007;3.华南理工大学轻工与食品学院,广东广州 510640)
研究从蔗梢中分离到的8种多酚类化合物的抗氧化活性和抗肿瘤活性。采用DPPH自由基清除能力、氧自由基吸收能力(ORAC)和ABTS自由基清除能力综合评价多酚化合物的体外抗氧化活性,MTT法评价多酚化合物的体外抗肿瘤活性。实验表明,8种化合物中槲皮素的DPPH自由基清除能力显著(p<0.05)高于阳性对照Trolox;咖啡酸抑制CNE2(人鼻咽癌细胞)增殖的活性最强,槲皮素抑制SGC7901(人胃癌细胞株)增殖的活性最强,2-(3,5-二羟苯基)-5-羟基-苯并呋喃和槲皮素能较强地抑制Hela(人宫颈癌细胞株)的增殖。蔗梢中的8种多酚类化合物均具有较强的抗氧化活性和一定的抗肿瘤活性,可作为保健食品和保健品的开发原料。
蔗梢,多酚类化合物,抗氧化活性,抗肿瘤活性
甘蔗是禾本科(Graminaeeae)甘蔗属(SaccharumL.)植物,是我国制糖的主要原料。我国是世界三大甘蔗起源中心之一,目前已成为居巴西、印度之后的世界第三大食糖生产国,其中广西为我国甘蔗第一大省,约占全国总面积的60%[1]。蔗梢,又称甘蔗尾叶,是收获甘蔗时顶上最嫩节和青绿叶片的统称,约占甘蔗生物量的10%,是甘蔗生产中的主要副产物之一。广西每年有几千万吨的蔗梢废弃物,除少部分作饲料和留种以外,大部分被焚烧,既造成严重的空气污染与安全隐患,又浪费资源,开发利用迫在眉睫。
目前甘蔗的精深加工利用多集中在蔗茎、蔗渣和糖蜜等方面,国际上特别是巴西、日本和台湾对甘蔗汁、甘蔗叶以及蔗糖加工中的中间产物和副产物中多酚物质的深入研究较多,发现这几类物质中多酚化合物以酚酸、黄酮和黄酮苷为主,具有抗氧化、抗肿瘤和治疗胃溃疡等功效[2-4]。国内外对蔗梢的研究利用较少,多停留在蔗梢青贮饲料、食用蔗笋、蔗梢汁饮料等初加工方面[5-7]。蔗梢富含多酚,据报道蔗梢虽然只占蔗茎的小部分,但多酚类物质含量比蔗茎还多,且比较集中[8]。目前蔗梢多酚的研究还停留在多酚的提取工艺及含量测定层面,对甘蔗多酚的深入系统研究未见报道。为探明蔗梢多酚的化学组成,前期开展了蔗梢多酚类化合物的分离纯化、结构鉴定,从蔗梢中分离到8种多酚类化合物,并鉴定了其化学结构,此部分工作已另文发表[9]。本文对这8种多酚类化合物的抗氧化和抗肿瘤活性进行研究,以期为蔗梢多酚的开发利用奠定理论基础。
1 材料与方法
1.1 材料与仪器
8种蔗梢多酚类化合物由本实验室分离鉴定[9],分别为4-羟基肉桂酸、芹菜素、咖啡酸、槲皮素、3-异戊烯基-5,7,2′,4′-四羟基黄酮、5′-异戊烯基-5,7,2′,4′-四羟基黄酮、8-(2,4-二羟苯基)-5-羟基-2-甲基-2-(4-甲基戊-3-烯基)-吡喃并苯并吡喃-6-酮、2-(3,5-二羟苯基)-5-羟基-苯并呋喃。
Trolox、AAPH、DPPH、荧光素钠、MTT (四甲基噻唑蓝) 美国sigma公司;顺铂 昆明贵研药业有限公司;细胞:CNE2 (人鼻咽癌低分化鳞状上皮细胞,人鼻咽癌细胞株);SGC7901(人胃癌细胞株),Hela(人宫颈癌细胞株) 由暨南大学医学院提供;所用试剂均为分析纯。
752N紫外可见分光光度计 上海精密科学仪器有限公司;RE-52AA旋转蒸发仪 上海亚荣生化仪器厂;SHZ-82水浴恒温振荡器 金坛市恒丰仪器厂;101-3电热鼓风恒温干燥箱 上海浦东形容科学仪器有限公司;CU600型电热恒温水箱 上海福玛实验有限公司;CO2培养箱 美国Thermo Forma公司;NP-S-15-500超声波生化仪 广东新动力超声电子有限公司;Elx800全自动酶标仪 奥地利DIALAB公司。
1.2 实验方法
1.2.1 蔗梢多酚类化合物抗氧化活性的测定
1.2.1.1 DPPH自由基清除能力测定 用无水乙醇配制浓度为0.2 mmol/L的DPPH自由基溶液,样品组分别加入2 mL样品和2 mL DPPH自由基溶液,对照组加入2 mL 50%乙醇和2 mL DPPH自由基溶液,用涡旋振荡器充分混匀,避光反应30 min后在517 nm处测定吸光度值[10]。
DPPH自由基清除率(%)=[1-(A样品-A对照)/A对照]×100
式(1)
1.2.1.2 氧自由基吸收能力(ORAC)评价 ORAC评价方法参考Joseph等[11]的方法并加以改进。用75 mmol/L磷酸氢二钠-磷酸二氢钠缓冲溶液(pH7.4)配制浓度为39.9 μmol/L的荧光素钠储备液,于4 ℃避光保藏。用75 mmol/L磷酸氢二钠-磷酸二氢钠缓冲溶液(pH7.4)稀释荧光素钠储备液,即得浓度为0.159 μmol/L的荧光素钠使用液。AAPH用75 mmol/L磷酸氢二钠-磷酸二氢钠缓冲溶液(pH7.4)配制浓度为38.25 mmol/L溶液,每次使用的AAPH均为新鲜配制,使用前置于冰水中。精确称取Trolox,用无水乙醇配成2 mmol/L溶液,并用75 mmol/L磷酸氢二钠-磷酸二氢钠缓冲溶液(pH7.4)稀释成不同浓度。
预先将酶标仪预温至37 ℃,保持反应体系温度恒定为37 ℃。设定激发波长为485 nm,发射波长为530 nm。在96孔板中,每孔加入25 μL样品溶液或Trolox溶液,空白对照为缓冲溶液,然后加入75 μL荧光素钠使用液,将板放入酶标仪中,37 ℃孵育10 min。加100 μL AAPH后,开始计时反应并读数(f0),每分钟读一次数(f1,f2,…,f70),共读71次(共计时反应70 min),将每次读数连成曲线。每个样品设置3个重复孔,AUC表示曲线下的面积。
AUC=0.5(f0+fn)+(f1+f2+…+fi+…+fn-1)
式(2)
Net AUC=AUCsample-AUCblank
式(3)
Trolox浓度与其Net AUC成正比,将样品Net AUC代入,换算得到ORAC值,即样品相当于Trolox的量(μmol Trolox 当量/μmol)。
1.2.1.3 ABTS自由基清除能力测定 实验参考Cao[12]、Smith[13]的方法并加以改进,将ABTS溶解在2.45 mmol/L K2S2O8水溶液中,配成7 mmol/L的溶液,避光放置12~16 h,得到ABTS+·储备溶液。用磷酸钠缓冲液(10 mmol/L)将ABTS+·储备溶液稀释至吸光度值为0.70±0.02(734 nm),即得ABTS+·工作液。取100 μL样品溶液于10 mL试管中,加入4 mL ABTS+·工作液,漩涡震荡30 s,于734 nm测吸光度值。
ABTS自由基清除率(%)=[1-(A样品-A对照)/A对照]×100
式(4)
1.2.2 蔗梢多酚类化合物体外抗肿瘤活性 CNE2、SGC7901、Hela接种在含10%胎牛血清的DMEM培养基中,于37 ℃、5%CO2培养箱中培养。取对数生长期细胞,用0.25%胰蛋白酶消化后,接种于96孔细胞培养板上(3×104cells/mL),每孔100 μL。置37 ℃、5%CO2培养箱中培养24 h后,实验组分别加入样品,对照组则加入等体积溶剂,每组3孔,重复3次。在37 ℃、5%CO2培养箱中培养3 d,加入MTT(5 mg/mL)20 μL继续培养4 h,弃上清,加入DMSO 150 μL,震荡15 min,以酶标仪在490 nm处测各孔吸光度值,按下式计算药物对肿瘤细胞生长的抑制率[14-15],利用对数几率图解法计算样品的半数抑制浓度(IC50)。
肿瘤细胞生长抑制率(%)=1-A490(实验组)/A490(对照组)×100
式(5)
2 结果与讨论
2.1 蔗梢多酚化合物的抗氧化活性

图1 蔗梢中8中多酚化合物的化学结构Fig.1 Chemical structure of eight polyphenol compounds from sugarcane tops
8个多酚化合物的抗氧化实验结果见表1。实验中的8个化合物的结构鉴定过程已另文发表[9],化学结构见图1,主要有酚酸类、黄酮类和苯并呋喃类三种,从结构上看,多酚类化合物是指分子结构中有若干个酚性羟基的植物成分的总称,包括酚酸和黄酮类化合物。黄酮类化合物泛指两个具有酚羟基的苯环(A-与B-环)通过中央三碳原子相互连结而成的一系列化合物,其化学结构骨架为C6-C3-C6。苯并呋喃类的化学骨架为C6-C3。其中咖啡酸和4-羟基肉桂酸为酚酸类,槲皮素、芹菜素、8-(2,4-二羟苯基)-5-羟基-2-甲基-2-(4-甲基戊-3-烯基)-吡喃并苯并吡喃-6-酮、3-异戊烯基-5,7,2′,4′-四羟基黄酮、5′-异戊烯基-5,7,2′,4′-四羟基黄酮为黄酮类,2-(3,5-二羟苯基)-5-羟基-苯并呋喃为苯并呋喃类。
从表1中可以看出,化合物抗氧化能力的大体趋势为,黄酮类>酚酸类>苯并呋喃类,其中,槲皮素、咖啡酸和5′-异戊烯基-5,7,2′,4′-四羟基黄酮的DPPH自由基清除率显著(p<0.05)高于阳性对照Trolox,芹菜素和8-(2,4-二羟苯基)-5-羟基-2-甲基-2-(4-甲基戊-3-烯基)-吡喃并苯并吡喃-6-酮与Trolox无显著性差异(p>0.05),4-羟基肉桂酸、3-异戊烯基-5,7,2′,4′-四羟基黄酮、2-(3,5-二羟苯基)-5-羟基-苯并呋喃显著低于Trolox(p<0.05);咖啡酸、槲皮素、芹菜素、3-异戊烯基-5,7,2′,4′-四羟基黄酮的ABTS自由基清除率与阳性对照Trolox无显著性差异(p>0.05),其他化合物的ABTS自由基清除率显著低于Trolox(p<0.05);5′-异戊烯基-5,7,2′,4′-四羟基黄酮的ORAC值显著高于其他化合物(p<0.05)。多酚类化合物结构特点是苯基上连接有多个羟基,易失去羟基上的质子,其抗氧化能力依赖于失去H质子后,所形成苯氧自由基的稳定性,化合物中的共轭结构越大,其苯氧自由基越稳定[16-17]。因此,多酚类化合物抗氧化能力的高低与所含羟基的数量及邻苯二酚结构的数量有关,这也解释了本文中的实验结果,黄酮类化合物所含的酚羟基较多,其次是酚酸类,最后是苯并呋喃类。在这8个蔗梢多酚类化合物中,槲皮素和咖啡酸含有邻苯二酚结构,实验结果证实,综合来看这两种化合物的抗氧化活性较其他化合物强。
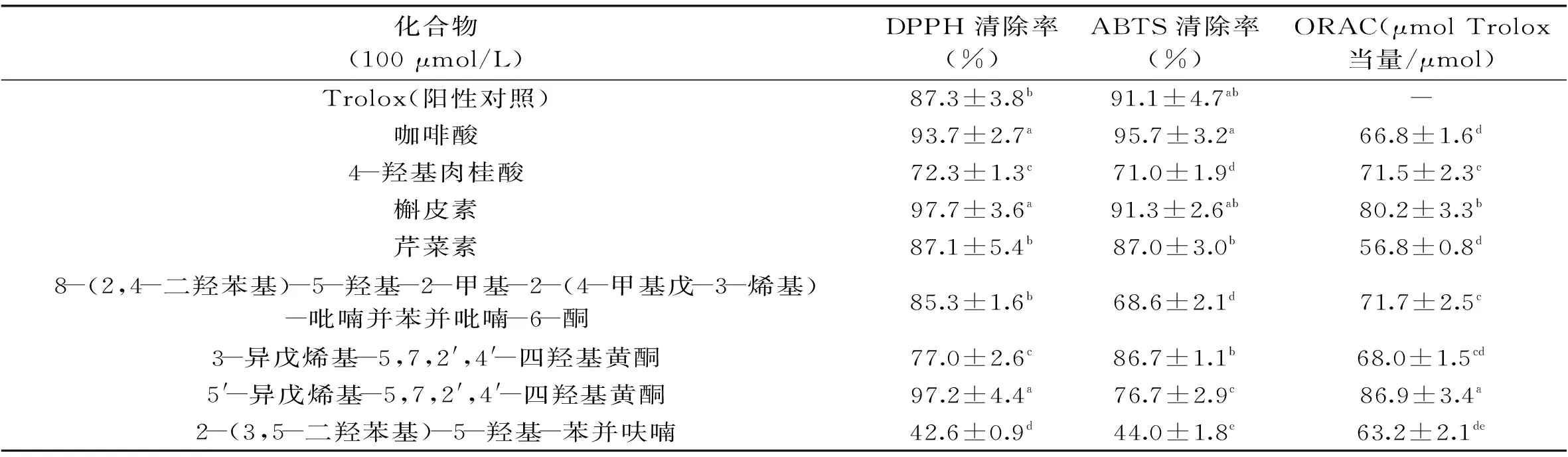
表1 8个蔗梢多酚类化合物的抗氧化活性
注:同列两组数据间标注字母不同者,表示两组数据有显著性差异(p<0.05),表2同。

表2 8个蔗梢多酚化合物单体的抗肿瘤活性
2.2 蔗梢多酚化合物的抗肿瘤活性
本实验选择了三种常见的肿瘤细胞考察蔗梢多酚化合物的抗肿瘤活性,具体结果见表2。实验结果表明,几种化合物对不同的肿瘤细胞表现出不同的抑制增殖能力。咖啡酸抑制CNE2(人鼻咽癌细胞株)增殖的活性显著高于其他7种化合物,但显著低于对照顺铂(p<0.05),而且在抑制其他两种肿瘤细胞增殖时表现并不突出。槲皮素能有效地抑制SGC7901(人胃癌细胞株)的增殖,抑制活性与顺铂无显著性差异(p>0.05);2-(3,5-二羟苯基)-5-羟基-苯并呋喃和槲皮素能有较强地抑制Hela(人宫颈癌细胞株)的增殖,但抑制活性显著低于顺铂(p<0.05)。综合本文8种多酚化合物的抗肿瘤活性,发现槲皮素的综合抗肿瘤活性最高。已有研究表明槲皮素能在毫摩尔浓度直接抑制皮肤肿瘤、白血病、结肠癌、肝癌、胃癌、肺癌、乳腺癌、前列腺癌、卵巢癌和结肠癌等多种肿瘤细胞的增殖[20]。银合欢种子中槲皮素对人肝癌细胞株BEL7404、人胃癌细胞株SGC7901及人鼻咽癌细胞株CNE的增殖具有抑制作用[21]。槲皮素抗肿瘤作用的机理已有深入研究,槲皮素可特异性地诱导人HeLa细胞凋亡,其诱导凋亡的机制可能与caspase-3、caspase-8活化有关[22],通过诱导细胞周期停滞和细胞凋亡而抑制肝癌HepG2细胞增殖[23]。槲皮素能够有效抑制胃癌SGC-7901的生长,呈时间剂量依赖性,抑制增生与诱导凋亡的机制可能与HSP70和EGFR表达的下调有关[24],王海燕等发现,槲皮素通过降低C-myc蛋白表达和促进P16蛋白表达,下调C-myc mRNA的表达的同时上调P16 mRNA的表达,来抑制胃癌MGC-803细胞的生长并诱导其发生凋亡,表现出抗肿瘤效应[25]。
多酚类化合物因结构中取代基不同,其抗肿瘤活性有很大差异,构效关系非常复杂,主要集中在羟基的位置和数量、双键的位置上。以黄酮为例,分子中含有2~4个酚羟基、C环2,3为双键、B环定位于2位、含有邻苯二酚结构,是其关键的结构-效应元件,具有这些元件的黄酮其抗肿瘤活性较强,反之则无抗肿瘤活性[18-19]。本文的实验结果与上述规律也有一定程度符合,槲皮素含有邻苯二酚,且酚羟基数量为5个,C环2,3为双键结构;咖啡酸和2-(3,5-二羟苯基)-5-羟基-苯并呋喃也具有邻苯二酚结构,酚羟基数量为3个。这也从结构上解释了其抗肿瘤活性较强的原因。
3 结论
从蔗梢多酚提取物中分离到的8种多酚化合物具有较好的抗氧化活性和一定的抗肿瘤活性。槲皮素、咖啡酸和5′-异戊烯基-5,7,2′,4′-四羟基黄酮的DPPH自由基清除率显著高于阳性对照Trolox(p<0.05),咖啡酸、槲皮素、芹菜素、3-异戊烯基-5,7,2′,4′-四羟基黄酮的ABTS自由基清除率与阳性对照Trolox无显著性差异(p>0.05),5′-异戊烯基-5,7,2′,4′-四羟基黄酮的ORAC值显著高于其他化合物(p<0.05)。咖啡酸抑制CNE2增殖的活性最强,槲皮素抑制SGC7901增殖的活性最强,2-(3,5-二羟苯基)-5-羟基-苯并呋喃和槲皮素能较强地抑制Hela的增殖,但它们抑制肿瘤细胞增殖的能力显著低于阳性对照顺铂(p<0.05)。从化学结构上看,多酚类化合物抗氧化和抗肿瘤活性的高低与所含羟基的数量及邻苯二酚结构的数量有关。
[1]侯佳. 广西甘蔗糖业产业竞争力研究[D].南宁:广西大学,201,12-14.
[2]Nagai Y,Mizutani H T,Wabe L,et al.Physiological Functions of Sugarcane Extracts[J]. Sugar Industry Technologists 60th Annual Meeting,Taipei,2001,14-19.
[3]Duarte-Almeida J M,Salatino A,Genovese M I,et al. Phenolic Composition and Antioxidant Activity of Culms and Sugarcane(SaccharumofficinarumL.)Products[J]. Food Chemistry,2011,125:660-664.
[4]Duarte-Almeida J M,Novoa A V,Linares A F,et al. Antioxidant Activity of Phenolics Compounds from Sugar Cane(SaccharumofficinarumL.)Juice[J]. Plant Foods for Human Nutrition,2006,61:187-192.
[5]韦正宇,蒋柳平. 甘蔗尾叶加尿素育肥本地水牛实验报告[J]. 广西畜牧兽医,2002,18(2):4-6.
[6]李乔仙,高月娥,尚德林,等. 云南甘蔗稍饲用现状及其青贮营养成分测定[J]. 养殖与饲料,2011,10:45-47.
[7]保国裕. 从甘蔗中提制若干保健品的探讨(上)[J]. 甘蔗糖业,2003(1):40-46.
[8]张业辉. 蔗梢中氨基酸的提取分离研究[D]. 南宁:广西大学,2007,36-49.
[9]Sun J,He X M,Zhao M M,et al. Antioxidant and Nitrite-scavenging Capacities of Phenolic Compounds from Sugarcane(SaccharumofficinarumL.)Tops[J]. Molecules,2014,19:13147-13160.
[10]Kadam U S,Ghosh S B,Strayo D,et al. Antioxidant Activity in Sugarcane Juice and Its Protective Role Against Radiation Induced DNA Damage[J]. Food Chemisty,2008,106:1154-1160.
[11]Joseph A P,Charles G S,Dennis S. Application of Manual Assessment of Oxygen Radical Absorbent Capacity(ORAC)for Use in High Throughput Assay of “Total” Antioxidant Activity of Drugs and Natural Products[J]. Journal of Pharmacol Toxicol Methods,2006,54:56-61.
[12]Cao G. Antioxidant and Prooxidant Behavior of Flavonoids Structure-activity Relationshio[J]. Free Radical Biology & Medicine,1997,22(5):749-760.
[13]Smith M,Zhu X. Increased iron and free radical generation in preclinical Alzheimer disease and mild cognitive impairment[J]. J Alzheimers Dis 2010,19(1):363-372.
[14]邓家刚,郭宏伟,侯小涛,等. 甘蔗叶提取物的体外抗肿瘤活性研究[J]. 辽宁中医杂志,2010,37(1):32-34.
[15]江恒,苏纪平,方锋学,等. 甘蔗叶多糖的提取分离及体外抗肿瘤作用研究[J]. 临床合理用药,2012,5(5C):28-31.
[16]Zhang H Y. Sturcture-activity Relationships and Rational Design Strategies for Radical-scavenging Antioxidants[J]. Current Computer-Aided Drug,2005,1(3):257-273.
[17]Chen Z Y,Ren J,Li Y Z,et al. Study on the Multiple Mechanisms Underliying the Reaction between Hydroxyl Radical and Phenolic Compounds by Qualitative Structure and Activity Relationship[J]. Bioorganic & Medicinal Chemisty Letters,2002,10(2):4067-4073.
[18]杨志峰,朱英,李珊珊.植物黄酮的抗肿瘤作用及其构效关系的研究所进展[J]. 四川中医,2011,29(9):35-39.
[19]常微. 植物黄酮抗肿瘤效应的结构一效应关系及ROS相关作用机制研究[D]. 重庆:第三军医大学,2008.
[20]舒毅,谭陶,张思宇,等. 槲皮素的药理学研究进展[J]. 华西药学杂志,2008,23(6):689-691.
[21]周江煜,王礼蓉,杜正彩,等. 银合欢种子中槲皮素对BEL7404、SGC7901及CNE的抑制作用研究[J].广西中医学院学报,2012,15(2):50-53.
[22]顾超,徐水凌,唐文稳,等. 槲皮素诱导HeLa细胞凋亡及caspase-3、caspase-8活化对凋亡影响的研究[J].中国药学杂志,2011,46(8):595-599.
[23]赵旭林,徐国昌,贺利民,等. 槲皮素诱导人肝癌HepG2细胞凋亡的实验研究[J].实用心脑肺血管病杂志,2010,18(3):310-311.
[24]向廷秀,陶小红,姜政,等. 槲皮素对SGC-7901胃癌细胞生长及HSP70和EGFR表达的影响[J].西安交通大学学报(医学版),2007,28(4):411-414.
[25]王海燕,郭良淼,陈勇,等. 槲皮素抑制人胃癌MGC-803细胞增殖并诱导其凋亡的研究[J].细胞与分子免疫学杂志,2006,22(5):585-587.
Antioxidant and antitumor activities of polyphenol compounds from sugarcane top
HE Xue-mei1,2,SUN Jian1,2,3,*,LI Li1,2,SHENG Jin-feng1,2,ZHAO Mou-ming3
(1.Agro-food Science and Technology Research Institute,Guangxi Academy of Agricultural Sciences,Nanning 530007,China;2.Guangxi Crop Genetic Improvement Laboratory,Nanning 530007,China;3.College of Light Industry and Food,South China University of Technology,Guangzhou 510640,China)
The antioxidant and antitumor biological activities of eight polyphenol compounds which were separated from sugarcane top were studied. The test results showed that DPPH radical scavenging activity of quercetin was significantly higher (p<0.05)than that of positive control Trolox. Caffeic acid showed the strongest inhibiting activity on CNE2 proliferation. Quercetin exhibited the strongest inhibiting activity on SGC7901 proliferation. 2-(3,5-Dihydroxy phenyl)-5-hydroxy-benzofuran and quercetin possessed stronger inhibiting activity on Hela proliferation. Eight polyphenolic compounds of sugarcane top exhibited good antioxidant activities and antitumor activities,indicated that sugarcane top would be good material for health products and health foods.
sugarcane top;polyphenol compounds;antioxidant activities;antitumor activities
2015-05-13
何雪梅(1981-),女,博士研究生,助理研究员,主要从事天然药物化学研究,E-mail:xuemeihe1981@126.com。
*通讯作者:孙健(1978-),男,博士,研究员,主要从事农产品贮藏加工研究,E-mail:jiansun@gxaas.net。
广西农业科学院基本科研业务专项(桂农科2013YM03;桂农科2014YQ04);公益性行业(农业)科研专项经费项目(201403064);2014年中央财政农业技术推广服务资金项目(桂财农函[2014]294号);广西科学研究与计划开发计划项目(桂科合14123001-10);2011年度留学人员科技活动项目择优资助经费(桂人社办发[2012]250号) 。
TS201.4
A
1002-0306(2015)23-0343-05
10.13386/j.issn1002-0306.2015.23.063

