山药黏蛋白的两种提取工艺及其对食道癌细胞的抑制
戴 榕,孔得信,李宗羽,包向男,郭小华,刘 虹
(中南民族大学,南方少数民族地区生物资源保护与综合利用工程中心,湖北武汉 430074)
山药黏蛋白的两种提取工艺及其对食道癌细胞的抑制
戴 榕,孔得信,李宗羽,包向男,郭小华,刘 虹*
(中南民族大学,南方少数民族地区生物资源保护与综合利用工程中心,湖北武汉 430074)
本实验以恩施州红细毛山药为实验材料,探索了从山药全粉中提取山药黏蛋白的工艺,比较了酶解絮凝法和传统的水提醇沉法两种工艺的优劣,并研究了山药黏蛋白对人食道癌细胞EC-109的抑制作用。实验结果如下:水提醇沉法最高得率为1.98%,最适料液比为1∶25、浸提温度45℃、浸提时间2h;酶解絮凝法得率最高达4.25%,絮凝时最适pH为9、壳聚糖最适浓度为10g/L。利用提取的山药黏液蛋白作用于人食道癌细胞EC-109的实验结果表明,五种稀释浓度的黏液蛋白对肿瘤细胞均有一定的抑制效果,在200倍稀释情况下,对EC-109的抑制作用最明显。
山药黏液蛋白,提取工艺,食道癌细胞
山药为薯预科植物薯蓣(Dioscorea opposita),属多年生缠绕草木植物,又名山芋、苹茹,药食两用,块茎富含山药黏液蛋白[1]。黏蛋白是目前公认的山药主要有效成分,也是山药化学和药理研究的重点和热点[2]。山药黏液蛋白的组成和结构比较复杂,与山药多糖组成蛋白-多糖复合体[3]。山药黏液蛋白具有抗氧化、抗衰老、抗突变作用,能够降低血糖、调节免疫功能和抗肿瘤,具有预防心血管系统脂肪沉淀、保持血管弹性、防止动脉粥样硬化等功效,并能减少皮下脂肪沉淀,避免人体出现肥胖[4-6],因此,山药黏液蛋白质对冠心病患者极为有益。山药黏液蛋白具有热不稳定性,与多糖的分离比较困难。国内外对山药黏液蛋白的提取进行了广泛研究[7-10],但很少研究成果能够实现产业化,多停留在实验室阶段,且存在有机溶剂残留量大、多糖得率低和成本高等问题,如传统的多糖提取水提醇沉法[11]。如何采用先进技术、低成本、高效产业化生产黏液蛋白成为山药产品开发的关键问题。
本研究采用传统的水提醇沉法和酶解絮凝法两种不同工艺,从恩施州本土山药品种红细毛山药全粉中快速提取山药黏液蛋白。在比较了两种工艺优劣的基础上,进行了四因素四水平正交分析,探索了山药黏液蛋白的高效提取技术。食道癌是常见和危害性极严重的恶性肿瘤之一,世界各国均有发现且呈区域性高发,目前正严重威胁着人类的健康[12-13]。在获得黏液蛋白冻干粉以后,我们验证了山药黏蛋白对人食管癌细胞EC-109的抑制作用,在癌症高发生率的21世纪,山药黏蛋白的抗癌作用无疑可以极大的提高该工艺的商业价值,帮助此工艺推广。
1 材料与方法
1.1 材料与仪器
山药全粉 恩施州湖北汇龙食品有限责任公司提供;人食管癌细胞EC-109系 湖北省肿瘤医院提供;食品级壳聚糖 购自武汉祥和精细化工有限公司;高温α-淀粉酶 购自北京双旋微生物培养基制品厂,活力单位3000-5000,CM:02-42;RPMI 1640培养基、胎牛血清 均购自于BD公司。
FA1004电子天平 上海舜宇恒平科学仪器有限公司;HHW21.600型恒温水浴锅 天津泰斯特仪器有限公司;101-OAB型电热鼓风干燥箱 天津市泰斯特仪器有限公司;L2S紫外分光光度计 上海仪电仪器分析总厂;FD-ID-50冷冻干燥机 北京博医康实验仪器有限公司;AVANTI J-E高速离心机 美国贝克曼库尔特有限公司。
1.2 实验方法
1.2.1 分离蛋白的提取工艺流程 水提醇沉法:山药粉过筛→浸提→离心分离→收集上清→异丙醇沉淀→离心分离→收集沉淀→真空干燥→山药黏液蛋白。
酶解絮凝法:山药粉过筛→浸提糊化→酶解→静置沉淀→收集上清→pH调整→壳聚糖絮凝→静置沉淀→收集沉淀→真空干燥→山药黏液蛋白。
1.2.2 提取工艺最优参数的确定
1.2.2.1 水提醇沉法 浸提料液比、浸提温度、浸提时间的实验因素水平设计见表1。每个实验组合均称取100目过筛后的山药全粉100g,采用5种不同料液比,45℃提取2h;采用5种不同温度,料液比1∶15g/mL,浸泡2h;料液比1∶25g/mL,45℃下浸泡不同时间。然后6000×g离心10min,收集上清;在上清液中加入3倍体积的异丙醇,连续搅拌30min,静止过夜后,重复上一离心步骤,收集沉淀,真空冷冻干燥并称重,计算山药黏蛋白得率[11]。每组实验重复三次,根据得率的高低选择最佳浸提料液比、浸提温度和浸提时间参数。

表1 实验因素水平设计表Table 1 Level design of experimental factors
1.2.2.2 酶解絮凝法 酶解过程:称取山药全粉1kg,100目过筛后,加30L 1%的氯化钠溶液,边加热边搅拌,升温至60℃并维持搅拌2h;按照50g的山药全粉中加入0.5g高温α-淀粉酶的比例[8],加入时样品仍保持在恒温水浴锅中,继续搅拌1h,使黏液蛋白充分溶出;室温条件下自然沉降,选取含有黏液蛋白的上清溶液(即发酵液)备用。
絮凝最适pH的确定:在1000mL三角瓶中,分别取250mL发酵液,调节pH至4.0,5.0,6.0,7.0,8.0,9.0,10.0,各加入10g/L壳聚糖溶液溶液,使其终浓度分别为1.0g/L,恒温摇床200r/min震荡5min,倒入50mL沉降试管(3.4cm × 14cm),室温静止60min,去上清,收集沉淀,5000r/min离心5min,并将沉淀在60℃烘干至恒重,弃上清,收集沉淀真空冷冻干燥后称重,计算山药黏蛋白得率。每个实验重复三次。
壳聚糖浓度的确定:在絮凝最适pH确定后,添加壳聚糖至发酵液中,使溶液终浓度分别为0.2,0.4,0.6,0.8,1.0g/L,其余操作同上,收集沉淀真空冷冻干燥后称重,计算山药黏蛋白得率,根据得率大小选取最适的壳聚糖添加量。每个实验重复三次。
1.2.2.3 黏液蛋白提取率的测定 两种不同提取方法获得山药粘蛋白沉淀后,在-60℃进行真空冷冻干燥,真空4~5Pa持续24h。山药黏液蛋白得率(%)=黏液蛋白总蛋白质量/原料总质量×100。
1.2.3 山药黏液蛋白对人食管癌细胞EC-109的抑制及显微观察 人食管癌细胞EC-109的培养:细胞贴壁生长后,置于含体积比10%胎牛血清的RPMI 1640培养基中常规培养,培养箱CO2浓度为5%(体积比),37℃培养,3~4d传代1次,取对数期生长的细胞用于实验。
收集真空冷冻干燥后的山药黏液蛋白,用50mmol/L的磷酸缓冲液将山药黏蛋白干粉稀释成5种不同浓度的黏蛋白溶液(0.005、0.0025、0.00167、0.00125、0.001mg/mL),各取100μL,分别作用于100μL培养好的对数期人食管癌细胞EC-109(3×103个细胞),每隔12h取样,用MTT法测得490nm处吸光值。用100μL无菌水作用于等体积的人食管癌细胞EC-109作为空白对照,并计算不同浓度的山药黏液蛋白溶液在各个时间内对癌细胞的抑制率,癌细胞生长抑制率根据公式IR(%)=(1-实验组OD值/对照组OD值)×100来计算。每个实验重复五次。
黏蛋白溶液作用于人食管癌细胞EC-109 72h后,取不同处理组细胞及对照组细胞常规制片,置于普通光学显微镜下观察并拍照记录细胞生长形态。
1.2.4 统计学处理 应用SPSS19.0软件对所有数据进行统计学处理,结果以(x±s)表示,两组间均数比较用t检验,多组间均数比较采用单因素方差分析。以p<0.05为差异有统计学意义。
2 结果与分析
2.1 水提醇沉法
2.1.1 料液比对山药黏液蛋白得率的影响 5种浸提料液比对山药黏液蛋白得率的影响结果见图1。由图可知,随着料液比的逐步增大,得率逐步上升,在料液比1∶25g/mL时,山药黏液蛋白得率最高,接近2%。但是料液比为1∶30g/mL时,山药黏液蛋白得率有下降趋势,这可能是由于过高的料液比使得溶液粘稠度增大,得率下降。1∶25g/mL的料液比为浸提最适料液比。

图1 浸提料液比对山药黏液蛋白得率的影响Fig.1 Influence of extracting water-material ratio on the yield of yam mucus protein
2.1.2 浸提温度对山药黏液蛋白得率的影响 5种浸提温度对山药黏液蛋白得率的影响结果见图2。由图可知,45℃时,山药黏液蛋白得率最高,达到1.5%,45℃为浸提提取最适温度。
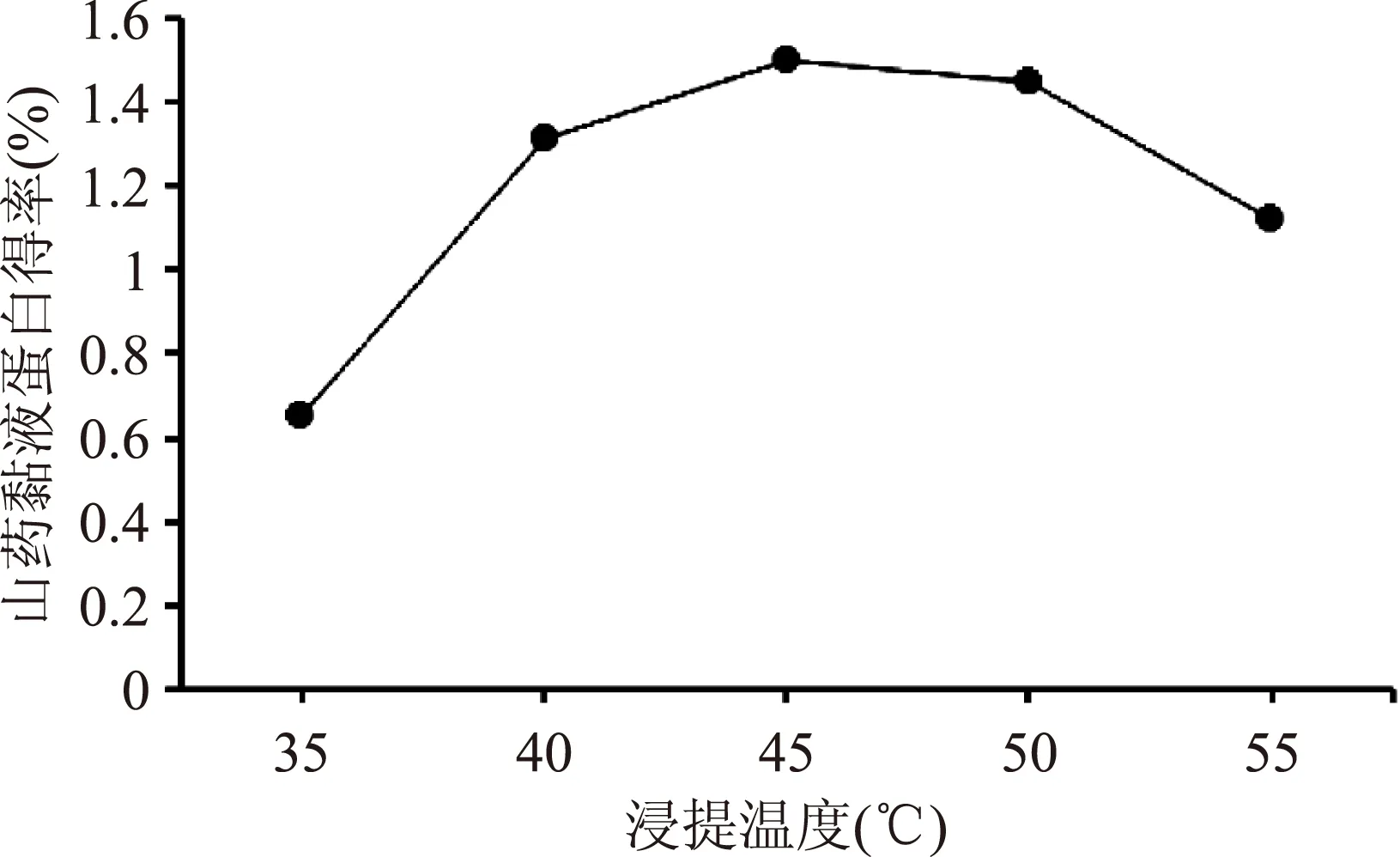
图2 浸提温度对山药黏液蛋白得率的影响Fig.2 Influence of extracting temperature on the yield of yam mucus protein
2.1.3 浸提时间对山药黏液蛋白得率的影响 5种浸提时间对山药黏液蛋白得率的影响结果见图3。由图可知,浸提时间在2h以前,随着时间的延长得率明显增加,2h以后的得率虽然有增加趋势,但几乎保持在同一直线,从经济节约角度考虑,拟定浸提时间2h为最适浸提时间。

图3 浸提时间对山药黏液蛋白得率的影响Fig.3 Influence of extracting time on the yield of yam mucus protein
2.2 酶解絮凝法
2.2.1 絮凝pH的确定 如图4所示,酶解絮凝中上清液的pH在4至9时,随着pH的升高,山药黏液蛋白的得率显著提高,在pH为9时黏液蛋白的得率最高,达到3.95%,pH进一步升高时得率呈下降趋势,分析其原因可能是pH的变化使山药黏液蛋白的电荷属性发生变化,影响了黏蛋白与壳聚糖的结合,导致山药黏液蛋白得率下降。从实验结果可知,酶解絮凝最适pH为9。
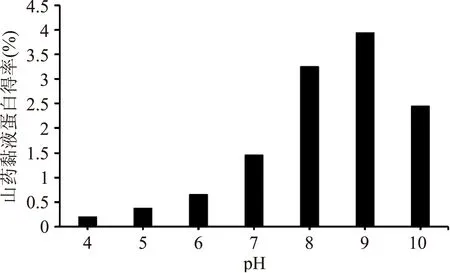
图4 pH对山药黏液蛋白得率的影响Fig.4 Influence of pH on the yield of yam mucus protein
2.2.2 壳聚糖浓度的确定 发酵液中五种不同浓度的壳聚糖添加量对山药黏液蛋白得率的影响如图5所示。由实验结果可知,发酵液中壳聚糖添加的最适宜浓度为0.8g/L,浓度为1.0g/L时得率呈下降趋势,分析其原因可能是壳聚糖添加过量后体系黏度随着增加,降低了分子间的接触能力,导致得率降低[14]。
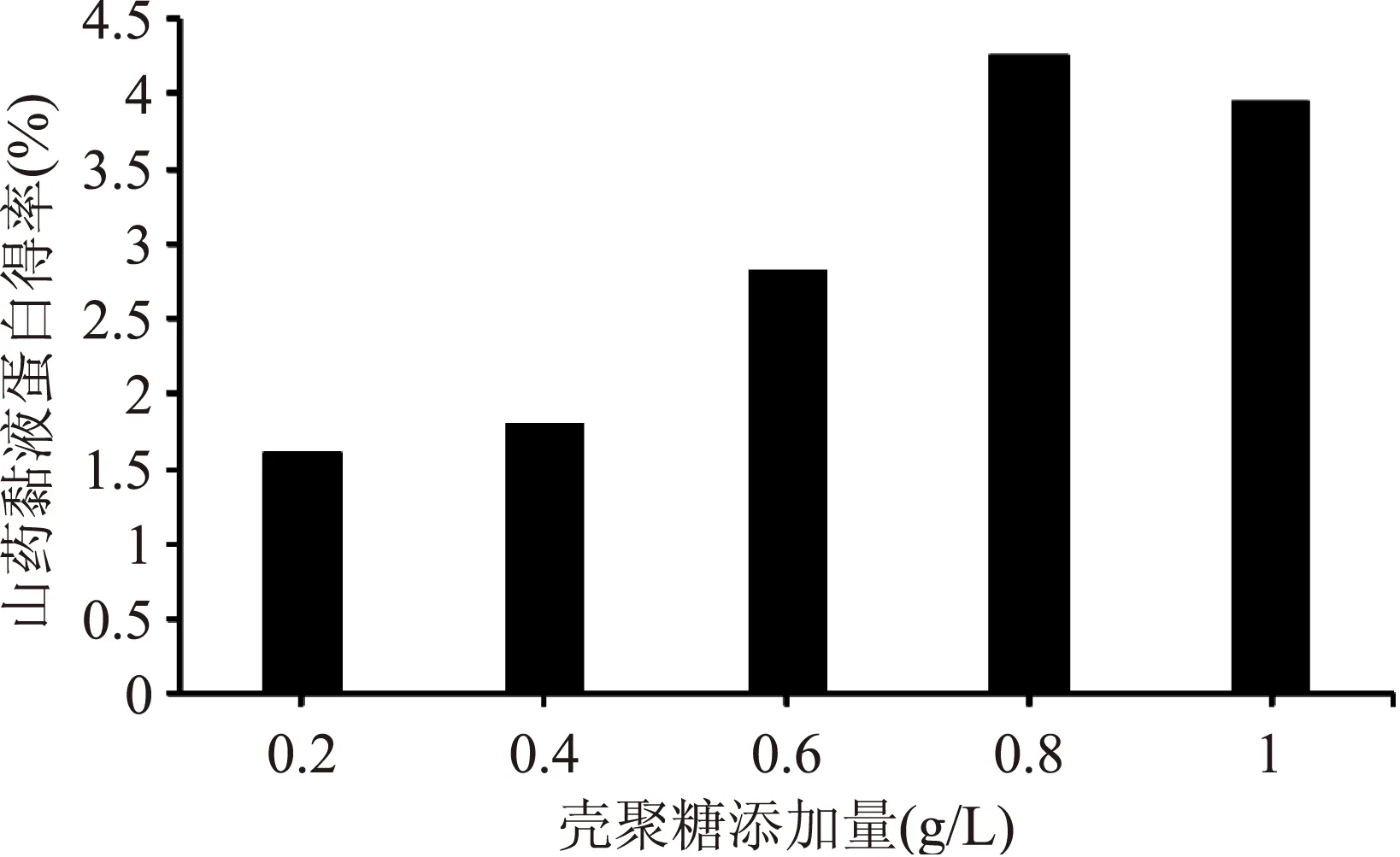
图5 发酵液中壳聚糖的浓度对黏液蛋白得率的影响Fig.5 Influence of chitosan on the yield of yam mucus protein
2.3 两种提取方法的统计学分析及最佳参数的确定
从表2,表3可知,水提醇沉和酶解絮凝两种提取方法中,料液比、浸提温度、浸提时间、絮凝pH、壳聚糖终浓度这五个因素的p值均小于0.01,表明料液比、浸提温度、浸提时间、絮凝pH、壳聚糖终浓度对山药黏蛋白的得率有极显著影响。
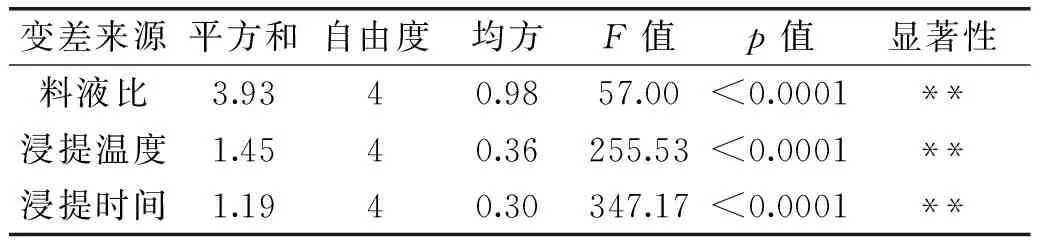
表2 水提醇沉法的因素方差分析表Table 2 ANOVA table of the method of water extraction and alcohol precipitation
注:**表示极显著(p<0.01),表3同。
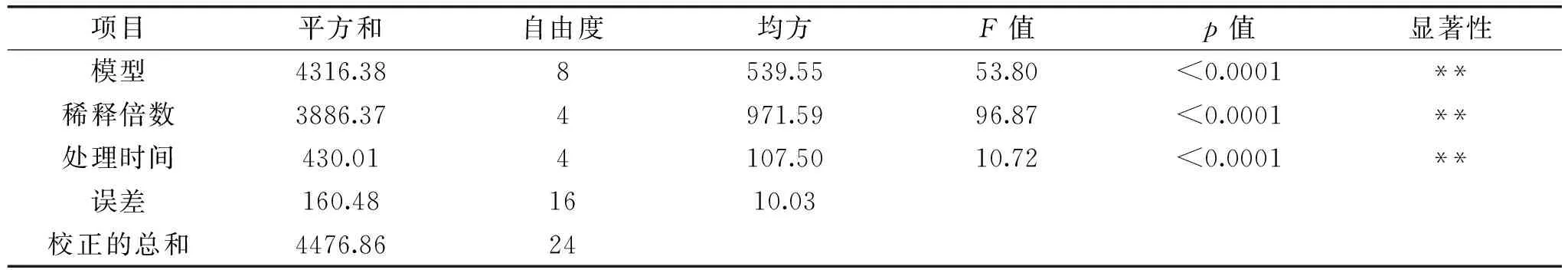
表4 山药提取物对EC-109癌细胞的抑制率的方差分析表Table 4 Variance table of yam mucus protein to EC-109 cancer cell
注:**表示极显著(p<0.01),R2=0.964。
进一步进行LSD法分析,通过方差分析表与LSD法相结合,最终确定两种工艺提取山药黏液蛋白的最适参数如下:水提醇沉法,料液比1∶25g/mL、浸提温度45℃、浸提时间2h,最高得率为1.98%;酶解絮凝法的最适宜提取参数为:pH为9,发酵液中壳聚糖添加的最适宜浓度为0.8g/L,最高得率为4.25%。

表3 酶解絮凝法的因素方差分析表Table 3 ANOVA table of the method of Enzymatic degradation and flocculation
2.4 山药黏液蛋白对人食管癌细胞EC-109的抑制

图6 不同浓度山药提取物对EC-109癌细胞的抑制效果Fig.6 Effect of different dilution Yam mucus protein to EC-109 cancer cell注:对照组抑制效率为0。
五种不同稀释浓度的山药提取物黏蛋白溶液对人食管癌细胞EC-109的抑制效果如图6、图7所示,统计分析结果见表4。从图6结果可以看出,在作用时间48h以内,山药黏液蛋白的浓度越高,对食管癌细胞的抑制作用越强,48h后抑制效果趋于平缓,72h后接近临界值最高峰(数据未给出)。从黏液蛋白稀释液作用后癌细胞的细胞形态来看(图7),结果与图6一致,稀释倍数越低癌细胞降解死亡程度越高。五种溶液中,最高浓度的山药黏液蛋白溶液(0.005mg/mL)对食管癌细胞的抑制效果较好,说明在一定浓度范围内,山药黏液蛋白浓度越高,作用时间越长,对人食管癌细胞EC-109的抑制效果越明显。从表4可知,山药黏液蛋白不同稀释倍数和不同处理时间均对癌细胞生长的抑制率有极显著的影响,且影响程度大小顺序为:稀释倍数>处理时间。

图7 五种不同浓度的山药黏蛋白溶液处理72h后的EC-109癌细胞形态Fig.7 Influence of five different cancer cells solution to EC-109 cancel cell after72 hours注:稀释浓度(mg/mL)为A. 0.005mg/mL、B. 0.0025mg/mL、C. 0.00167mg/mL、D. 0.00125mg/mL、E. 0.001mg/mL;F为EC-109癌细胞对照;标尺=50μm。
3 结论
本实验探索两种从山药全粉中提取山药黏蛋白的加工工艺,利用提取的山药黏蛋白研究了该粗蛋白对人食管癌细胞EC-109的抑制作用。两种提取工艺的最适提取参数分别如下,水提醇沉法:料液比1∶25g/mL、浸提温度45℃、浸提时间2h,最高得率为1.98%;酶解絮凝法的最适宜提取参数为:pH为9时,发酵液中壳聚糖添加的最适宜浓度为0.8g/L,最高得率达4.25%。比较两种提取方法可以发现酶解絮凝法的得率明显高出水提醇沉法,我们建议采用的酶解絮凝法替代了传统的水提醇沉法工艺。因为在实际生产中,水提醇沉法需要反复采用有机溶剂提取,不仅存在有机溶剂残留的问题,不利于山药渣的回收利用,而且增加了生产成本和安全风险。酶解絮凝法则在较温和的条件下采用自然沉降的方式固液分离沉淀山药黏液蛋白,极大的提高了生产效率和安全性,是一种资源节约型和环境友好型工艺。酶解絮凝的优点在于不存在有机溶剂废液污染问题,利用自然沉降的方式来实现固液分离,步骤简单降且低了生产成本,并且得到的成品不含对人体有害的物质,后续处理方便。残存的壳聚糖本身作为一种天然的食品添加剂,还具有一定的抗菌防腐的作用,大大促进了山药粘蛋白粉的推广应用。
利用山药多糖的抗肿瘤研究在国内外有过许多报道[6,15-16],但对山药黏液蛋白作用于人食管癌细胞的研究仍为空白。本实验研究发现山药黏液蛋白对人食管癌细胞EC-109有较好的抑制作用,在一定的稀释范围内,黏液蛋白浓度越高,对食管癌细胞的抑制作用越明显。本研究结果为抗肿瘤药物的筛选奠定了基础,也拓宽了新的思路。
[1]李敏. 山药活性成分提取技术及药理功能的研究进展[J].南方农业学报,2013,44(7):1184-1189.
[2]王震宙,黄绍华. 山药中的功能保健成分及其在食品加工中的应用[J]. 食品工业,2004,25(4):51-52.
[3]宋永刚,胡晓波,王震宙. 山药的活性成分研究概况[J]. 山西食品工业,2007(4):45-48.
[4]何凤玲. 山药中活性成分的提取及降糖活性研究[D]. 重庆:西南大学,2011.
[5]何凤玲,叶小利,李学刚,等. 山药中降糖活性成分的筛选与比较[J]. 食品工业科技,2011,32(6):373-375.
[6]赵国华,李志孝,陈宗道,等. 山药多糖RDPS-I的结构分析及抗肿瘤活性[J]. 药学学报,2003,38(1):37-41.
[7]李义,李红霞,陈星,等. 山药水溶性粗多糖提取工艺的研究[J]. 饲料工业,2005,26(16):45-47.
[8]张元,林强,魏静娜,等. 酶法提取山药中多糖的工艺研究[J]. 中国中药杂志,2008,33(4):374-377.
[9]Chuan SC,Jeng SD,Heng YC. Antioxidant and anti-inflammatory properties of taiwanese yam(Dioscorea japonica Thunb. var. pseudojaponica(Hayata)Yamam.)and its reference compounds[J]. Food Chemistry,2013,141(2):1087-1096.
[10]Juliana QM,Denise CC,Mirna DA,et al. Anti-inflammatory activity of American yam Dioscorea trifida L.f. in food allergy induced by ovalbumin in mice[J]. Journal of Functional Foods,2013,5(4):1975-1984.
[11]孙莹,纪跃芝,马爱民,等. 水提-醇沉法提取大黄多糖工艺优化研究[J]. 中国实用医药,2010,5(18):6-8.
[12]周衡,黄贵华. 中医对食管癌的认识和治疗研究进展[J].辽宁中医药大学学报,2012,14(2):212-215.
[13]杜树辉. 50例原发性食道癌中医证候特点及演变规律分析[D]. 沈阳:辽宁中医药大学,2013.
[14]马庆双. 低聚壳聚糖的制备及应用研究[D].南京:南京理工大学,2004.
[15]赵国华,李志孝,陈宗道. 化学改性对山药多糖抗肿瘤活性的影响[J]. 中国食品学报,2004(1):42-45.
[16]Jong MP,Yoon JK,Ju SK,et al. Anti-inflammatory and carbonic anhydrase restoring actions of yam powder(Dioscorea spp)contribute to the prevention of cysteamine-induced duodenal ulcer in a rat model[J]. Nutrition Research,2013,33(8):677-685.
Comparison of two extraction technology of Yam mucus proteinand its inhibition on Esophageal cancer cells
DAI Rong,KONG De-xin,LI Zong-yu,BAO Xiang-nan,GUO Xiao-hua,LIU Hong*
(Engineering Research Centre for the Protection and Utilization of Bioresource in Ethnic Area ofSouthern China,South-Central University for Nationalities,Wuhan 430074,China)
In this paper,local hongximao yam in Enshi was used to extract Yam mucus protein as experimental material. Two kinds of extraction methods were compared. The inhibition of Yam mucus protein to human esophageal cancer cell EC-109 was also studied. Result showed that the highest yield of the traditonal method with water extraction and alcohol precipitation was 1.98%,the optimum solid-liquid ratio was 1∶25,the optimum extraction temperature was 45℃ and the optimum extraction time was two hours. The highest yield of the method enzymatic flocculation was 4.25%. The optimum pH of the flocculation process was 9 and the optimum concentration of chitosan was 10g/L. Result of anticancer experiment showed that five solutions of mucus protein with different dilutions all had a certain inhibition on the tumor cells. The effect of the solution with 200-fold dilution to EC-109 cancer cells was the best.
Yam mucus protein;extraction technology;Esophageal cancer cell
2014-09-04
戴榕(1993-),女,本科,研究方向:微生物。
*通讯作者:刘虹(1977-),女,博士,副教授,研究方向:植物资源学。
国家级大学生创新创业训练项目(BCX13103)。
TS201.4
A
1002-0306(2015)13-0371-05
10.13386/j.issn1002-0306.2015.13.070

