体内和体外条件下不同浓度硅酸钠和对应pH抑制粉红单端孢(Trichotheciumroseum)效果比较
牛黎莉,毕 阳,张盛贵,赵冠华,白小东,罗荣涛,段伟鹏
(甘肃农业大学食品科学与工程学院,甘肃兰州 730070)
体内和体外条件下不同浓度硅酸钠和对应pH抑制粉红单端孢(Trichotheciumroseum)效果比较
牛黎莉,毕 阳*,张盛贵,赵冠华,白小东,罗荣涛,段伟鹏
(甘肃农业大学食品科学与工程学院,甘肃兰州 730070)
本文研究了不同浓度硅酸钠和对应pH对T.roseum孢子萌发和菌落生长的抑制;100mmol/L硅酸钠和对应pH12.60处理孢子3,6,9h后,损伤接种苹果对其病斑直径的影响;以及采用扫描电镜观察处理后孢子表面形态的变化。结果表明,不同浓度硅酸钠和对应pH处理均能有效抑制T.roseum孢子的萌发和菌落生长,但硅酸钠处理的效果要更好(p<0.05),硅酸钠处理后的孢子其病斑直径明显低于对照(p<0.05),但经对应pH12.60处理后的孢子其病斑直径则与对照相比无显著性差异(p>0.05)。硅酸钠处理的孢子表面粗糙,皱缩明显,表面结构破坏,有明显的内容物渗出;对应pH处理虽然也能导致孢子皱缩,但并未破坏其结构。上述结果表明,硅酸钠比对应pH处理对T.roseum生长的抑制作用更为明显。
T.roseum,硅酸钠,pH,抑制
粉红单端孢(Trichotheciumroseum)是重要的果蔬采后病原物,主要引起苹果心腐病[1]和甜瓜的粉霉病[2-3]。此外,该病原还会引起梨[4-5]、葡萄[6]、番茄[7]、芒果[8]和坚果[9]等多种果蔬的腐烂。除了造成腐烂外,该病原物还具备较强的产生单端孢霉烯族毒素的能力,存在对人畜健康的潜在危害[10-11]。目前,控制由T. roseum引起的病害主要依赖于人工合成的杀真菌剂[8,12]。但长期使用不仅存在药物残留危害、污染环境、而且会增加病原物的抗药性[13]。因此,亟需寻找新的、更为安全有效的控制方法。
硅是地球表面最为丰富的元素之一,可溶性硅酸盐对植物的生长和发育具有多种重要的影响[14],其中已被FDA认定为一般公认安全的(GRAS)化学物质的硅酸钠已广泛用于控制多种作物的田间和采后病害[15-17],其该药物对采后病害的控制作用机理涉及直接抑制病原物以及诱导寄主的防卫反应两个方面,其对病原物的抑制作用具有广谱性[18-20]。由于溶液呈碱性,因此推测硅酸钠的抑菌机理可能与其所呈的碱性直接相关[18,21]。有报道表明,环境pH对真菌的生长具有重要的影响[22],环境pH能直接改变孢子体内的pH从而影响细胞代谢和能量合成[23]。但硅酸钠对真菌的抑制机理是缘于pH还是硅酸根尚缺乏明确的报道。
本文拟研究不同浓度硅酸钠和对应pH处理在体外条件下对T.roseum孢子萌发和菌丝生长的影响;通过采用不同浓度硅酸钠和对应pH处理的孢子损伤接种,比较体内条件下苹果果实病斑直径的差异;采用扫描电镜观察硅酸钠和对应pH处理后孢子的形态变化。
1 材料与方法
1.1 材料与仪器
T.roseum由甘肃农业大学食品科学与工程学院采后生物实验室保存;苹果(品种:红星)于2013年10月采自甘肃省景泰县条山农场,单果包装后装箱,80个/箱;硅酸钠、氢氧化钠为分析纯 天津光复精细化工有限公司。
CX21光学显微镜 中国奥林巴斯;剑桥立体5-150扫描电镜 英国剑桥LEO电子显微镜有限公司;PHS-3C酸度计 上海雷磁仪器厂。
1.2 孢子的收集
T.roseum划线接种于马铃薯葡萄糖琼脂培养基(PDA)上,28℃避光培养,培养10d后,加入含0.05% Tween-80的无菌水,用玻璃棒刮下平板上的病原菌孢子,然后转入50mL三角瓶中,在WYX-A微型旋涡混合器上振荡15s,再用双层纱布过滤,滤液用血球计数板计数算出孢子悬浮液的浓度后,最后稀释至所需浓度。
1.3 硅酸钠溶液pH的测定
用无菌蒸馏水和液态的马铃薯葡萄糖培养基分别配制20、40、60、80、100mmol/L的硅酸钠溶液,然后在28℃恒温水浴锅中恒温30min后,用pH计测定溶液的pH,每个处理测定3次,求平均值。以下实验中的对应pH溶液是用高压灭菌的10mol/L的氢氧化钠溶液调节无菌蒸馏水或培养基的pH与相应浓度的硅酸钠溶液的pH相同。
1.4 硅酸钠和对应pH对孢子萌发的影响
参照Li等[24]方法并稍加修改,用1%的水琼脂倒板,等凝固后,用5mm的打孔器打孔,然后用无菌的镊子将水琼脂饼夹到灭菌的载玻片上(放置在灭菌的加了滤纸的培养皿中,并在各培养皿中加入2mL的无菌水),每个载玻片上放置3个,在每个琼脂饼上分别滴加10μL的不同浓度(20、40、60、80、100mmol/L)的硅酸钠溶液和对应pH溶液(11.96、12.30、12.41、12.50、12.60),并以无菌蒸馏水为对照,等药液进入琼脂,20min后,每个琼脂饼分别加入10μL的孢子悬浮液(1×106个孢子/mL),放入28℃的培养箱中进行培养。15h后用光学显微镜进行孢子萌发的观察,每个琼脂饼观察200个孢子,芽管长度达到孢子直径的一半时,认为是萌发。
1.5 硅酸钠和对应pH对菌丝生长的影响
参照Liu等[18]方法并做修改,将灭菌后PDA培养基冷却至温度60℃,分别加入不同质量的硅酸钠使得硅酸钠的终浓度为20、40、60、80、100mmol/L,充分溶解后,倒板。用灭菌的10mol/L的氢氧化钠溶液调节PDA的pH与不同浓度硅酸钠溶液的pH相同,约20mL均匀平铺于直径9cm的培养皿,以自然的PDA平板为对照,然后将培养10d的T.roseum平板,在边缘用5mm的打孔器打取菌饼接于培养基中央,28℃黑暗培养5d后,用十字交叉法测定菌落直径,每个浓度重复实验3次。
1.6 硅酸钠和对应pH处理后对苹果损伤接种后病斑直径的影响
参照Bi等[20]方法。选择外观整齐、大小均一、无损伤、无病虫害的苹果,用2%的次氯酸钠溶液浸泡2min后用自来水冲洗后室温晾干,再用75%的酒精对果实表面消毒,再用直径3mm的无菌打孔器在果实上均匀刺5mm×3mm的伤口4个,立即接入10μL经100mmol/L硅酸钠溶液和对应pH溶液分别处理3、6、9h的孢子悬浮液,浓度为1×106个孢子/mL,用保鲜袋包装,在室温条件下贮藏20d后,用十字交叉法测定病斑直径。每个处理10个苹果,3次重复,以接入同体积的无菌水作为对照。
1.7 硅酸钠和对应pH处理后对孢子表面形态的影响
以100mmol/L硅酸钠、对应pH以及无菌水处理,处理3、6、9h的孢子(5×106个)为样本。孢子表面形态变化参照Li等[19]方法,在4℃下用2%戊二醛固定2h,PBS溶液洗3次,每次10min;再浸泡于体积分数为1%锇酸溶液中,4℃下2h左右。用50%、70%、95%和100%的系列乙醇各脱水10min。醋酸异戊酯置换20min。临界点干燥,真空镀金。制好的扫描电镜标本在扫描电镜下观察,并采集照片。
1.8 数据处理
全部实验数据用Microsoft Excel 2007和SPSS 16.0数据处理系统进行统计处理,计算标准偏差(±SE)并进行Duncan s多重差异显著分析,图中的不同字母表示0.05水平上的差异显著性。
2 结果与讨论
2.1 不同浓度硅酸钠溶液的pH
20、40、60、80和100mmol/L的硅酸钠添加于培养基溶液后,pH在10.44~12.30之间变化,而相应浓度硅酸钠的水溶液的pH在11.96~12.60之间变化(表1);在相同的硅酸钠浓度下,培养基中加入硅酸钠的pH稍低于添加于无菌蒸馏水中的pH。

表1 不同浓度硅酸钠在液态培养基和无菌蒸馏水中的pH(±SE)Table 1 pHs of sodium silicate at different concentration in PDB solution and sterile distilled water(±SE)
2.2 硅酸钠和对应pH处理对孢子萌发的影响
不同浓度硅酸钠和对应pH处理均能有效抑制孢子萌发,但是硅酸钠和对应pH处理之间存在差异。硅酸钠浓度越高,其抑制效果便越好;而对应pH处理虽然也能显著抑制孢子萌发,但其抑制效果远不及硅酸钠(图1)。当硅酸钠浓度在20mmol/L时,没有抑制孢子萌发,而对应pH溶液则显著抑制了孢子萌发;当硅酸钠浓度达到40mmol/L时,其抑制效果开始显现,且作用明显,其孢子萌发率分别比对照和对应pH低48%和8%;随着硅酸钠浓度的进一步增加,其对孢子萌发率的抑制效果便显著增强。相比而言,当对应pH从12.30增至12.50时,其抑制效果保持稳定,并未进一步增强;当硅酸钠浓度在100mmol/L时几乎完全抑制孢子萌发,处理孢子的萌发率仅为对照和对应pH12.60的2%和4%。

图1 不同浓度硅酸钠和对应pH处理对T.roseum孢子萌发的影响Fig.1 Effect of sodium silicate at different concentration and corresponding pH on conidia germination of T. roseum注:1~6分别表示硅酸钠浓度0、20、40、60、80、100mmol/L;对应pH溶液的pH分别为8.08、11.96、12.30、12.41、12.50、12.60;标有不同字母表示有显著性差性p<0.05。
2.3 硅酸钠和对应pH处理对菌落直径的影响
不同浓度硅酸钠和对应pH处理均能显著抑制T.roseum的菌落生长,但抑制效果存在差异,硅酸钠处理的抑制效果要显著优于对应pH处理(图2)。当硅酸钠在20mmol/L时,就对菌落生长表现抑制,但不及对应pH10.44处理;随着硅酸钠处理浓度的增加,对菌落生长的抑制效果也显著增强,且各硅酸钠浓度处理的效果均显著优于对应pH处理。当硅酸钠浓度为40mmol/L时,其菌落生长仅分别为对照和对应pH的31.4%和42.5%;当硅酸钠浓度为100mmol/L时,则完全抑制了菌落直径的扩展。
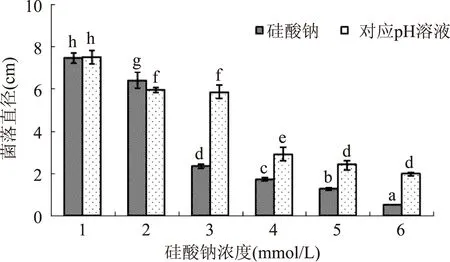
图2 不同浓度硅酸钠和对应pH处理对T.roseum菌落生长的影响.Fig.2 Effect of sodium silicate at different concentration and corresponding pH on colony diameters of T. roseum注:1~6分别表示硅酸钠浓度0、20、40、60、80、100mmol/L;对应pH溶液的pH分别为7.01、10.44、10.96、11.34、11.86、12.30;标有不同字母表示有显著性差异,p<0.05。
硅酸钠所显示的真菌抑制活性,与其溶液本身的碱性有关[18,21]。由于硅酸钠属于强碱弱酸盐,当溶液pH大于11时,能够解离出Na+和硅酸根离子[25]。孢子萌发和菌落直径结果显示,当硅酸钠的浓度为40mmol/L时,此时溶液的pH接近11,硅酸钠的抑制作用明显增强。而且浓度越高,其抑菌效果越好。对照PDA培养基的自然pH为7.01,而20mmol/L硅酸钠对应的pH为10.44,其pH变化较大,这种环境pH的突然改变,使得菌丝生长和孢子萌发均受到显著的抑制。随着硅酸钠浓度的提高,其对应pH的增幅不大,对其菌丝生长和孢子萌发的抑制效果也变化不大。硅酸钠浓度为100mmol/L时,溶液中Na+的浓度仅为200mmol/L,略高于生理盐水中的154mmol/L Na+浓度。因此,Na+通过渗透影响所引起的抑菌作用不大。硅酸钠对孢子萌发和菌丝生长的抑制则主要缘于硅酸根离子。
2.4 硅酸钠和对应pH处理的孢子对损伤接种苹果病斑直径的影响
孢子经100mmol/L硅酸钠处理后再损伤接种苹果,其病斑直径明显低于对照;但孢子经对应pH12.60处理后再损伤接种苹果,则与对照之间无显著差异。随着硅酸钠处理时间的延长,处理孢子损伤接种后的病斑直径会进一步缩小,当处理9h时,几乎完全抑制了病斑的扩展(图3)。由于苹果果肉中4左右的低pH可中和对应pH处理的碱性孢子,使孢子微环境趋于正常pH。同时,果肉本身的高含水量可使得表面皱缩、渗透势发生改变的孢子重新吸收水分而恢复正常活性。而硅酸钠处理由于破坏了孢子的结构,即使外界环境提供大量水分并中和碱性pH,孢子正常活性也难以恢复,从而导致其致病力明显减弱或消失。在硼酸盐[26],氯化铝和焦亚硫酸钠[13]等无机盐处理导致Botrytis cinerea和Fusarium sambucinum孢子形态破坏、以及菌体致死的现象时也观察到类似的结果。

图3 100mmol/L硅酸钠和对应pH溶液处理不同时间的孢子对损伤接种苹果病斑直径的影响 Fig.3 Effect of wound-inoculated with spores of T.roseum treated with sodium silicate at 100mmol/L and corresponding pH at 12.60 for different time on lesion diameter of apple fruits注:标注不同字母表示有显著差异性,p<0.05。
2.5 硅酸钠和对应pH处理对孢子表面形态的影响
100mmol/L硅酸钠及对应pH12.60处理显著改变了孢子的表面形态,处理时间越长,形态的改变也就越明显,但硅酸钠处理对孢子的破坏作用更大(图3)。用无菌蒸馏水处理的对照孢子在3、6和9h三个处理时间段其形态变化不大,孢子表面形态完整,形状饱满(图4A~图4C);经100mmol/L硅酸钠处理后,孢子皱缩,表面粗糙,凹陷明显(图4D~图4F),处理9h时甚至可以观察表面结构破坏,有明显的内容物渗出(图4F);同样,对应pH12.60处理3h的孢子其形态变化与对照相比差异不大(图4G),随着处理时间的延长,孢子皱缩显著增强,当处理9h时,表面粗糙,凹陷现象突出,但结构依然完整(图4H,I)。
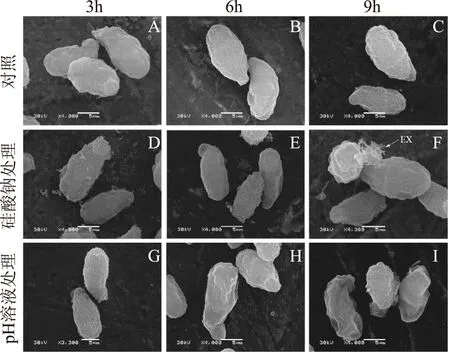
图4 100mmol/L的硅酸钠和对应pH处理对T.roseum孢子表面形态的影响 Fig.4 Effect of sodium silicate at 100mmol/L and corresponding pH at 12.60 treatments on spore morphology of T.roseum注:图A,B和C为对照分别处理3,6,9h;图D,E和F为100mmol/L硅酸钠分别处理3,6,9h;G,H和I为pH12.60分别处理3,6,9h,图中EX表示渗出物。
3 结论
本研究首次发现,不同浓度硅酸钠和对应pH处理均能有效抑制T.roseum孢子的萌发和菌落生长,但硅酸钠处理的效果更好。用经100mmol/L硅酸钠处理后的孢子损伤接种苹果,其病斑直径明显低于对照,但经对应pH12.60处理后的孢子损伤接种,其病斑直径则与对照相比无显著性差异。扫描电镜观察发现,硅酸钠处理的孢子表面粗糙,皱缩明显,表面结构破坏,有明显的内容物渗出;对应pH处理虽然也能导致孢子皱缩,但并未破坏其结构。由此表明,硅酸钠比对应pH处理对T.roseum生长的抑制作用更为明显。
综上所述,硅酸钠对T.roseum孢子的萌发和菌落生长的良好抑制效果除了与其改变环境pH外,更多地涉及硅酸根离子的影响;T.roseum孢子致病力的显著降低则完全决定于硅酸根离子对孢子结构的破坏。至于硅酸根离子如何破坏孢子的结构并在抑菌中发挥作用尚有待进一步研究。
[1]呼丽萍,马春红.苹果霉心病菌的侵染过程[J].植物病理学报,1995,25(4):351-356..
[2]Huang Y,Deverall B J,Tang W H,et al. Foliar application of acibenzolar-S-methyl and protection of postharvest rock melons and Hami melons from disease[J]. European Journal of Plant Pathology,2000,106(7):651-656.
[3]Bi Y,Tian S P,L H X,et al. Effect of temperature on chilling injury,decay and quality of Hami melon during storage[J]. Postharvest Biology and Technology,2003,29(2):229-232.
[4]English W H. Taxonomic and pathogenicity studies of the fungi which cause decay of Pears in Washington[J]. Research Studies. Washington State University,1940,8(3):127-128.
[5]Sommer N F,Fortlage R J,Edwards D C. THE PATHOGEN[J]. Postharvest technology of horticultural crops,2002,3311:197.
[6]Serra R,Braga A,Venancio A. Mycotoxin-producing and other fungi isolated from grapes for wine production,with particular emphasis on ochratoxin A[J]. Research in Microbiology,2005,156(4):515-521.
[7]Welch Jr A W,Jenkins Jr S F,Averre C W. Trichothecium fruit rot on greenhouse tomatoes in North Carolina[Trichotheciumroseum,fungus diseases][J]. Plant Disease Reporter,1975.
[8]杨波,杨冬平,高兆银,等.杀菌剂对芒果果腐病原粉红单端孢菌的室内毒力测定[J].热带生物学报,2013,4(1):45-49.
[9]Hong C X,Michailides T J. Prune,plum,and nectarine as hosts ofTrichotheciumroseumin California orchards[J]. Plant Disease,1997,81(1):112-112.
[10]Tang Y M,Xue H L,Bi Y,et al. A method of analysis for T-2 toxin and neosolaniol by UHPLC-MS/MS in apple fruit inoculated with Trichothecium roseum[J]. Food Additives & Contaminants:Part A,2014(just-accepted).
[11]魏晋梅,周围,毕阳.粉红单端孢体外产毒条件的探讨及粗毒素活性测定[J].食品工业科技,2007(5):110-112.
[12]王慧,桑维钧,倪云跃,等.不同杀菌剂对苹果霉心病菌的室内毒力测定[J]. 湖北农业科学,2013(6):1309-1311.
[13]Avis T J,Rioux D,Simard M,et al. Ultrastructural alterations in Fusarium sambucinum and Heterobasidion annosum treated with aluminum chloride and sodium metabisulfite[J]. Phytopathology,2009,99(2):167-175.
[14]Epstein E. The anomaly of silicon in plant biology[J]. Proceedings of the National Academy of Sciences,1994,91(1):11-17.
[15]Code of Federal Regulations,Title 21,Part 182.90.
[16]Belanger R R,Bowen P A,Ehret D L,et al. Soluble silicon:its role in crop and disease management of greenhouse crops[J]. Plant Disease,1995,79:329-336.
[17]Liang Y,Sun W C,Si J,et al. Effects of foliar-and root-applied silicon on the enhancement of induced resistance to powdery mildew in Cucumis sativus[J]. Plant Pathology,2005,54(5):678-685.
[18]Liu J,Zong Y Y,Qin G Z,et al. Plasma membrane damage contributes to antifungal activity of silicon againstPenicilliumdigitatum[J]. Current Microbiology,2010,61(4):274-279.
[19]Li Y C,Bi Y,Ge Y H,et al. Antifungal activity of sodium silicate onFusariumsulphureumand its effect on dry rot of potato tubers[J]. Journal of Food Science,2009,74(5):213-218.
[20]Bi Y,Tian S P,Guo Y R,et al. Sodium silicate reduces postharvest decay on Hami melons:induced resistance and fungistatic effects[J]. Plant Disease,2006,90(3):279-283.
[21]Guo Y R,Liu L,Zhao J,et al. Use of silicon oxide and sodium silicate for controllingTrichotheciumroseumpostharvest rot in Chinese cantaloupe(CucumismeloL.)[J]. International Journal of Food Science & Technology,2007,42(8):1012-1018.
[22]Manteau S,Abouna S,Lambert B,et al. Differential regulation by ambient pH of putative virulence factor secretion by the phytopathogenic fungusBotrytiscinerea[J]. FEMS Microbiology Ecology,2003,43(3):359-366.
[23]Li B Q,Lai T F,Qin G Z,et al. Ambient pH stress inhibits spore germination ofPenicilliumexpansumby impairing protein synthesis and folding:a proteomic-based study[J]. Journal of Proteome Research,2009,9(1):298-307.
[24]Li Y C,Yang Z M,Bi Y,et al. Antifungal effect of borates againstFusariumsulphureumon potato tubers and its possible mechanisms of action[J]. Postharvest Biology and Technology,2012,74:55-61.
[25]Halasz I,Agarwal M,Li R,et al. What can vibrational spectroscopy tell about the structure of dissolved sodium silicates?[J]. Microporous and Mesoporous Materials,2010,135(3):74-81.
[26]Qin G Z,Zong Y Y,Chen Q,et al. Inhibitory effect of boron againstBotrytiscinereaon table grapes and its possible mechanisms of action[J]. International Journal of Food Microbiology,2010,138(1-2):145-150.
Comparison of inhibitory effect of sodium silicate atdifferent concentrations and corresponding pHonTrichotheciumroseuminvitroandinvivo
NIU Li-li,BI Yang*,ZHANG Sheng-gui,ZHAO Guan-hua,BAI Xiao-dong,LUO Rong-tao,DUAN Wei-peng
(College of Food Science and Engineering,Gansu Agricultural University,Lanzhou 730070,China)
The inhibitory effect were assayed on spore germination and colony growth ofT.roseumtreated with sodium silicate at different concentration and corresponding pH. The lesion diameter was determined in apple fruits inoculated with pores treated with 100mmol/L sodium silicate and corresponding pH12.60 for 3,6 and 9h. Morphology of spores treated with 100mmol/L sodium silicate and corresponding pH12.60 was observed by SEM. The results showed that sodium silicate at different concentration and corresponding pH significantly inhibited the spore germination and colony growth. However,sodium silicate treatments showed more effective than corresponding pH treatments(p<0.05). Apples inoculated with spores treated with sodium silicate had a smaller lesion diameter when compared with the control;however,no difference was found in lesion diameter treated with corresponding pH and the control. Spores treated with sodium silicate appeared rough,significant shrinkage,damaged structure and contents exudate. The treatment with corresponding pH also caused the shrinkage of spores,but the structure was not damaged. It was suggested that sodium silicate treatment caused more severe damage than corresponding pH treatment againstT.roseum.
T.roseum;sodium silicate;pH;inhibition
2014-10-27
牛黎莉(1979-),女,在职博士,讲师,研究方向:采后防腐和保鲜。
*通讯作者:毕阳(1962-),男,博士,教授,研究方向:采后防腐和保鲜。
国家自然基金面上项目(31371869);国家自然基金面上项目(31071835)。
TS201.3
A
1002-0306(2015)13-0157-05
10.13386/j.issn1002-0306.2015.13.024

