不同品种蓝莓花色苷稳定性的比较研究
田密霞,胡文忠,李亚东,刘程惠,姜爱丽
(1.吉林农业大学园艺学院,吉林长春 130118;2.大连民族学院生命科学学院,生物化学工程国家民委-教育部重点实验室,辽宁大连 116600)
不同品种蓝莓花色苷稳定性的比较研究
田密霞1,2,胡文忠2,李亚东1,*,刘程惠2,姜爱丽2
(1.吉林农业大学园艺学院,吉林长春 130118;2.大连民族学院生命科学学院,生物化学工程国家民委-教育部重点实验室,辽宁大连 116600)
本实验探讨了pH、热、光、金属离子(Na+、Ca2+、Fe3+、Mg2+、Cu2+、Zn2+)、H2O2、Na2SO3、蔗糖、苯甲酸钠、D-异抗坏血酸钠以及不同包装材质对两种蓝莓花色苷理化稳定性的影响。结果表明:蓝莓花色苷只有在酸性条件下才可稳定存在;对热、光敏感,稳定性差;氧化剂及还原剂对蓝莓花色苷有较大的破坏作用,蔗糖却有明显的增色作用;PET材质更适合做为蓝莓产品的包装材料。由两种蓝莓比较得出低丛蓝莓花色苷的理化性质更为稳定,在今后的加工或是色素提取中应该选用花色苷性质相对稳定的蓝莓品种。
蓝莓,花色苷,稳定性
蓝莓作为一种花色苷含量很高的浆果,备受人们的青睐。近年来蓝莓花色苷的研究主要集中在花色苷种类的分析鉴定及其功能性方面,即对其体外及体内抗氧化及疾病防治方面的研究[1-10]。然而随着人们对天然着色剂取代有毒合成着色剂兴趣的增加,天然着色剂日益成为科学家们广泛而热门的研究对象[11]。在食品行业,类胡萝卜素和花色苷是最常用的植物类色素[12]。类胡萝卜素属于脂溶性色素,性质稳定[13-14],大量存在于胡萝卜、西红柿和辣椒中[15]。相反,花青素属水溶性色素且极不稳定,可从葡萄、草莓、树莓、蓝莓、红球甘蓝、苹果、萝卜、郁金香、玫瑰、兰花等中提取得到[16]。而且,花色苷作为一类天然的染料,色彩自然艳丽,低毒性,保健功效强,越来越引起科研领域的关注,但相对不稳定性和低提取率使其应用受到限制。在浆果中,蓝莓以其花色苷的种类复杂及含量高而著称[17-18],而且近年来我国蓝莓种植面积及产量逐年增加[19]。本论文就加工和贮藏过程中可能影响花色苷稳定性的各种因素做详细研究。
1 材料和方法
1.1 材料与仪器
蓝莓 采摘自吉林农业大学果园内新鲜、成熟度一致、无病虫害的低丛与高丛两种蓝莓果实(记为品种①和②),冷冻保藏温度在-40℃冰柜中备用;95%乙醇、无水乙醇 沈阳锦弘化工;氢氧化钠、盐酸、过氧化氢 天津通泰医药化工有限公司;亚硫酸钠、氯化钠、氯化钙、三氯化铁、硫酸铜、硫酸镁、氯化锌、山梨酸钾、苯甲酸钠、磷酸氢二钠、磷酸二氢钾、柠檬酸 国药集团化学试剂有限公司;蔗糖 吴江市亿华化工有限公司。
Labda-250型紫外可见分光光度计 美国PE;电子天平 上海梅特勒-托利多;DK-S26电热恒温水浴锅 上海精宏实验设备有限公司;TDL80-2B离心机 上海安享科学仪器厂;pHS-25型酸度计 上海伟业仪器厂;202-2A型电热恒温干燥箱 天津市泰斯特仪器有限公司;SHB-Ⅲ型循环水多用真空泵 巩义市英峪予华仪器厂;CL-2型恒温加热磁力搅拌器 郑州长城科工贸有限公司。
1.2 实验方法
1.2.1 蓝莓花色苷提取液的制备 分别取一定质量的两种蓝莓果实,研碎后,按照料液比1∶10加入含1% HCl乙醇溶液,在室温下超声提取(58kW)20min,在4℃、1200r/min条件下离心15min,收集上清液。蓝莓残渣二次提取,合并两次的上清液,经AB-8树脂纯化、洗脱后用真空旋转式蒸发仪减压浓缩至原体积的一半,得花色苷提取液。两种提取液分别置于棕色瓶中放置4℃冰箱中冷藏备用[20]。
1.2.2 蓝莓花色苷最大吸收波长的确定 将两种花色苷溶液适当稀释后,用紫外可见分光光度计在400~600nm下扫描,分别测定吸收曲线。
1.2.3 蓝莓花色苷稳定性的研究
1.2.3.1 pH对蓝莓花色苷的影响 量取一定的色素提取液,分别用柠檬酸-柠檬酸钠缓冲溶液配制成一定浓度的pH分别为2.0、3.0、4.0、5.0、6.0、8.0的溶液,混匀后室温避光放置0.5h后,在400~600nm波长范围内进行扫描,记录其最大吸收峰,并观察其颜色变化[21]。
1.2.3.2 温度对蓝莓花色苷的影响 取一定量的色素提取液管,用pH=3.0的缓冲液稀释10倍。具塞试管各加入稀释后的色素液20mL,分别在40、60、80、100℃恒温水浴中避光放置各40、80、120、160、200、240min后,立即冰浴冷却,分别测最大吸收峰处的吸光值,观察加热前后吸光值的变化情况[21]。
吸光值变化率(%)=(加热后的吸光值-加热前的吸光值)/加热前的吸光值×100
1.2.3.3 光照对蓝莓花色苷的影响 取一定量的色素提取液管,用pH=3.0的缓冲液稀释10倍后,分别置于室内避光处﹑窗口自然光处,分别测最大吸收峰处的吸光值,每1d测一次,测定6d。
1.2.3.4 金属离子对蓝莓花色苷的影响 分别配制0.2mol/L的Na+、Ca2+、Fe3+、Mg2+、Cu2+、Zn2+金属离子溶液。取一定量的蓝莓花色苷溶液,分别加入一定体积的金属离子溶液取,空白样(CK)加入蒸馏水,用pH为3.0的缓冲液将金属离子浓度稀释50倍,立即测吸光度A0室温,避光静置,每1h测吸光度得A1h、A2h、A3h。
1.2.3.5 氧化剂对蓝莓花色苷的影响 取一定量花色苷原液,分别加入1.0mL的不同浓度的H2O2溶液,用pH=3.0的缓冲溶液稀释,使之最终浓度为0.1%、0.3%、0.5%,空白样(CK)加入蒸馏水。分别测最大吸收峰处的吸光值,室温避光静置,每隔 20min测其吸光值。
花色苷残存率(%)=氧化处理后的吸光值/氧化处理前的吸光值×100
1.2.3.6 还原剂对蓝莓花色苷的影响 取一定量的花色苷原液,分别加入不同体积的Na2SO3溶液,空白样(CK)加入蒸馏水。用pH=3.0的缓冲溶液稀释,使之最终浓度为0.01%、0.03%、0.05%,分别测最大吸收峰处的吸光值,室温避光静置,每隔 20min测其吸光值。
1.2.3.7 蔗糖对蓝莓花色苷的影响 取一定量的花色苷原液适当稀释后,配制浓度分别为0、5%、10%、20%蔗糖溶液(pH=3),分别测取吸光值,再避光放置6d,每24h测1次吸光值。
1.2.3.8 防腐剂对蓝莓花色苷的影响 取一定量的花色苷原液,用pH=3的缓冲液分别配制成浓度为0、0.05%、0.10%、0.15%的苯甲酸钠溶液,分别测取吸光值,再避光放置6d,每隔24h测1次吸光值。
1.2.3.9 抗氧化剂对蓝莓花色苷的影响 取一定量花色苷原液,用pH=3的缓冲液分别配制成质量分数为0、0.01%、0.03%、0.05%的D-异抗坏血酸钠溶液,分别测取吸光值,再避光放置6d,每隔24h测1次吸光值。
1.2.3.10 包装材料及其颜色对蓝莓花色苷的影响 取一定量花色苷原液,用pH=3的缓冲液稀释10倍后,分装到透明玻璃瓶、棕色玻璃瓶和透明塑料瓶中,分别测取吸光值,在室温自然光放置6d,每隔24h测1次吸光值。
1.3 统计方法
数据用SPSS软件进行统计分析,采用新复极差法进行方差分析,检验差异显著性。实验重复3次。
2 结果与分析
2.1 吸收波长的选择
使用Labda-250型紫外可见分光光度计在400~600nm波长范围内,对蓝莓对照品溶液进行光谱扫描,由图1可见:蓝莓花色苷最大吸收波长为520nm。由于蓝莓花色素苷对pH很敏感,不同pH会导致其最大吸收峰移动,所以以下各实验,要根据不同pH的花色素苷溶液,选择对应的最大吸收峰进行测定。
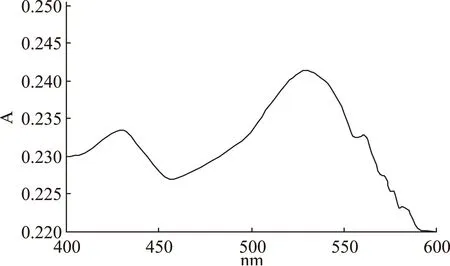
图1 蓝莓色素溶液的吸收曲线Fig.1 Absorption spectrum of UV of blueberry anthocynin
2.2 两种溶液色素稳定性的比较
2.2.1 不同pH下花色苷的稳定性分析 两种蓝莓色素在不同pH条件下的颜色变化情况见表1,将两种色素溶液调成不同pH,在各自最高吸收波长下测定其吸光度,结果见图2。
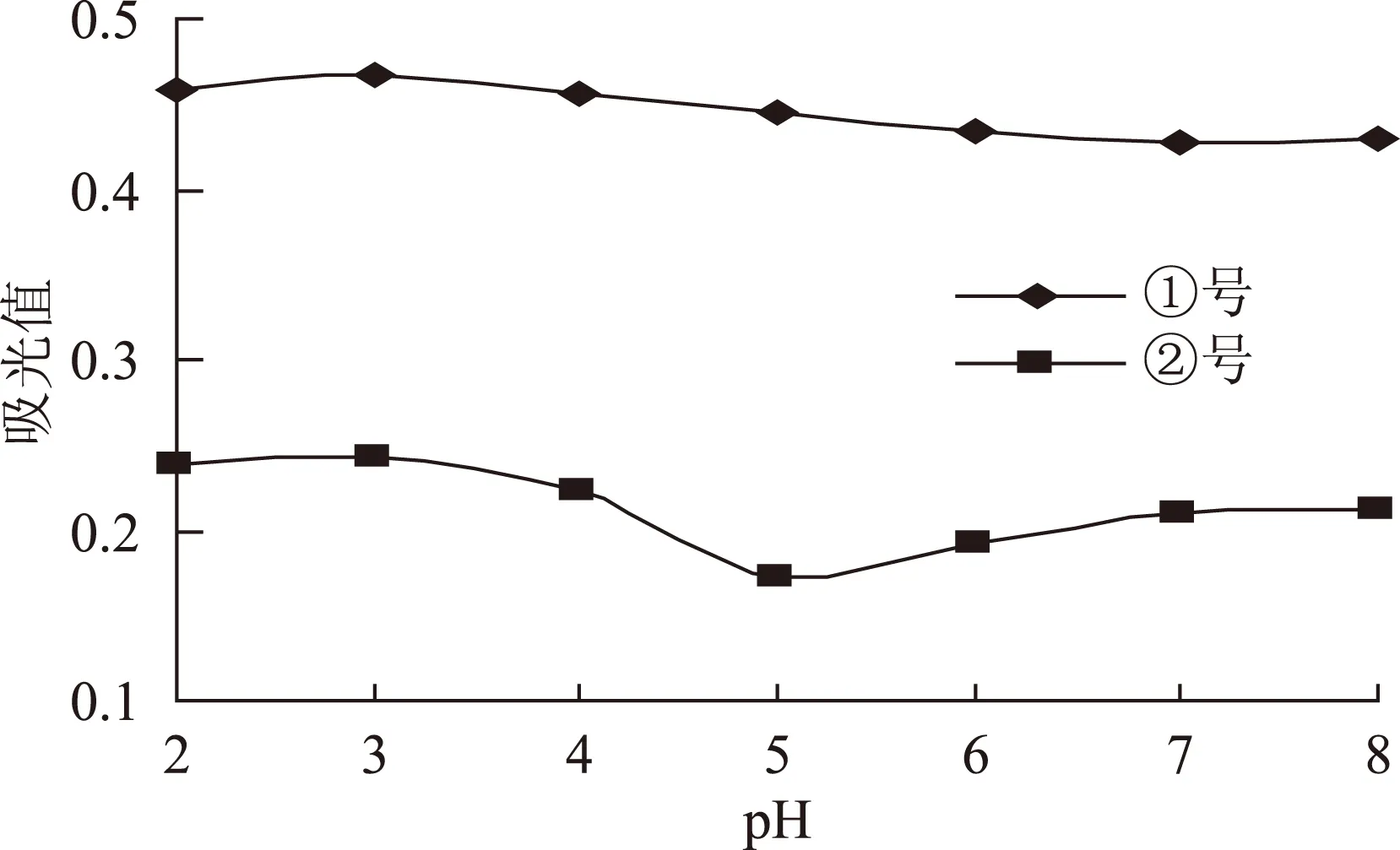
图2 在不同pH下两种蓝莓色素的光谱特性分析Fig.2 Spectral characteristics analysis of blueberry’ anthocynin in different pH
由表1可知,pH越低,溶液颜色越深。在酸性条件下,黄盐阳离子占优势,随着pH增加,反应向生成醌型碱的方向进行,从而醌型碱数目也增加[22]。对于①号来说,在pH2~5的范围内,色素液颜色逐渐由红色变成微红,而②号在pH为5是近乎无色;在6~8的范围内,随pH升高,颜色变化为淡紫色-浅灰色-浅灰蓝色。这说明蓝莓花色苷适用于酸性食品。

表1 不同pH下花色苷的颜色变化Table 1 Color changes of anthocynin in different pH
如图2所示,②号色素液在 pH4以下比较稳定,当pH>4时,其稳定性下降而且稍有起伏;而①号相对于②号而言,其花色苷的稳定性要好。
2.2.2 温度对花色苷稳定性的影响分析 由图3可知,两种蓝莓花色苷对热都不稳定,因为温度升高会加速水分子的对流速度,促进水分子对花色苷的破坏作用。加热320min后,其他温度下花色苷的吸光度值显著低于40℃下的吸光度值(p<0.01)。加热时间越长,吸光值(ABS)变化程度越大,因此蓝莓在加工过程中,应尽量采用高温瞬时或低温长时间杀菌的方式,以减少花色苷的热降解。两种蓝莓色素液加热前和在40、60、80、100℃加热240min后对应吸光值变化率分别为①号:-0.4%、-10.9%、-21.4%、-45.1%,②号:-0.7%、-31.0%、-43.8%、-50.7%。通过比较,可知两种色素之间对热稳定性存在明显差异,②号蓝莓花色苷吸光值变化较大,而①号的吸光值变化较小,这说明①号蓝莓花色苷的热稳定性相对较好。

图3 温度对两种蓝莓花色苷稳定性的影响Fig.3 Effect of temperature on stability of anthocynin
2.2.3 光对花色苷稳定性的影响分析 两种蓝莓色素溶液在暗处、窗口自然光放置一段时间后,测定其在各自最高吸收波长下测定其吸光度,并观察其变化情况。结果见图4。
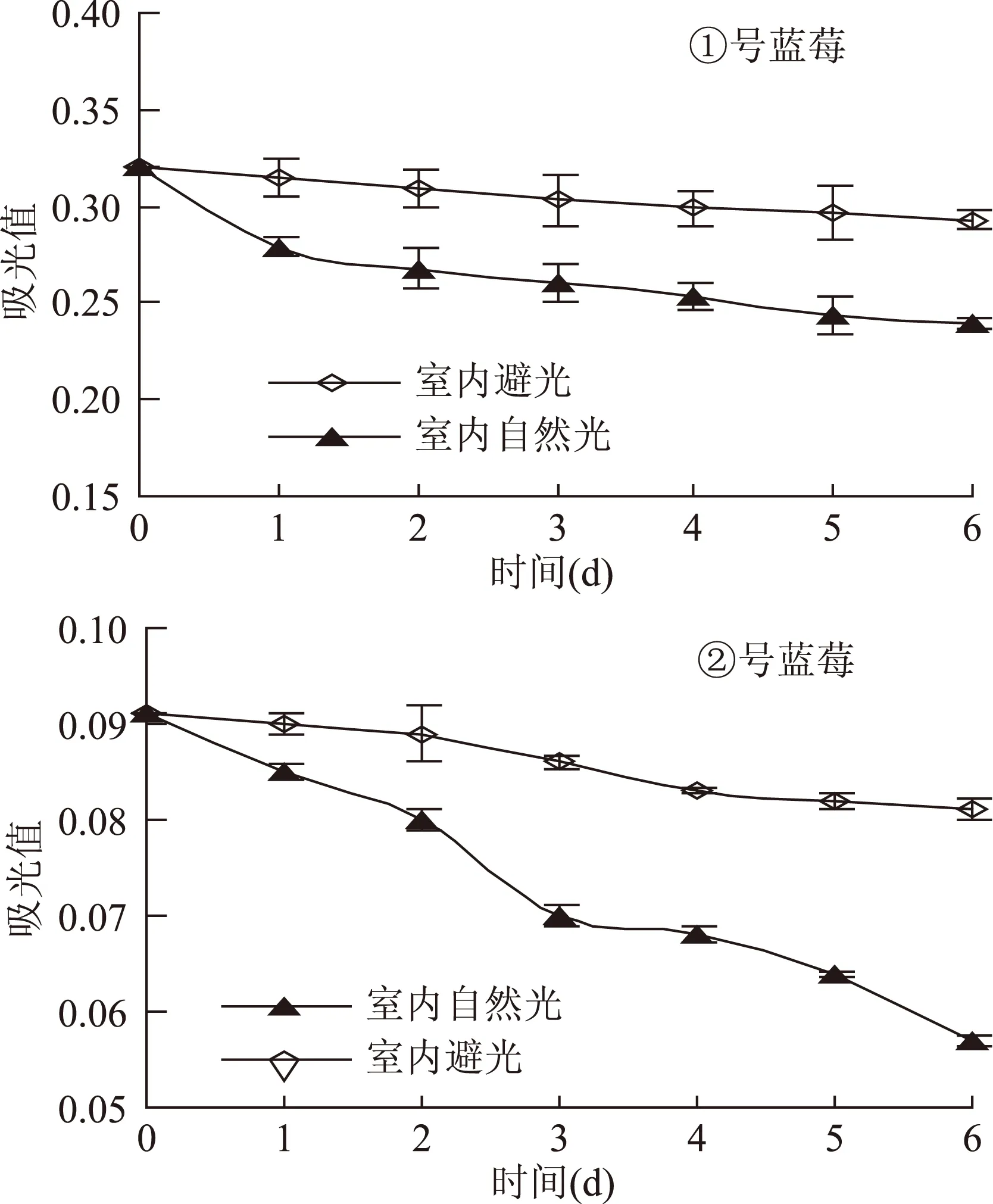
图4 光对两种蓝莓花色苷稳定性的影响Fig.4 Effect of light on stability of anthocynin
由图可知:两种蓝莓中花色苷在自然光直射下褪色快,在避光条件下褪色慢,这可能是由于蓝莓花色苷在光照条件下酰基脱落,导致花色苷的稳定性下降有关,因此,蓝莓应尽量在避光条件下储藏和运输。在自然光下放至6d后,降解率分别为①号25.3%,②号37.4%;在暗处两种蓝莓中花色苷的降解速率缓慢,放置6d的降解率分别为①号8.3%,②号11.0%。由此可得,①号色素耐光性较好,②号色素在光照下稳定性较差,颜色褪去得相对快。
2.2.4 金属离子对花色苷稳定性的影响分析 从图5中可知,六种金属离子对花色苷具有一定影响。对于①号蓝莓的花色苷而言,Fe3+、Mg2+、Cu2+、Zn2+的影响显著(p<0.01),其次是Na+、Ca2+,3h内其对应的吸光值变化率依次为Fe3+:-2.0%,Mg2+:-1.3%,Cu2+:-0.6%,Zn2+:-0.3%,Na+:-0.7%,Ca2+:-1.2%;对于②号蓝莓花色苷,Fe3+影响最显著,Fe3+、Mg2+、Cu2+、Zn2+、Na+、Ca2+对应吸光值变化率为-3.5%、-1.9%、-1.0%、0.8%、-0.9%、-1.6%。
显然,对于每一种金属离子而言,①号蓝莓花色苷吸光值变化率小于②号蓝莓花色苷吸光值变化率,说明①号蓝莓花色苷比较稳定。

图5 金属离子对两种蓝莓花色苷稳定性的影响Fig.5 Effect of metal ion on stability of anthocynin
2.2.5 氧化剂对花色苷稳定性的影响分析 如图6所示,两种蓝莓色素液经过氧化剂(H2O2)处理后,随着时间的延长,两种色素液的吸光值均降低,且随着氧化剂(H2O2)浓度升高,不仅色素液颜色迅速变浅,且花色苷残存率逐渐降低,氧化剂(H2O2)的浓度越大,这种降低的幅度也相对增大,原因可能是H2O2氧化花色苷使其结构破坏,形成无色化合物,稳定性降低,且H2O2浓度越大,破坏效应越大。
放置2h后,对于①号蓝莓色素液,H2O2浓度为0.1%、0.3%、0.5%的样品溶液其花色苷残存率依次为94.9%、91.7%、89.4%(p<0.05);而对于②号蓝莓色素液,H2O2浓度为0.1%、0.3%、0.5%的样品溶液其花色苷残存率为60.4%、50.0%、45.4%(p<0.01)。由此可见,两种蓝莓的花色苷对氧化剂的耐受性不同,显然,比较可得①号蓝莓花色苷的耐氧化性比较好。

图6 氧化剂对两种蓝莓花色苷稳定性的影响Fig.6 Effect of hydrogen peroxide on stability of anthocynin
2.2.6 还原剂对花色苷稳定性的影响分析 由图7可知,还原剂(Na2SO3)对蓝莓花色苷存在一定的破坏作用。随着时间的延长,两种蓝莓花色苷的残存率均逐渐降低,且Na2SO3浓度越大,最终的残存率也越低。
对于①号蓝莓色素液,随着还原剂(Na2SO3)浓度的增加,其花色苷的残存率急剧减小,Na2SO3浓度为0.01%、0.03%、0.05%的样品溶液其花色苷残存率依次为71.5%、52.9%、44.3%,色素液颜色由红色转浅粉色;而对于②号蓝莓色素液,Na2SO3浓度为0.01%、0.03%、0.05%的样品溶液其花色苷残存率为52.8%、42.0%、37.1%,色素液颜色粉红变为无色。对于同种Na2SO3浓度,2h后,花色苷残存率比较:①号>②号。由此可见,②号蓝莓花色苷对Na2SO3更加敏感,①号蓝莓其花色苷的耐还原性比②号稍强。

图7 还原剂对两种蓝莓花色苷稳定性的影响Fig.7 Effect of sodium sulfite on stability of anthocynin
2.2.7 蔗糖对花色苷稳定性的影响分析 两种蓝莓色素液经不同浓度的蔗糖处理后,避光放置一段时间,分别测定其吸光值,结果见图8;蔗糖对于两者稳定性影响情况的比较分析可知,在蔗糖质量浓度为0%~20%范围内,样品溶液的吸光度均发生变化,且随着时间的推移,样品溶液的吸光度变化率也缓慢增加,颜色有加深趋势。这原因可能是蔗糖通过降低水分活度而对色素的发色团起到保护作用的结果。但对于这两种蓝莓花色苷,蔗糖对其稳定性的影响程度略有差异:蔗糖对②号蓝莓色素有较明显的增色作用,而对①号蓝莓色素的稳定性影响相对较小,说明①号蓝莓花色苷对蔗糖较稳定。
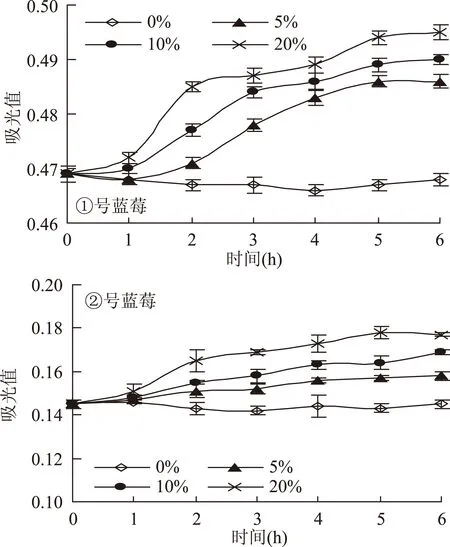
图8 蔗糖对两种蓝莓花色苷稳定性的影响Fig.8 Effect of sucrose on stability of anthocynin
2.2.8 防腐剂对花色苷稳定性的影响分析 从图9可知:随着苯甲酸钠浓度的升高,两种蓝莓色素的吸光值逐渐降低,浓度越大降低的程度也越大,随时间的延长,色素的变化趋势与对照基本一致。在一定浓度范围内,对于①号蓝莓,不同苯甲酸钠浓度的色素液的吸光值变化不大,且随时间的延长,同种浓度色素液的吸光值变化曲线比较平缓(p>0.05),这说明苯甲酸钠其色素稳定性的影响不显著;②号色素液的吸光值随时间变化的幅度比较大(p<0.05),这说明它对苯甲酸钠较敏感。

图9 苯甲酸钠对蓝莓花色苷稳定性的影响Fig.9 Effect of sodium benzoate on stability of anthocynin
2.2.9 抗氧化剂对花色苷稳定性的影响 由图10可知,在pH3.0的两种色素溶液在加入D-异抗坏血酸钠后,短时间蓝莓色素液吸光值先降低,马上出现增色效应,可能由于D-异抗坏血酸钠氧化过程中产生的H2O2对花色苷的2位碳原子进行亲核攻击,从而破坏吡喃环产生无色物质,这些物质有进一步降解或聚合,最终产生褐色沉淀。随着贮存时间的延长和D-异抗坏血酸钠浓度的增加,花色苷吸光度逐渐下降,溶液颜色变浅。6d后,含0.01%、0.03%、0.05%D-异抗坏血酸钠的色素吸光值变化率分别变为:①号-10.3%、-12.1%、-27.9%,②号-36.7%、-38.6%、-40.9%,显然,②号蓝莓吸光值的变化更显著(p<0.01),说明其花色苷对D-异抗坏血酸钠更敏感。

图10 D-异抗坏血酸钠对蓝莓花色苷稳定性的影响Fig.10 Effect of sodium D-isoascorbate on stability of anthocynin
2.2.10 包装材料对花色苷稳定性的影响 将两种蓝莓色素液分装透明玻璃瓶、棕色玻璃瓶和透明PET瓶中,室温不避光放置一段时间,分别测定其各自的吸光值,计算吸光值变化率,结果见图11。
由图可知,两种蓝莓色素液经不同的包装材料保存,不避光放置,随着贮存时间的延长花色苷吸光度逐渐下降,溶液颜色变浅。经计算,6d后,透明玻璃瓶、棕色玻璃瓶、透明PET瓶包装的色素液其吸光值变化率分别为:①号-10.2%、-7.8%、-7.1%,②号-17.9%、-14.1%、-10.4%,显然,②号蓝莓吸光值的变化比①号更显著,其中PET瓶包装的蓝莓色素液吸光值变化率是最小的。可能是因为PET瓶化学性质稳定,具有优良的阻湿、阻气性和耐高低温性能,而透明玻璃瓶透光性良好,光通过玻璃瓶时部分会被吸收,部分透过的光便促使色素发生变化,棕色玻璃瓶能吸收了大部分光,而其耐高低温性能稍差,瓶身温度升高对色素可能有一定影响,所以透明玻璃放置的色素液中花色素被破坏程度最严重,褪色最明显。因此,得出①号蓝莓花色苷比②号更稳定,且PET瓶对蓝莓色素的保存效果更好。

图11 包装材料对蓝莓花色苷稳定性的影响Fig.11 Effect of packaging material on stability of anthocynin
3 结论
蓝莓花色苷只有在酸性条件下才可稳定存在;320min后,同温度下①号吸光值变化率高于②号约8.7%;自然光处放6d后,②号蓝莓降解率比①号蓝莓高约12.1%;经6种金属离子处理后,②号吸光值变化率小①号约0.67%;经H2O2处理2h后,①号色素残存率要高出②号平均约40%;经Na2SO3处理2h后,①号蓝莓色素残存率②号平均高出约12.3%;加入蔗糖处理6d,②号吸光值变化率要高出10.7%;加入苯甲酸钠后①号吸光值随时间的变化比②号要平缓;经D-异抗坏血酸钠处理6d后,②号吸光值变化率平均高出①号约20%;不同包装材质对色素保存效果是PET瓶>棕色玻璃>透明玻璃,此时①号吸光值变化率低于②号约5.8%。
从总体上看,①号蓝莓花色苷具有比②号理化性质更为稳定。这可能是品种不同,蓝莓中所含的花色苷种类以及花色苷的浓度不同造成的[23-24],因此在加工或是色素提取中应该选用花色苷相对稳定的蓝莓品种。
[1]Virachnee Lohachoompol,Mary Mulholland,George Srzednicki,et al. Determination of anthocyanins in various cultivars of highbush and rabbiteye blueberries[J]. Food Chemistry,2008,67:2-5.
[2]Hao Chen,Yuegang Zuo. Identification of flavonol glycosides in American cranberry fruit[J]. Food Chemistry,2007,101:1357-1364.
[3]Priya Kathirvel,Yuansheng Gong,Mark P Richards. Identification of the compound in a potent cranberry juice extract that inhibits lipid oxidation in comminuted muscle[J]. Food Chemistry,2009,115:924-932.
[4]Li-Qiong Sun,Xiao-Ping Ding,Jin Qi,et al. Antioxidant anthocyanins screening through spectrum-effect relationships and DPPH-HPLC-DAD analysis on nine cultivars of introduced rabbiteye blueberry in China[J]. Food Chemistry,2012,132:759-765.
[5]Jin-Ming Konga,Lian-Sai Chia,Ngoh-Khang Goh,et al. Analysis and biological activities of anthocyanins[J]. Phytochemistry,2003,64:923-933.
[6]Katerina Valentova,Jitka Ulrichova,Ladislav Cvak,et al. Cytoprotective effect of a bilberry extract against oxidative damage of rat hepatocytes[J]. Food Chemistry,2007,101:912-917.
[7]Anastasia Z Kalea,Kateryna Clark,Dale A Schuschke,et al. Dietary enrichment with wild blueberries(Vaccinium angustifolium)affects the vascular reactivity in the aorta of young spontaneously hypertensive rats[J]. Journal of Nutritional Biochemistry,2010,21:14-22.
[8]Kevin S Shaughnessy,Ian A Boswall,Adam P Scanlan,et al. Diets containing blueberry extract lower blood pressure in spontaneously hypertensive stroke-prone rats[J]. Nutrition Research,2009,29:130-138.
[9]Magdalini A Papandreoua,Andriana Dimakopoulou,Zacharoula I Linardaki,et al. Effect of a polyphenol-rich wild blueberry extract on cognitive performance of mice,brain antioxidant markers and acetylcholinesterase activity[J]. Behavioural Brain Research,2009:198:352-358.
[10]Xianli Wu,Omar Rahal,Jie Kang,et al. In utero and lactational exposure to blueberry via maternal diet promotes mammary epithelial differentiation in prepubescent female rats[J].Nutrition Research,2009,29:802-811.
[11]Chou P H,Matsui S,Misaki K,et al. Isolation and identification of xenobiotic aryl hydrocarbon receptor legends in dyeing wastewater[J]. Environmental Science and Technology,2007,41(2):652-657.
[12]International Food Information Council(IFIC)and Foundation US Food and Drug Administration(FDA). Food ingredients and colors[M]. Washington,DC:IFIC Foundation,2004,3.
[13]Buchanan B B,Gruissem W,Jones R L. Biochemistry and molecular biology of plants[M]. New York:Wiley,2002:1367.
[14]Potter N N,Hotchkiss J H. Food Science[M]. New York:Chapman and Hall,1995:415-417.
[15]Branen,Alfred Larry. Food Additives[M]. New York:Marcel Dekker Incorporated,2001:2.
[16]Dey P M,Harborne J B. Plant phenolics methods in plant biochemistry(2nd printing)[M]. London:Academic Press Limited,1993:326-341.
[17]Garcia-Viguera C,Zafrilla P,Tomas-Barberan F A. Determination of authenticity of fruit jams by HPLC analysis of anthocyanins[J]. Journal of the Science of Food and Agriculture,1997,73:207-213.
[18]Kalt W,Forney C F,Martin A,et al. Antioxidant capacity,vitamin C,phenolics,and anthocyanins after fresh storage of small fruits[J]. Journal of Agricultural and Food Chemistry,1999a,47(11):4638-4644.
[19]李亚东,刘海广,张志东,等. 我国蓝莓产业现状和发展趋势[J].中国果树,2008(6):67-71.
[20]Alexandra Pazmino-Duran E,Monica Giusti M,Ronald E Wrolstad,et al. Anthocyanins from Oxalis triangularis as potential food colorants[J]. Food Chemistry,2001,75:211-216.
[21]徐明生,吴磊燕,汤凯洁,等.紫红薯色素稳定性的研究[J]. 食品科学,2002,38(2):71-73.
[22]Cooper-Driver G A. Contributions of Jeffrey Harborne and co-workers to the study of anthocyanins[J]. Phytochemistry,2001,56(3):229-236.
[23]Mazza G,Brouillard R. The mechanism of co-pigmentation of anthocyanin in aqueous solution[J]. Phytochemistry,1990,29:1097-1102.
[24]Janna O A,Khairul A K,Maziah M. Anthocyanin stability studies in Tibouchina semidecandra[J]. Food Chemistry,2007,101:1640-1646.
Comparing stability of anthocyanins from different varieties of blueberries
TIAN Mi-xia1,2,HU Wen-zhong2,LI Ya-dong1,*,LIU Cheng-hui2,JIANG Ai-li2
(1.Horticultural College,Jilin Agricultural University,Changchun 130118,China;2.College of Life Science,Dalian Nationalities University,Key Laboratory of Biochemical Engineering,The State Ethnic Affairs Commission -Ministry of Education,Dalian 116600,China)
The effect of temperature,light,pH,metal ions,oxidants,reducing agents,sugar,preservative(sodium benzoate,potassium sorbate),antioxidant(d-sodium erythorbate)as well as the bottle material on stability of anthocyanins in two different kinds of blueberry were discussed in the experiment. Results showed that only in acidic environments,the pigment had high stability. Anthocyanins had low fever and light stability. Oxidant and reductant had strong destructive effect to blueberry anthocyanins,but sucrose had counterproductive. PET was suitable for packaging materials. In conclusion,the low bush blueberry anthocyanins had higher stability than the high bush blueberry anthocyanins in the same conditions. So it should choose the right variety of blueberry when producing or extracting the anthocyanins.
blueberries;anthocyanins;stability
2014-09-18
田密霞(1979-),女,博士研究生,工程师,研究方向:果蔬保鲜加工及其功能性成分研究。
*通讯作者:李亚东(1964-),男,硕士,教授,研究方向:小浆果种质资源及栽培生理。
农业部2011公益性行业(农业)科研专项小浆果产业技术研究与实验示范(201103037);吉林省财政厅项目(2012004);吉林省科技厅发展计划项目(20110828);中央高校自主科研项目(DC13010307);大连民族学院大学生创新创业训练计划项目(X2013046)。
TS201.2
A
1002-0306(2015)13-0060-07
10.13386/j.issn1002-0306.2015.13.004

