静电纺纤维在生物医药应用领域的研究进展*
刘延波 孙健 赵雪菲 马素梅
(1.天津工业大学纺织学院,天津,300387; 2.天津工业大学先进纺织复合材料教育部重点实验室,天津,300387)
静电纺纤维在生物医药应用领域的研究进展*
刘延波1,2孙健1赵雪菲1马素梅1
(1.天津工业大学纺织学院,天津,300387; 2.天津工业大学先进纺织复合材料教育部重点实验室,天津,300387)
随着人们对纳米纤维材料特殊性能和高度适应性认识的不断提高,越来越多的研究在关注纳米纤维的制备方法。其中,静电纺丝技术是一种操作简单、原料适应性广且易于实现规模化生产的纺丝方法。静电纺纳米纤维具有较高的比表面积及孔隙率,在生物医药领域有着广泛的应用。介绍生物医药应用领域静电纺纤维的研究状况,着重阐述静电纺技术在组织工程支架、药物控释、创伤敷料、生物酶固定化、生物传感器及医学诊断应用等方面的最新研究进展。
静电纺,生物医药,组织工程支架,药物控释,酶固定,生物传感器
近几十年,随着人们对纳米结构材料特殊性能和高度适应性认识的不断提高,越来越多的研究投向了纳米材料,并发展了很多制备纳米结构的应用技术。其中,静电纺丝技术是纺制连续超细纤维最为简单有效的一种方法,且适用于比较广泛的原料[1]。静电纺丝技术是利用电场力纺制超细纤维的一种便捷方法,原料可选择多种天然与合成聚合物。典型的静电纺设备(图1)包括带有毛细针头的聚合物注射泵、高压电源和接收装置。其工作原理:在毛细针头处施加高压,当电场力增加到某一数值时,悬垂液珠开始变得不稳定并逐渐形成液锥(通常称“泰勒锥”);继续增加电场力直至克服溶液或熔体表面张力,液珠在泰勒锥顶端形成带电聚合物射流;然后射流经鞭动和牵伸变得更长更细,溶剂也在此过程中逐渐挥发,纤维射流固化;最后纤维收集于接收装置之上。
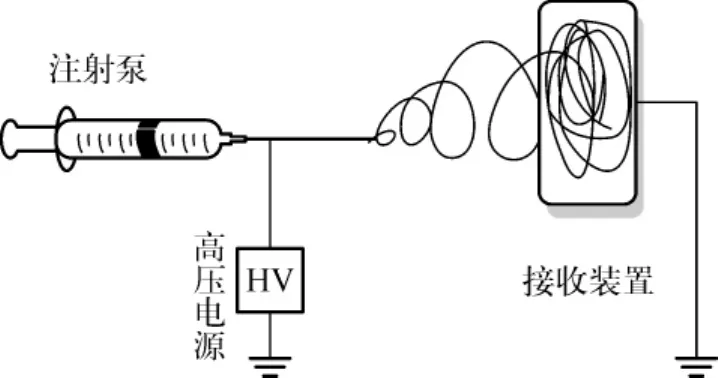
图1 静电纺设备模型
由静电纺丝技术纺制的纤维直径范围可从几十纳米到几微米,而这对于传统技术来说很难实现。较小的单纤维尺寸使纤维具有了较高的比表面积,且静电纺设备构成较为简单,易于实现对影响单根纤维尺寸形状及成网孔隙相关参数的各过程因素(如电压、接收距离等)的调整[2]。另外,为获得设计所需的性能和功效,纤维基质的化学成分也易于选择和替换,可以轻松地纺制出生物相容性纤维,还可以通过混合和表面功能化处理使纤维性能多样化[3]。静电纺丝技术有着诸多的特点、优点,当之无愧地成为了最便捷的纳米纤维纺制技术,并在生物医药领域得到了越来越多的关注。
将静电纺丝技术制得的超细纤维作为组织支架基底,可为所培养的细胞提供较适宜的吸附、繁殖和分化环境,有利于组织增生。而当作为创伤敷料使用时,可实现与多种治疗药物的结合,如特定药品、抗生素、蛋白质等能很容易地嵌入静电纺纤维基底中[4]。组织支架与创伤敷料相比,前者是将静电纺纤维作为组织再生的基底,而后者是作为治疗药物的释放平台。静电纺纤维具有较大的比表面积,能非常容易地实现酶类及其他生物催化剂的固定化。另外,静电纺纤维膜具有很高的孔隙率,且孔洞内连通性较好,这些都有利于固定酶和催化剂维持较高的存活率[5]。
本文着重介绍静电纺丝技术在组织工程支架、药物控释、创伤敷料、生物酶固定化、生物传感器及医学诊断应用等方面的最新研究进展。
1 组织工程支架
一些人体组织在受到损伤后难以再生,如创伤情况严重时,患者则需依靠替代物或移植物来达到组织功能的重建[6],[7]229。因此,理想的支架需满足以下要求:
——较好的生物相容性;
——足够的机械强度;
——较适宜的孔隙结构,以便于细胞的内生长,以及运输营养素、氧气、生长因子和代谢产物等[8]。
从生物体结构角度来看,大多数生物体组织都由相互交织的蛋白纤维构成[7]229。静电纺纳米纤维的缠结结构具有类似的特点,且表面积巨大,由其制备的组织支架可为细胞生长提供有益的支撑,并能起到很好的引导作用[9]。近年来已有很多研究小组采用静电纺纤维模拟组织工程支架,如骨组织[10]462、软骨[11]、肌腱[12]、神经[13]、血管[14]和皮肤支架[15]等。
现有研究表明,静电纺纤维孔隙率较高,这有利于细胞的接种、黏附、增殖、分化,以及最终形成组织。Murphy等[10]464研究了支架孔径尺寸对骨细胞吸附、增殖和迁移的影响,其研究结果显示,小孔径支架具有较大表面积,有利于初始阶段细胞的黏附,而大孔径支架能成功地促进细胞的迁移生长,大大降低细胞的聚集程度。因此,找出大孔径支架的制备方法势在必行。Phipps等[16]530对比分析了三种扩大聚己内酯/胶原蛋白/羟基磷灰石(PCL/col/HA)骨组织工程支架孔径尺寸的方法,并认为在静电纺丝过程中加入聚环氧乙烷(PEO)这一可去除性纤维,可有效提高所纺制支架的孔径尺寸。此外,除了形态结构,组成成分对人工支架也至关重要,生物相容性和力学性能就是其中两个重点。近来已开展许多制备含有机-无机成分的静电纺纤维支架的研究工作。羟基磷灰石(HA)作为骨组织的主要无机成分受到了广泛关注[16]531,它能在一定范围内增强支架的机械强度。Prabhakaran等[17]制备出聚乳酸/羟基磷灰石(PLA/HA)和聚乳酸/胶原蛋白/羟基磷灰石(PLA/col/HA)成分的骨组织工程支架。Li等[18]也制备出了不同结构形态的聚乳酸(PLA)和聚乳酸/羟基磷灰石(PLA/HA)成分的组织工程支架,提高了人类初生造骨细胞的增殖速度,并对骨修复具有一定的作用。
在血管组织工程应用中,一般需要接种特定细胞或是将细胞封装于可降解合成材料支架内,诱生细胞外基质。人体内血管组织分三层,每一层吸附不同的细胞。因此,为更好地模拟血管组织、实现不同细胞的吸附要求,需制备多层结构的支架。Vaz等[19]利用配有圆辊接收器的多层静电纺装置制备出双层聚乳酸/聚己内酯(PLA/PCL)管状支架(图2)。细胞测试结果(图3)显示,该支架可以有效提高细胞的黏附、增殖、分化,促进细胞迁移生长。

图2 双层PLA/PCL管状支架的SEM图

图3 培养鼠成纤细胞的双层PLA/PCL管状支架的SEM图
Yuan等[20-21]采用压力诱导滚卷电纺膜法(图4)制备出三维多层管状结构支架,其可更好地模拟实现人体血管的功能。研究人员将三种不同的细胞置于二维膜的不同位置,再将覆有细胞的膜滚卷成三维管状,这样三种细胞就呈由内到外的三层分布状态,更接近不同细胞在血管组织中真实的分布状态,这在血管组织工程支架应用方面具有极大的潜力。
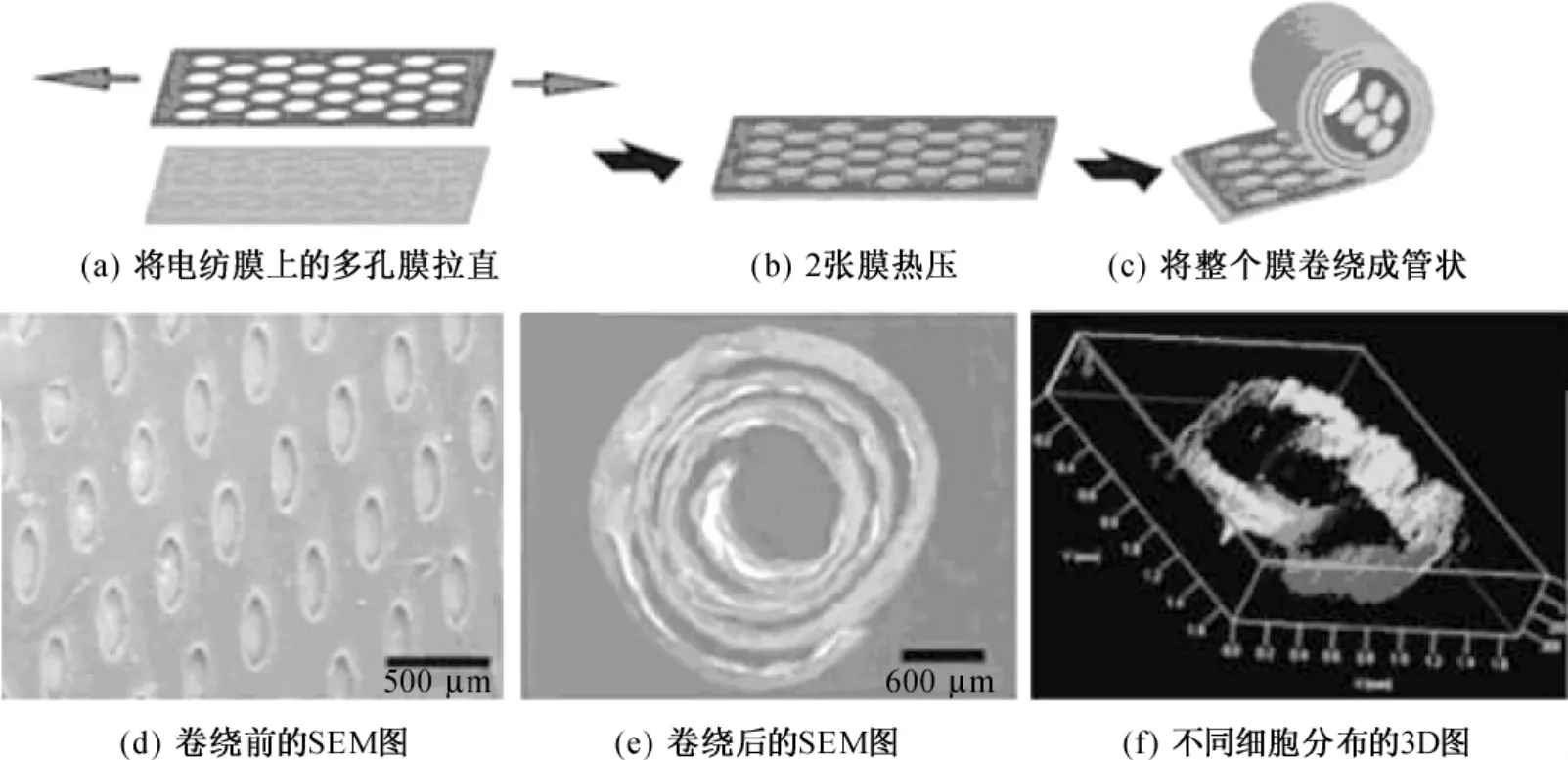
图4 压力诱导滚卷电纺膜法制备三维多层管状结构支架
在临床应用中,支架的缝合强度也是一个亟待解决的难题。而为了解决这一难题,需制备出无缝支架。Pabittei等[22]在静电纺过程中引入焊接技术,制备出无缝静电纺聚己内酯(PCL)纤维支架,在一定程度上改善了管状支架的缝合强度。Bergmeister等[23]采用静电纺技术纺制出高孔隙率、大孔径孔洞且细胞吸附性能得到优化设计的血管支架,证明了在保证血管有效生物力学性能的同时,可实现提高静电纺血管孔径与孔隙率。He等[24]采用静电纺技术纺制出新型小口径聚氨酯(PU)人造血管(图5),通过调整条件参数使血管移植物支架的纤维排布(图6)、力学性能及生物相容性得到了极大优化。

图5 PU人造血管实物

图6 不同速度接收滚筒纺制的PU血管S EM图
Mckenna等[25]致力于开发重组人体弹性蛋白静电纺血管,以改善移植过程中的有害免疫反应和原料供应等问题。试验表明,内皮细胞可以吸附并存活于该类支架上,且支架的机械性能与生物提取蛋白所制支架相近,可作为临床应用中的替代品。但研究人员也提到,单独使用弹性蛋白制备的支架,其力学性能尚不足以应对血管移植过程中的要求。
2 药物控释
用于药物控释的纳米结构系统在医药领域有着广泛的应用,如部分肿瘤治疗、呼吸及疼痛治疗等[26]。利用非等轴纳米结构如纳米棒、纳米管和纳米纤维等进行药物输送及释放的前景十分广阔。
在静电纺丝液中加入药物后,可直接纺制出该类非等轴药物载体[27]。由于在聚合物原料中加入了小分子药物,故能成功地将药物载入纤维,且加工过程中,加载的高压电对药物活性几乎无影响。静电纺纳米材料比表面积大,溶剂挥发快速、高效,能较好地保持所载药物的活性,且其再结晶时间有限。能以这种方法加入纤维中的小分子药物包括亲脂性药物布洛芬、紫杉醇、伊曲康唑等。
另一种是很多研究常采用的同轴静电纺方法[28]。Kiatyongchai等[29]研究人员采用同轴静电纺技术,将模拟药物封装于醋酸纤维素和明胶混合成分的超细纤维芯层中,在pH值为1.2的含有胃蛋白酶人工胃液中测试所封装阿莫西林的释放特性,结果显示其释放过程遵循菲克扩散定律,释放半衰期约为5 h,没有观察到突释现象,且在人工胃液中放置24 h后纤维仍保持完整,该法适用于在胃肠道内稳定释放药物。Li等[30]报道了一种新型载药芯壳纳米纤维,可对槲皮黄酮释放进行双相(即固液两相)调节。该纳米纤维由改进的采用聚氯乙烯(PVC)包覆的同轴喷嘴静电纺设备(图7)制得,芯壳层原料分别为乙基纤维素(EC)和聚乙烯吡咯烷酮(PVP)。SEM图显示该纳米纤维具有直线形态及芯壳结构,利用X射线衍射发现槲皮黄酮在纳米纤维中以非结晶态存在。体外溶解释放试验结果(图8)显示,PVP壳层迅速将所载药物释放到测试溶液中,而EC芯层则在随后缓慢释放药物,后者符合菲克扩散定律,这样通过在壳层和芯层加载不同种类的药物可实现双相释放调节。
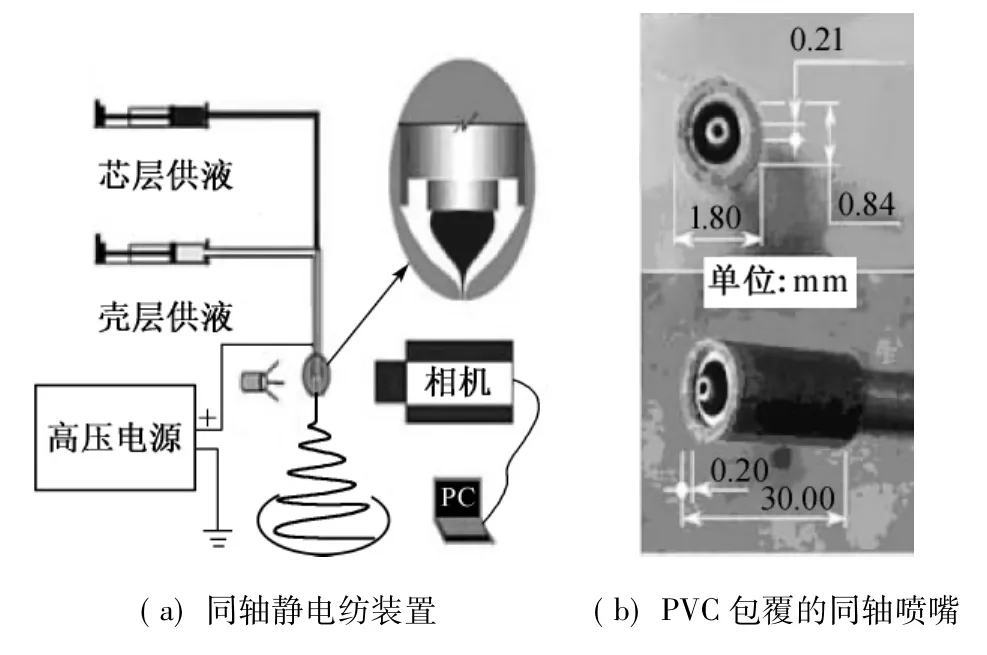
图7 新型载药芯壳纳米纤维的纺制

图8 体外药物释放测试
3 创伤敷料
理想的创伤敷料应能隔离多余的渗出液,并能以合适的速率转移水气,利于空气流动,与创面轮廓贴合(即与健康组织有较好的贴合且不会紧贴创伤组织)[31]1251。
近来有许多关于兼具生物降解性和相容性的纤维类创伤敷料的报道[32]。其中,纳米纤维因其结构具有高比表面积,药物释放高效,纤维的吸湿性、柔韧性和渗透性都有利于细胞的吸附,以及可促进创面愈合的细胞转移及增殖,故可暂时替代天然细胞外基质,还可作为抗菌药物和其他生长因子的载体[33]885。
Unnithan等[33]889醋酸纤维素(CA)和玉米蛋白物理混合,制备出纤维直径为400~700 nm的抗菌静电纺纳米纤维敷料。其中,聚氨酯为基础聚合物,混合醋酸纤维素和玉米蛋白用于改善敷料的亲水性、细胞的吸附增殖及血液的凝结能力。此外,为避免常见的临床感染发生,研究人员还将抗菌剂硫酸链霉素混入静电纺纤维中,测试了加入该抗菌剂后纤维对革兰氏阴性和革兰氏阳性细菌的抗菌性。该研究还测试分析了成纤维细胞(fibroblast,其为疏松结缔组织的主要细胞成分)与聚氨酯/醋酸纤维素、聚氨酯/醋酸纤维素/玉米蛋白抗菌剂复合纳米纤维敷料之间相互作用的效果,包括细胞存活、增殖和吸附等。且研究发现,与聚氨酯纳米纤维敷料相比,复合敷料的血液凝结能力更出色,醋酸纤维素和玉米蛋白极大地提高了纤维敷料的亲水性与生物活性,为伤口愈合提供了一个湿润的环境。
Sofokleous等[34]利用静电纺丝法成功制备了新型可生物降解且生物相容性好的纤维型载药聚乳酸-羟基乙酸共聚物(P LGA)敷料,所载抗菌药物阿莫西林可在体外以可控的方式稳定释放21 d。药物释放初期有突释现象,而聚合物的降解、扩散也会促进阿莫西林药物从PLGA敷料中的释放,但整体上药物从敷料中的释放过程较稳定。PLGA敷料为阿莫西林药物提供了最初期的保护,但随时间的推移,接触药物的媒介聚合物水解会引起药物释放,因此,可在释放媒介中检测到阿莫西林降解物。图9显示了PLGA敷料对阿莫西林药物释放的成功控制,其在磷酸盐缓冲盐水及模拟人体体液中的药物稳定性和生物活性延长到21 d以上。傅里叶变换红外光谱也显示,生产敷料产品的静电纺过程对阿莫西林药物的化学结构无影响,这保证了药物的药理学及抗菌性能。

图9 静电纺纤维型载药P LGA敷料在不同液体中浸泡2 1 d后的SEM图
4 生物酶固定化
酶是一种具有较高效率和选择性的生物催化剂,但较差的稳定性制约了酶的实际应用[35]9349,[36]。因此,在生物催化剂的应用中,酶的固定化十分重要,而固定化酶的性能又在很大程度上受载体材料结构的影响[37]。纤维,特别是静电纺纳米纤维,由于具有相当大的特殊化的表面积,现已逐渐成为生物催化剂固定化应用中具有良好发展前景的一种载体材料。
将静电纺纳米纤维作为生物催化剂固定化载体的方法主要有两种[35]9349:表面吸附和封装。在表面吸附方法中,生物催化剂(特别是各类酶)与静电纺纳米纤维表面以共价键联接,这在一定程度上限制了生物催化剂的承载量,且在与疏水性静电纺纳米纤维表面接触时还需进行改性,以提高它们的生物相容性。相比之下,将生物催化剂封装于纳米纤维之中,可以通过与水溶性、生物相容性较好的聚合物如聚乙烯醇(PVA)等混合,然后经静电纺丝加工,再与聚合物交联而制得。交联过程有利于提高生物催化剂的承载量[38]。
Canbolat等[35]9350利用静电纺和化学交联方法,在PVA纳米纤维上固定化表面显有增强型绿荧光蛋白质的工程化酵母菌。结果发现,增强型绿荧光蛋白质能够以正确的构象显现,酵母菌细胞能在静电纺和化学交联过程中很好地存活下来。这一加工功能化酵母菌的过程为在静电纺纳米纤维上直接固定折叠链段活性酶提供了一种方法。
Xu等[39]采用全新的方法将漆酶固定于静电纺聚丙烯腈(PAN)纳米纤维表面,每克纤维的漆酶承载量可以达到220 mg。固定化的漆酶可保持自由酶活性的72%,这相比于自由酶,固定化漆酶的使用令储存稳定性有了显著提高。Ji等[40]应用同轴静电纺方法制备出了一种可进行多步反应并具有高效辅酶再生过程的人工细胞,其以新型中空纳米纤维为基质。该细胞现已成功应用于胆汁酸的测定,其对浓度范围为0~200μmol/L的胆汁酸表现出良好的线性关系。与溶液基多酶系统相比,静电纺中空纳米纤维基多酶系统表现出了更集中的活性恢复能力,且恢复率高达75%。该法有望改善并拓宽多酶系统在工业、生物传感器、生物医药及诸多其他相关研究领域的应用。
5 生物传感器及医学诊断应用
检测分析用设备通常由敏感生物分子、检测器和信号处理器组成[31]1247。基于酶电极的电化学生物传感器在生物化学分析、临床诊断和环境监测等方面具有相当大的应用潜力[41]9319。在制备酶生物传感器的过程中,人们较关注纳米材料的形态和结构的优化设计。而生物传感器成功运行的关键在于能否将酶物质有效地固定于电极之上。表面积大的静电纺纤维膜具备用于敏感检测的潜能,人们正越来越多地关注其在生物传感器方面的应用。
Zhao等[41]9321通过静电纺制得一维中等孔径氧化锌纳米纤维,并经退火处理后,参与组建了多孔三维立体框架。在生物传感器的制备过程中,以纳米结构为基质,将三维氧化锌框架直接在材质为金的电极上成形,并与辣根过氧化物酶(HRP)组装,形成酶化过氧化氢生物传感器(图10)。且研究发现,该法制备的生物传感器具有非常高的敏感度,反应速度较快,且稳定性良好。这些卓越的性能一方面源于一维中等孔径结构能有效组装酶,另一方面源于多孔三维空间框架有利于电极连通及反应物的迅速交换。多孔三维氧化锌框架为优质电化学生物传感器中组装蛋白质的制作开辟了新路径。

图10 多孔三维氧化锌固定HRP前后对比
Wang等[42]应用静电纺技术再经脱乙酰处理,制得两种高敏感度、高选择性的基于掺杂有二羟蒽醌纳米纤维膜的固态荧光传感器材料雏形,且都具有较好的生物安全性和相容性,分别适于检测Cu2+和Cr3+,可实时对诸如受污染湖水等环境中的重金属进行快速检测。
生物医学诊断的一种分类方式是基于某种特定的免疫反应,而免疫测定的第一步就是将待测样品(抗体/抗原)固定在固体基底上。静电纺纤维可以封装不同种类的蛋白质和酶类,用于识别一些生物医药分子,从而用作医学诊断传感器。近来,气体传感应用领域对三氧化钨(WO3)关注较多,静电纺纤维被认为是对NO2、H2S、丙酮[43]等气体检测应用中最具潜力的材料。如,对人体呼出的丙酮气体进行快速、灵敏、准确的分析是糖尿病无创伤诊断的关键技术。Bai等[44]以无水钨酸和硝酸铜为前驱体,采用静电纺技术合成具有不同结构相掺杂铜的WO3中空纳米纤维,成形过程如图11所示。该纤维在质量分数为0.002%的丙酮中快速反应及恢复时间分别为5和20 s,大比表面积、连接结构及三斜晶构象为氧吸附提供了便利,加强了丙酮与WO3相互作用的强度。
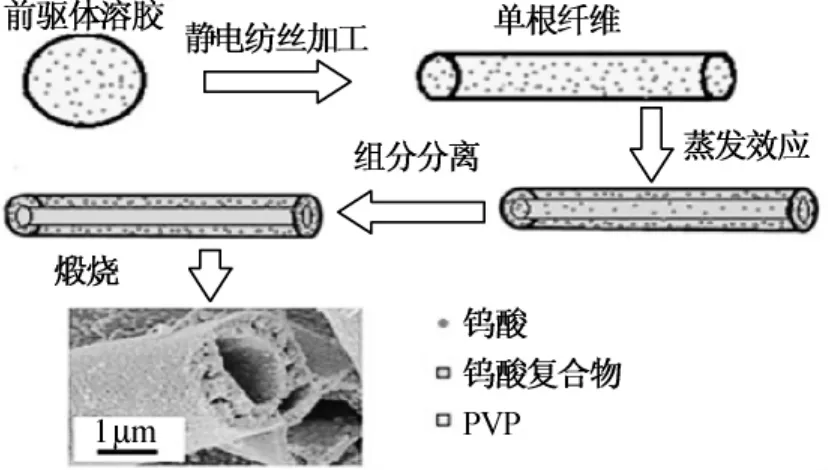
图11 三氧化钨中空纤维结构形成图
Zhou等[45],[46]889将铱掺杂聚苯乙烯静电纺纤维用于葡萄糖检测用光学传感器;Wang等[46]900还利用聚氨酯静电纺多孔纤维作为外壳制得了可植入型葡萄糖传感器。静电纺纳米纤维使得生物医学诊断变得更加灵敏且信噪比更高,但其自身也存在一些不可避免的缺陷,如较低的通过率和相对较弱的机械强度,这些会妨碍静电纺纳米纤维更广泛的应用。可通过与其他技术相融合,如微流体技术,用于多元测试分析[47-49]。Li u等[50]将静电纺聚合物纳米纤维膜压夹于生物检测用微流体装置中的微流体通道内用于辅助检测,结果表明,加入电纺膜可使其对人类免疫缺陷病毒(HIV)的测试灵敏度更高。
除了蛋白质、酶类和一些小生物分子外,经处理的静电纺膜还可用于癌细胞的检测,特别是针对循环肿瘤细胞(CTC)。Zhang等[51]将TiO2纳米纤维放置于Si基底之上,并涂覆用于捕获CTC的抗体,所得捕捉平台相较于平滑的Si基底垫,细胞捕捉率更高,这得归功于水平放置的静电纺纳米纤维与细胞外基质支架之间增强形态的相互作用。且在他们的后续研究中[52-53],使用透明PLGA纳米纤维基底替代Si基底,有利于应用激光微解剖设备进行单个癌细胞的分离和检测。另外,在PLGA纳米纤维上覆盖一层聚二甲硅氧烷(PDMS)杂乱层,能加强细胞与基底的作用,进一步提高细胞的捕获性能。
6 结语
静电纺纳米纤维具有较高比表面积和孔隙率,在生物医药领域有着广泛的应用。作为组织支架基底,其能够为所培养的细胞提供较适宜的生长环境;作为创伤敷料,其可使药物高效释放;在生物酶固定化应用中,其能保证生物酶和催化剂维持较高存活率,可用于医学诊断的生物传感器中,为多种疾病的诊疗发挥巨大作用……
当前,随着研究工作的不断深入,静电纺纳米纤维的性能改善将会取得更大进步,其将会为人们的健康生活提供更广泛、更好的服务。
[1]CARACCIOLO PC,TORNELLO PR C,BALLARIN F M,etal.Developmentof electrospun nanofibers for biomedical applications:State of the art in Latin America[J].JBiomater Tiss Eng,2013,3(1):39-60.
[2]NIRMALA R,KALPANA D,NAVAMATHAVAN R,et al.Preparation and characterizations of silver incorporated polyurethane composite nanofibers via electrospinning for biomedical applications[J].J Nanosci Nanotechno,2013,13(7):4686-4693.
[3]COSTA LM M,DEOLYVEIRA GM,CHERIAN BM,et al.Bionanocomposites from electrospun PVA/pineapple nanofibers/stryphnodendron adstringens bark extract formedical applications[J].Ind Crop Prod,2013,41 (3):198-202.
[4]TONCHEVA A,SPASOVA M,PANEVA D,et al.Polylactide(PLA)-based electrospun fibrous materials containing ionic drugs as wound dressing materials:A review[J].Int J Polym Mater Po,2014,63(13): 657-671.
[5]KUMAR P,GUPTA A,DHAKATE S R,et al.Covalent immobilization of xylanase produced from bacillus pumilus SV-85Son electrospun polymethylmethacrylate nanofibermembrane[J].Biotechnol Appl Bioc,2013,60(2):162-169.
[6]LIUWanying,THOMOPOULOSS,XIA Yingna.Electrospun nanofibers for regenerative medicine[J].Adv Healthc Mater,2012,1(1):10-25.
[7]WANG Xuefeng,DING Bin,LI Baiyun.Biomimetic electrospun nanofibrous structures for tissue engineering[J].Materials Today,2013,16(6).
[8]HOLMES B,CASTRO N J,ZHANG Liangge,et al.Electrospun fibrous scaffolds for bone and cartilage tissue generation:Recent progress and future developments[J].Tissue Eng Part B Reviews,2012,18(6): 478-486.
[9]ZHENGWenfang,ZHANGWu,JIANG Xiaoying.Biomimetic collagen nanofibrous materials for bone tissue engineering[J].Adv Eng Mater,2010,12(9): 451-466.
[10]MURPHY C M,HAUGH M G,O'BRIEN F J.The effect ofmean pore size on cell attachment,proliferation in collagen-glycosaminoglycan scaffolds for bone tissue engineering[J].Biomaterials,2010,31(3).
[11]ZHENG Ruan,DUAN Haicheng,XUE Jiaxin,et al.The influence of guelatin/PCL ratio and 3-D construct shape of electrospun membranes on cartilage regeneration[J].Biomaterials,2014,35(1):152-164.
[12]BOSWORTH L A,ALAM N,WONG Jingku,etal.Investigation of 2D and 3D electrospun scaffolds intended for tendon repair[J].JMater Sci-Mater M,2013,24 (6):1605-1614.
[13]XIE Jiawan,MACEWAN M R,LIU Weiyin,et al.Nerve guidance conduits based on double-layered scaffolds ofelectrospun nanofibers for repairing the peripheral nervous system[J].ACSApplied Materials&Interfaces,2014,6(12):9472-9480.
[14]HASAN A,MEMIC A,ANNABIN,et al.Electrospun scaffolds for tissue engineering of vascular grafts[J].Acta Biomaterialia,2014,10(1):11-25.
[15]FRANCO R A,NGUYEN T H,LEE B T.Preparation and characterization of electrospun PCL/PLGA membranes and chitosan/gelatin hydrogels for skin bioengineering applications[J].J Mater Sci-Mater M,2011,22(10):2207-2218.
[16]PHIPPSM C,CLEM W C,GRUNDA JM,et al.Increasing the pore sizes of bone-mimetic electrospun scaffolds comprised of polycaprolactone,collagen I and hydroxyapatite to enhance cell infiltration[J].Biomaterials,2012,33(2).
[17]PRABHAKARAN M P,VENUGOPAL J,RAMAKRISHNA S.Electrospun nanostructured scaffolds for bone tissue engineering[J].Acta Biomaterialia,2009,5(8):2884-2893.
[18]LIMingming,LIUWei,SUN Jianshu,et al.Culturing primary human osteoblasts on electrospun poly(lacticco-glycolic acid)and poly(lactic-co-glycolic acid)/nanohydroxyapatite scaffolds for bone tissue engineering[J].ACS Applied Materials&Interfaces,2013,13 (5):5921-5926.
[19]VAZ CM,VAN TUIJL S,BOUTEN C V C,et al.Design of scaffolds for blood vessel tissue engineering using a multi-layering electrospinning technique[J].Acta Biomaterialia,2005,1(5):575-582.
[20]YUAN Bei,JIN Ying,SUN Yuan,et al.A strategy for depositing different types of cells in three dimensions to mimic tubular structures in tissues[J].Adv Mater,2012,24(7):890-893.
[21]JIN Ying,WANG Naxing,YUAN Bei,et al.Stress-induced self-assembly of complex three dimensional structures by elastic membranes[J].Small,2013,9(14): 2410-2414.
[22]PABITTEID R,HEGER M,BEEK JF,etal.Optimization of suture-free laser-assisted vessel repair by solder doped electrospun poly(epsilon-caprolactone)scaffold[J].Ann Biomed Eng,2011,39(1):223-234.
[23]BERGMEISTER H,SCHREIBER C,GRASL C,et al.Healing characteristics of electrospun polyurethane grafts with various porosities[J].Acta Biomaterialia,2013,9(4):6032-6040.
[24]HEWei,HU Zhenjiang,XU Anwei,et al.The preparation and performance of a new polyurethane vascular prosthesis[J].Cell Biochemistry and Biophysics, 2013,66(3):855-866.
[25]MCKENNA K A,HINDS M T,SARAO R C,et al.Mechanical property characterization of electrospun recombinant human tropoelastin for vascular graft biomaterials[J].Acta Biomaterialia,2012,8(1): 225-233.
[26]GOUDA M,HEBEISH A A,ALJAFARIA I.Synthesis and characterization of novel drug delivery system based on cellulose acetate electrospun nanofiber mats[J].Journal of Industrial Textiles,2014,43(3):319-329.
[27]HAROOSH H J,DONG Yue,INGRAM G D.Synthesis,morphological structures and material characterization of electrospun PLA:PCL/magnetic nanoparticle composites for drug delivery[J].JPolym Sci Pol Phys,2013,51(22):1607-1617.
[28]SOHRABIA,SHAIBANI P M,ETAYASH H,et al.Sustained drug release and antibacterial activity of ampicillin incorporated poly(methyl methacrylate)-nylon 6 core/shell nanofibers[J].Polymer,2013,54(11): 2699-2705.
[29]KIATYONGCHAI T,WONGSASULAK S,YOOVIDHYA T.Coaxial electrospinning and release characteristics of cellulose acetate-gelatin blend encapsulating amodel drug[J].JAppl Polym Sci,2014,131(8): 17-21.
[30]LIChen,WANG Zhehui,YU Dongge,et al.Tunable biphasic drug release from ethyl cellulose nanofibers fabricated using amodified coaxial electrospinning process[J].Nanoscale Res Lett,2014,9(2):21-25.
[31]KHADKA D B,HAYNIE D T.Protein-and peptidebased electrospun nanofibers in medical biomaterials[J].Nanomedicine:Nanotechnology,Biology and Medicine,2012,8(8).
[32]DONGARGAONKAR A A,BOWLIN G L,YANG H.Electrospun blends of gelatin and gelatin-dendrimer conjugates as a wound-dressing and drug-delivery platform[J].Biomacromolecules,2013,14(11):4038-4045.
[33]UNNITHAN A R,GNANASEKARAN G,SATHISHKUMAR Y,et al.Electrospun antibacterial polyurethanecellulose acetate-zein compositemats for wound dressing[J].Carbohydrate Polymers,2014,102(3).
[34]SOFOKLEOUS P,STRIDE E,EDIRISINGHE M.Preparation,characterization and release of amoxicillin from electrospun fibrous wound dressing patches[J].Pharmaceutical Research,2013,30(7):1926-1938.
[35]CANBOLATM F,GERA N,TANG Chao,et al.Preservation of cell viability and protein conformation on immobilization within nanofibers via electrospinning functionalized yeast[J].ACS Applied Materials&Interfaces,2013,19(5).
[36]TRAN D N,BALKUS K J.Perspective of recent progress in immobilization of enzymes[J].Acs Catal,2011,1(8):956-968.
[37]WANG Ying,HSIEH Y L.Immobilization of lipase enzyme in polyvinylalcohol(PVA)nanofibrousmembranes[J].JMembrane Sci,2008,309(1/2):73-81.
[38]MORADZADEGAN A,RANAEI-SIADAT SO,EBRAHIM-HABIBI A,et al.Immobilization of acetylcholinesterase in nanofibrous PVA/BSA membranes by electrospinning[J].Eng Life Sci,2010,10(1): 57-64.
[39]XU Ren,CHIChenli,LIFeitai,et al.Laccase-polyacrylonitrile nanofibrous membrane:Highly immobilized,stable,reusable and efficacious for 2,4,6-trichlorophenol removal[J].ACSApplied Materials&Interfaces,2013,23(5):12554-12560.
[40]JIXiaoyuan,WANG Peng,SU Zhenhui,et al.Enabling multi-enzyme biocatalysis using coaxial-electrospun hollow nanofibers:Redesign of artificial cells[J].J Mater Chem B,2014,2(2):181-190.
[41]ZHAOMeigu,ZHOU Yuan,CAIBin,etal.The application of porous ZnO 3D framework to assemble enzyme for rapid and ultrahigh sensitive biosensors[J].Ceramics International,2013,39(8).
[42]WANG Minglang,MENG Guwei,HUANG Qi,et al.Electrospun 1,4-DHAQ-doped cellulose nanofiber films for reusable fluorescence detection of trace Cu2+and further for Cr3+[J].Environmental Science&Technology,2012,46(1):367-373.
[43]WANG Lei,TELEKI A,PRATSINIS S E,et al.Ferroelectric WO3nanoparticles for acetone selective detection[J].Chem Mater,2008,20(15):4794-4796.
[44]BAIXue,JIHuimin,GAO Peng,et al.Morphology,phase structure and acetone sensitive properties of copper-doped tungsten oxide sensors[J].Sensor Actuat BChem,2014,19(3):100-106.
[45]ZHOU Chenshen,SHIYanglin,DING Xiaodong,et al.Development of a fast and sensitive glucose biosensor using iridium complex-doped electrospun optical fibrous membrane[J].Analytical Chemistry,2013,85(2): 1171-1176.
[46]WANG Nan,BURUGAPALLIK,SONGWuhui,et al.Electrospun fibro-porous polyurethane coatings for implantable glucose biosensors[J].Biomaterials,2013,34(4).
[47]LIU Yingying,YU Jia,CHENWanwan,etal.Cu2+detection with gold nanoparticles by patterning colorimetric strips on a filter membrane assembled in a microfluidic chip[J].Chinese J Chem,2012,30(9): 2047-2051.
[48]ZHANG Yang,TANG Yuefen,HSIEH Y H,etal.Towards a high-throughput label-free detection system combining localized-surface plasmon resonance and microfluidics[J].Lab Chip,2012,12(17): 3012-3015.
[49]ZHANG Yang,QIAO Lebin,REN Yueke,et al.Two dimensional barcode-inspired automatic analysis for arrayed microfluidic immunoassays[J].Biomicrofluidics,2013,7(3):77-81
[50]LIU Yingying,YANG Dangyun,YU Tai,et al.Incorporation of electrospun nanofibrous PVDF membranes into amicrofluidic chip assembled by PDMS and scotch tape for immunoassays[J].Electrophoresis,2009,30 (18):3269-3275.
[51]ZHANG Nanan,DENG Yueli,TAI Qindong,et al.Electrospun TiO2nanofiber-based cell capture assay for detecting circulating tumor cells from colorectal and gastric cancer patients[J].Adv Mater,2012,24(20): 2756-2760.
[52]ZHAO Lubing,LU Yunting,LI Feiqi,et al.Highpurity prostate circulating tumor cell isolation by a polymer nanofiber-embedded microchip for whole exome sequencing[J].Adv Mater,2013,25(21):2897-2902.
[53]HOU Sui,ZHAO Linbin,SHEN Qiliang,et al.Polymer nanofiber-embeddedmicrochips for detection,isolation and molecular analysis of single circulatingmelanoma cells[J].Angew Chem Int Edit,2013,52(12): 3379-3383.
《合成纤维工业》2016年征订启事
《合成纤维工业》是国家科委批准发行的合成纤维领域的专业性科技期刊,全方位报道国内外科研生产的科技成果、实用技术和科技信息,辟有研究与开发、科研快讯、综述与专论、设备与控制、实践与经验、分析与测试、国内外动态等主要栏目。每期提供近15万字的技术信息,是合成纤维工业生产、研究开发、设计、管理、经营等部门专家、技术人员、管理人员的首选期刊。
《合成纤维工业》是中国期刊方阵双效期刊、中文核心期刊、中国石化集团公司核心期刊和中国科技论文统计源期刊、CA收录刊源。《合成纤维工业》已入编中国学术期刊(光盘版)、万方数据——数字化期刊群、中文科技期刊数据库等。
《合成纤维工业》是化纤界专家和企业家的朋友,也是合成纤维科技成果通向企业的桥梁与纽带。《合成纤维工业》愿为您提供全方位的咨询、中介和广告服务,竭诚欢迎海内外合成纤维专家、企业家垂询。《合成纤维工业》网站(www.hcxwgy.com)欢迎与各信息网站及化纤企业刊互换友情链接。
《合成纤维工业》为大16开本,双月刊。国内外公开发行,国内邮发代号42-21。订价10.00元/期,年价60.00元。请读者及时到当地邮政局订阅!也可直接与编辑部联系补订。编辑部现有1994—2014年合订本(定价70.00元/本),欢迎读者踊跃订阅。
地址:湖南省岳阳市云溪区
巴陵石化分公司技术中心(原岳化研究院)
《合成纤维工业》编辑部
联系人:余毅
邮政编码:414014
电话:0730-8482342
传真:0730-8482342
E-mail:hcxwgy.blsh@sinopec.com
网址:http://www.hcxwgy.com
Research progress on electrospinning fiber for biomedical applications
Liu Yanbo1,2,Sun Jian1,Zhao Xuefei1,Ma Sumei1
(1.School of Textiles,Tianjin Polytechnic University; 2.Key Laboratory of Advanced Textile Composites,Ministry of Education,Tianjin Polytechnic University)
With increasing awareness of the special properties and broad applicability of nanofibermaterials,more and more researches focused on the preparation methods of nanofiber,of which electrospinning technique was one of spinning methods with simple operation,extensive adaptation of raw materials and easily realizing mass production.Due to the higher specific surface area and porosity,electrospun nanofibers had been applied in the biomedical field widely.The application status of electrospinning concerning biologicalmedicines,especially the latest research progress of electrospinning technique including tissue engineering scaffold,drug delivery,wound dressing,biologic enzyme immobilization,biosensor and medical diagnosis application and so on,was introduced.
electrospinning,biomedical,tissue engineering scaffold,drug delivery,enzyme immobilization,biosensor
R318.08
:A
:1004-7093(2015)09-0001-11
*国家自然基金项目(51373121)
2015-04-04
刘延波,女,1965年生,副教授。研究方向为超细纤维包括微米级和纳米级纤维材料的技术开发。

