苦草(Vallisneria natans)移植对沉积物再悬浮后的水质控制效果研究
谷娇 宁晓雨 靳辉 朱小龙 谈冰畅 李宽意
摘要 通过单因子(苦草密度)影响试验和双因子(有无苦草、沉积物性质)受控试验,研究苦草移植在短期内对沉积物再悬浮后的水质控制效果。结果表明,苦草移植可以显著降低水体悬浮物浓度与营养盐水平,且密度越高,悬浮物浓度与营养盐水平越低;沉积物营养水平影响苦草对水体的净化效果:高营养底泥中,苦草对悬浮物的去除率为22.19%,而低营养底泥中去除率仅为8.21%;高营养底泥中,苦草对水体TN的去除率为10.94%,显著高于低营养底泥。因此,沉水植被区域沉积物再悬浮的沉降不仅与沉水植物本身有关,还与沉积物的性质有关。
关键词 苦草;沉积物再悬浮;水质控制
中图分类号 S181.3 文献标识码A 文章编号 0517-6611(2015)11-216-04
水体富营养化和水生植被衰退是当前全世界面临的生态环境问题[1-3]。水生植被尤其是沉水植被作为湖泊生态系统的重要初级生产者,对维护湖泊生态系统及净化水质有着重要的意义[4-9]。因此,重建和恢复沉水植被是控制湖泊富营养化、恢复水生态系统结构的有效途径之一[10-11]。近年来,关于沉水植被对水体修复效果的野外调查研究较为集中。Horppila[12]通过对希登韦西湖(芬兰西南部,总面积30.3 km2)的调查发现,沉水植物区内底泥再悬浮量为 793 g DW/m2,而沉水植物区外同时刻底泥再悬浮量可达 1 701 g DW/m2。Houwing等[13]也发现植物区水体浊度和悬浮固体浓度明显低于周围水体,认为沉水植物抑制底泥再悬浮是由于植物有效地衰减了风浪波,抑制了水流的紊动。吴振斌等[14]利用富营养浅水湖泊——武汉东湖中建立的大型试验围隔系统,证明重建后的沉水植物可显著改善水质。与无沉水植被覆盖区相比,沉水植被区对沉积物再悬浮的抑制是植被密度、覆盖度、种类等综合作用的结果,涉及机理较多,而关于植被本身的作用尚需进一步研究。除此之外,沉水植被区水体底泥沉降特性除了取决于植物本身外,是否与沉积物性质有关?因此,笔者利用造浪泵模拟风浪扰动,选取太湖不同性质的沉积物,根据太湖苦草平均密度,设计单因子(苦草密度)影响试验和双因子(有无苦草、沉积物性质)受控试验,研究苦草移植后短时间内对沉积物再悬浮后的水质控制机理,旨在为湖泊富营养化治理提供参考。
1 材料与方法
1.1 试验设置 试验于2013年10月21日~11月12日在苏州东山试验基地进行。试验分为两部分,一部分研究移植不同密度苦草对沉积物再悬浮后水体悬浮浓度及水体营养盐的影响,一部分研究移植苦草对不同性质沉积物再悬浮后水体悬浮浓度及水体营养盐的影响。试验所选用的沉水植物苦草是东太湖的优势种之一,苦草植株高度约30 cm。两试验均在聚乙烯塑料桶(桶高56 cm,上下底直径分别为50、38 cm )中进行,桶内沉积物厚度为10 cm,注入50 cm深经过滤的东太湖湖水,水体总氮(TN)、总磷(TP)的初始浓度分别为0.68±0.06 mg/L、0.06±0.01 mg/L,平均水温为16 ℃(范围为13~19 ℃)。试验均在露天条件下进行,如遇下雨天气,及时加盖桶盖,以免雨水影响桶内营养盐浓度。
移植不同密度苦草对沉积物再悬浮影响的试验于10月21日~10月28日进行。设计了1个影响因子(苦草密度)3组处理(低密度882 g/m2,中密度1 764 g/m2,高密度3 528 g/m2),每组处理4个重复。苦草密度设定参考太湖的分布情况,将低密度组作为对照,其他两组处理均与低密度组进行比较。沉积物来自梅梁湾一河道表层底泥为高营养底泥(表1),经过60目的筛绢网过筛混匀后使用。移植苦草对不同性质沉积物再悬浮影响的试验于11月5日开始,11月12日结束。设计2个影响因子(有无苦草与沉积物性质)4个处理组,即低营养底泥+无草、低营养底泥+有草(3 528 g/m2)、高营养底泥+无草、高营养底泥+有草(3 528 g/m2),每个处理4个重复。高营养底泥来自梅梁湾一河道表层底泥,低营养底泥来自同一河道深层底泥(表1),经过60目的筛绢网过筛混匀后使用。高、低营养底泥根据沉积物中总氮、总磷以及有机质含量来划分(表1)。两试验均采用森森造浪泵(6 W)模拟风浪扰动,置于水面下15 cm处。扰动强度根据太湖年平均悬浮浓度40 mg/L (10~150 mg/L)[15]来确定,6 W造浪泵置于该试验水面下15 cm处,可使水体悬浮浓度达到152 mg/L。试验前开启水泵扰动底泥,每隔半天采集一次水样,测定悬浮物浓度,观察模拟风浪扰动引起沉积物再悬浮特征。待水体悬浮浓度稳定后,分别称量不同生物量苦草种入各试验桶,种植完毕后关闭造浪泵,采集初始值,试验开始。试验期间,观察沉积物再悬浮沉降以及苦草生长情况。
1.2 测定项目 采样于试验开始后第0.5、1、2、4、8 d进行,依据《湖泊生态调查观测与分析》,测定水体氮、磷浓度和叶绿素含量,分析沉积物中总氮、总磷及有机质的含量;计算悬浮物浓度,样品悬浮颗粒物分析主要参照《湖泊营养化调查规范》。
1.3 数据处理与分析 所有试验数据的描述性统计和检验统计均采用SPSS 19.0进行,重复测量数据采用Repeated Measures进行分析,非重复测量数据采用Oneway ANOVA进行分析,显著性水平为P<0.05;所有图形均由Origin8.0生成。
2 结果与分析
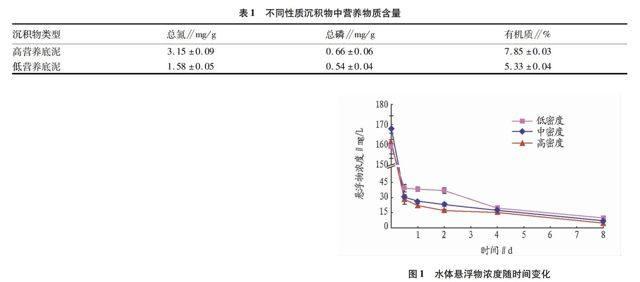
2.1 移植不同密度苦草对沉积物再悬浮的影响重复测量方差分析表明,移植不同密度苦草对水体悬浮物浓度的影响有显著差异(P<0.05),即低密度组>中密度组>高密度组。由图1可知,试验结束时低、中、高密度处理组悬浮浓度分别为10.00、7.05、4.73 mg/L,其中高密度处理组悬浮浓度从161.63 mg/L 降至4.73 mg/L,显著低于低密度处理组(P<0.01)。各处理组悬浮物浓度随时间变化呈逐步下降趋势(P<0.01),且不同处理组的下降速率存在极显著差异(P<0.01),高密度组大于中、低密度组。说明种植苦草促进沉积物再悬浮的沉降,并且密度越大,对水体悬浮浓度影响越明显。
试验期间,不同处理组悬浮浓度在0~0.5 d快速下降,0.5~4 d缓慢下降,2~8 d趋于稳定。在0~0.5 d,高密度处理组悬浮浓度下降速率高达11.1 mg/(L·h),悬浮浓度下降了82.7%,显著高于低密度处理组(P<0.05)。说明苦草密度越大,悬浮浓度下降越快,下降幅度越大。0.5~4 d,各处理组悬浮浓度下降变缓,其中低密度处理组波动较大,在0.5~2 d下降速率仅是中、高密度处理组的1/3和1/5,而2~4 d时下降速率是中、高密度处理组的2.98和2.57倍。说明苦草密度越大,悬浮浓度下降越平稳。4~8 d,低、中、高密度处理组悬浮浓度下降速率分别为0.09、0.11和0.11 mg/(L·h),各处理组趋于稳定。
2.2 移植不同密度苦草对水体TN、TP的影响移植不同密度苦草对水体中TN、TP的去除效果均有显著差异(P<0.05)。由图2可知,试验结束时高密度处理组的水体TN浓度下降了83.70%,显著高于低密度(P<0.01)和中密度处理组(P<0.05)的下降幅度;高、中密度处理组中水体TP浓度比低密度处理组多下降了18%和21%(P<0.01),而高、中密度处理组差异不显著。说明苦草密度越大,越有利于水体TN、TP的去除和沉降。
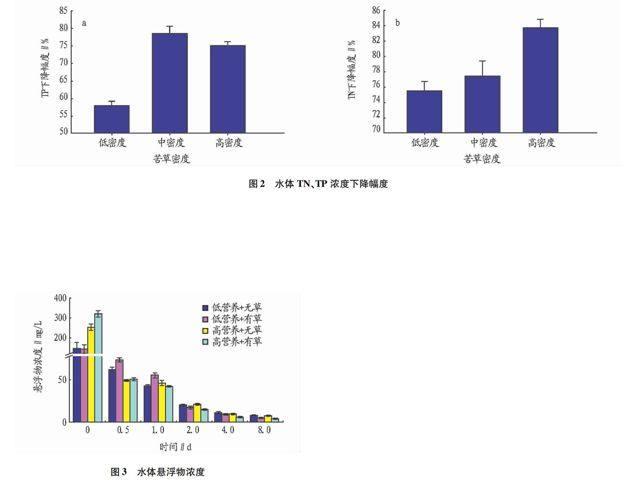
2.3 苦草对不同性质沉积物再悬浮的影响重复测量方差分析表明,沉积物性质和种植苦草对水体悬浮物浓度均有显著影响(P<0.05),并且二者具有交互作用(P<0.01)。沉积物性质不同,苦草对水体悬浮物浓度的作用也不同。由图3可知,试验结束时低营养底泥+无草、低营养底泥+有草、高营养底泥+无草、高营养底泥+有草4个处理组的悬浮物浓度分别为8.00、 5.13、7.86、4.33 mg/L。高营养底泥中,有草组的水体悬浮物浓度下降了316.74 mg/L,比无草组多下降了70.27 mg/L,苦草对悬浮物的去除率为22.19%;低营养底泥中,有草组的水体悬浮物浓度下降了144.87 mg/L,比无草组多下降了11.89 mg/L,去除率仅为8.21%。说明种植苦草促进了再悬浮的沉降,底泥性质会影响苦草对底泥再悬浮的控制作用。无草时,高营养底泥组悬浮物物浓度下降速率为30.81 mg/(L·d),比低营养底泥组高了13.38 mg/(L·d);有草时,高营养底泥组悬浮物浓度下降速率高达39.59 mg/(L·d),比低营养底泥组高了22.18 mg/(L·d),说明沉积物营养含量越高,沉积物再悬浮沉降越快,并且种植苦草更加速沉降。试验期间,不同处理组悬浮物浓度在0~0.5 d快速下降,0.5~4 d缓慢下降,4~8 d趋于稳定。
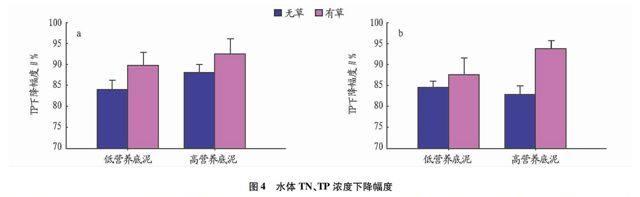
2.4 苦草对水体TN、TP的影响沉积物性质和苦草对水体TN、TP均有显著影响(P<0.05),并且二者有交互作用(P<0.01)。由图4可知,高营养底泥中,有草组TN浓度比无草组多下降了10.94%(P<0.01);低营养底泥中,有草组TN浓度仅比无草组多下降了2.97%。说明种植苦草能够降低水体TN的含量,且高营养底泥中苦草的去除作用更明显。高营养底泥中,有草组TP浓度比无草组多下降了4.51%(P<0.05);低营养底泥中,有草组TP浓度比无草组多下降了5.74%。说明移植苦草能够降低水体TP含量,但是沉积物营养含量对苦草去除TP的作用影响不大。
3 讨论
3.1 水体悬浮物浓度下降的机理水体悬浮物浓度降低与苦草的移植密切相关。Madsen等[16]认为,水生植物抑制再悬浮的能力取决于其单位生物量所占的水体体积,沉水植物对再悬浮的抑制作用既受其生物量在水体中配置特点的影响,同时也受其密度的影响。试验0~0.5 d期间,苦草对水体泥沙沉降的影响主要是通过改变水体上下水动力条件,减小水力挟沙能力实现的。因为水泵虽然停止,但是水体运动不会马上停止,而种植的苦草具有发达的根系和繁密的叶片,能够有效地减小上覆水的流速和水体扰动,降低了扰动能量,并阻碍其进一步向下传导[17],而苦草密度越大,对水流运动的阻碍作用也大,沉降越快。试验4~8 d期间,沉积物再悬浮沉降减缓,苦草开始扎根生长,依靠茎叶的过滤吸附作用去除悬浮泥沙是此时悬浮物浓度降低的主要原因。首先,苦草繁密的枝叶可以形成密集的过滤层,部分悬浮泥沙被截留,有效地充当悬浮物的“陷阱”。黄宜凯等[18]研究认为,悬浮物中的细小颗粒携带电荷,在静电作用下常被吸附在植物的根茎叶上,吸附能力一般与植物表面积有关,面积越大,吸附能力越强。试验中也发现苦草叶片上覆盖了一层泥沙,并且苦草密度越大、叶片越多,富集的泥沙颗粒也越多,导致高密度苦草处理组悬浮物浓度显著低于其他各组。其次,苦草表面分泌助凝物质,促使悬浮泥沙颗粒由分散的悬移质向絮凝团转化,当浮力小于重力时下降沉积于植物根部周围[19-20]。最后,苦草与浮游藻类竞争光照和营养盐,分泌化感物质,抑制藻类生长,可以有效降低水体中的有机悬浮颗粒。
沉积物性质会影响苦草对悬浮泥沙的控制作用。试验结果表明,高营养底泥中苦草对悬浮物的去除率显著高于低营养底泥中的去除率。因为悬浮泥沙本身具有自我沉降作用,扰动停止后,悬浮物悬浮的动态平衡状态被打破,在重力作用下不断发生絮凝沉降。而絮凝的直接原因在于泥沙颗粒的碰撞,碰撞导致泥沙颗粒粘结。悬浮体系泥沙浓度越大,颗粒平均距离越小,单位时间内颗粒自由无碰撞运动距离就越小,碰撞的概率也就越大,絮凝作用越强烈,泥沙絮凝沉降较快[21]。高营养底泥粒径小、粘性大、有机质含量高,扰动后水体悬浮物浓度远远高于低营养底泥处理组,更容易发生颗粒粘结;再加之移植的苦草表面分泌助凝物质,更加速了悬浮物的沉降。
3.2 水体营养盐浓度下降的机理苦草通过吸附沉淀、吸收代谢、富集浓缩等各种综合作用,影响水体营养盐浓度,且其程度受植物种植密度与沉积物性质的影响。首先,苦草对水体氮磷有吸附作用,因为苦草根系发达、具有较大的接触面积,不溶性胶体、附着于根系的细菌(部分凝集的菌胶体)容易被根系粘附或吸附而沉积,使得底泥中的N、P含量升高而减少向上覆水的释放。其次,移植苦草促进悬浮物的沉降从而携带大量颗粒态氮、磷,是短期内水体氮、磷快速下降的主要原因[22]。种植苦草时,高营养底泥组TN的下降幅度远远大于低营养底泥组,一方面可能与沉积物中的营养物质含量有关,高营养底泥TN含量为3.15±0.09 mg/g,低营养底泥仅为1.58±0.05 mg/g,因此苦草促进高营养底泥再悬浮沉降时携带的TN含量更多;另一方面可能与水体初始悬浮物浓度有关,试验开始时高营养底泥组的悬浮物浓度是低营养底泥组的2倍。研究表明,水体悬浮物浓度与水体N含量呈负相关关系,水中颗粒悬浮物大多带负电荷,NH4+N带有正电荷[23]。因此,大量颗粒物对NH4+N的吸附可能也是高营养底泥组TN下降较多的原因之一。最后,苦草及其叶表面的附着藻类与水体浮游植物竞争营养盐,吸收水体N、P,并抑制藻类生长,也会促进水体TN 、TP浓度的降低[24]。另外,王传海等[25]的研究表明,沉水植物的光合作用增加了上覆水和沉积物-水界面氧的含量,不但降低了水体氨氮浓度,而且铁、锰、铝等金属氧化物通过吸附和离子交换也控制磷酸盐的迁移。这可能也是该试验水体移植苦草后TN 、TP下降的原因。
沉水植物是浅水湖泊生态系统中的重要组成部分,一场风浪过后,其密度、覆盖度以及种类等的不同会直接改变其对生态系统的影响。因此,了解沉水植被对沉积物再悬浮的抑制作用,有利于明晰水质改善的机理,加强对沉水植物在生态系统中作用的认识,为治理浅水湖泊富营养化提供理论依据。
4 结论
苦草移植对沉积物再悬浮后的水质控制有明显作用,不仅可以加速沉积物再悬浮的沉降、降低水体悬浮颗粒物浓度、改善水下光照条件,还可以有效降低水体总氮、总磷含量。苦草移植对水质的控制效果与苦草密度及其沉积物性质密切相关,苦草密度越大,沉积物营养含量越高,有利于沉积物再悬浮的沉降和水体TN、TP的去除。总之,苦草移植对沉积物再悬浮后的水质控制效果显著,对于湖泊富营养化治理有重要的意义。
参考文献
[1]KLEEBERG A,HUPFER M,GUST G.Phosphorus entrainment due to resuspension in a lowland River,Spree,NE GermanyA laboratory microcosm study[J].Water,Air,and Soil Pollution,2007,183(1/4): 129-142.
[2] DALLA VECCHIA F,ROCCA N L,MORO I,et al.Morphogenetic,ultrastructural and physiological damages suffered by submerged leaves of Elodea canadensis exposed to cadmium[J].Plant Science,2005,168: 329-338.
[3] 谢平.微囊藻毒素对人类健康影响相关研究的回顾[J].湖泊科学,2009,21(5):603-613.
[4] MADSEN J D,CHAMBERS P A,JAMES W F,et al.The interaction between water movement,sediment dynamics and submersed macrophytes[J].Hydrobiologia,2001,444: 71-84.
[5] 杨荣敏,李宽意,王传海.大型水生植物对太湖底泥磷释放的影响研究明[J].农业环境科学学报,2007,26(S1):274-278.
[6] KRNER S,DUGDALE T.Is roach herbivory preventing recolonization of submerged macrophytes in a shallow lake?[J].Hydrobiologia,2003,506(1/3): 497-501.
[7] FRITIOFF A.Influence of temperature and salinity on heavy metal uptake by submersed plants[J].Environmental Pollution,2005,133: 265-274.
[8] 种云霄.利用沉水植物治理水体富营养化[J].广州环境科学,2005,20(3):41-43.
[9] 胡洪营,门玉洁,锋民.植物化感作用抑制藻类生长的研究进展[J].生态环境,2006,15(1):153-157.
[10] CIURLI A,ZUCCARINI P,ALPI A.Growth and nutrient absorption of two submerged aquatic macrophytes in mesocosms,for reinsertion in a eutrophicated shallow lake[J].Wetlands Ecosystem Manage,2009,17: 107-115.
[11] GOI A,TRAPIDO M,TUHKANEN T.A study of toxicity,boideradability,and some byproducts of ozonised nitrophenols [J].Advances in Environment Research,2004,8(3): 303-311.
[12] HORPPILA J.Effects of submerged macrophytes on sediment resuspension and internal phosphorus loading in Lake Hiidenvesi (Southern Finland)[J].Water Research,2003,37(18): 4468-4474.
[13] HOUWING E J,T NCZOS I C,KROON A,et al.Interaction of submerged vegetation,hydrodynamics and turbidity; analysis of field and laboratory studies[M].Elsevier:Proceedings in Marine Science,2002: 441-453.
[14] 吴振斌,邱东茹,贺锋,等.水生植物对富营养化水体水质净化作用研究[J].武汉植物学研究,2001,19(4): 299-300.
[15] 张运林,秦伯强,陈伟民,等.太湖水体中悬浮物研究[J].长江流域资源与环境,2004,3(13): 266-271.
[16] MADSEN T V,OLESEN B,BAGGER J.Carbon acquisition and carbon dynamics by aquatic isoetids[J].Aquatic Botany,2002,73(4): 351-371.
[17] KLEEBERG A.Effects of aquatic macrophytes on organic matter deposition,resuspension and phosphorus entrainment in a lowland river[J].Freshwater Biology,2010.55(2):326-345.
[18] 黄宜凯,濮培民.湖泊水体中悬浮物降解的实验研究[J].水资源保护,1998(4):27-31.
[19] 朱广伟,秦伯强,高光,等.长江中下游浅水湖泊沉积物中磷的形态及其与水相磷的关系[J].环境科学学报,2004,24(3):281-288.
[20] COOPER P F,FINDLATER B C.Constructed wetlands in water pollution control[M].Oxford:Pergamon Press,1990.
[21] 关许为,陈英祖.长江口泥沙絮凝静水沉降动力学模式的试验研究[J].海洋工程,1995(1):46-50.
[22] 郭长城,王国祥,喻国华.利用水生植物净化水体中的悬浮泥沙[J].环境工程,2006,24(6):31- 33.
[23] 金相灿,屠清瑛.湖泊富营养化调查规范[M] .2版.北京: 中国环境科学出版社,1990:213-215.
[24] 厉恩华.大型水生植物在浅水湖泊生态系统营养循环中的作用[D].武汉:中国科学院研究生院(武汉植物园),2006.
[25] 王传海,李宽意,文明章,等.苦草对水中环境因子影响的日变化特征[J].农业环境科学学报,2007,26(2): 798-800.
责任编辑 宋平 责任校对 况玲玲

