慢性肾脏病与脑小血管病患者磁共振弥散张量成像的相关性研究
朱阿娣,张颖冬,周俊山,徐青青,殷信道
(1南京市江宁区第二人民医院神经内科,南京 211103;南京医科大学附属南京医院:2神经内科,3放射科,南京 210006)
脑小血管病(cerebral small vessel disease,SVD)是导致老年血管性认知障碍、痴呆以及步态和平衡障碍、情绪低落、尿失禁等的主要原因之一[1]。早期发现和处理血管危险因素特别是SVD具有重要意义。慢性肾脏病(chronic kidney disease,CKD)已被证实是SVD的一个独立的危险因素[2]。近年来,关于CKD与SVD的研究多集中在常规磁共振成像(magnetic resonance imaging,MRI)可见的脑白质病变区,而脑白质病变周围看似正常的脑白质微结构是否受到影响,目前研究较少。本研究以54例SVD患者为研究对象,对其进行磁共振弥散张量成像(diffusion tensor imaging,DTI)研究,探讨CKD与DTI之间的关系。
1 对象与方法
1.1 研究对象
选取2012年10月至2014年5月南京医科大学附属南京医院神经内科诊治的SVD患者54例,均符合SVD专家共识的诊断标准[3]。其中男性46例,女性8例;年龄44~90(66.44±12.25)岁;均为右利手,且签署知情同意书。均经影像学证实,MRI显示有腔隙性脑梗死或脑白质病变,无皮质下及分水岭梗死,皮质下无直径>15mm的病灶,脑白质病变Fazekas分级<2级;颈部血管超声显示无明显颈动脉狭窄;血管MRI显示无颅内大动脉狭窄或闭塞。排除标准:(1)颅脑损伤、颅内肿瘤、多发性硬化、帕金森病、痴呆、癫痫等累及中枢神经系统的疾病;(2)嗜酒、吸毒或其他精神性药物滥用者(如抗精神病药、苯二氮类药等);(3)合并严重内科急症,如心肺肝肾功能衰竭、感染、免疫性疾病等;(4)MRI禁忌证或已知的幽闭恐怖症。
1.2 方法
1.2.1 肾小球滤过率(glomerular filtration rate,GFR)的测定 患者在入院第2日清晨,空腹采外周静脉血4ml,用于肾功能、血脂等生化指标的测定,由奥林巴斯AU5421全自动生化分析仪完成。血总胆固醇≥5.18mmol/L为高胆固醇血症,三酰甘油≥1.70mmol/L为高三酰甘油血症(hypertriglyceridemia,HTG),血清超敏C反应蛋白(high-sensitivity C-reactive protein,hs-CRP),正常参考值<3mg/L。GFR由血肌酐水平通过Cockcroft-Gault公式估算,GFR<60(ml/min·1.73m2)定义为CKD[4],根据CKD诊断标准分组,CKD组17例,非CKD组37例。
1.2.2 头颅MRI检查 采用Philips,Achieva Tx 3.0T MRI系统,在入院24h内进行头颅MRI检查,扫描序列及参数包括,T1WI[重复时间(repetition time,TR)/回波时间(echo time,TE)2000/20ms],T2WI(TR/TE 3000/80ms),液体衰减反转恢复序列[(FLAIR)TR/TE/TI 11000/125/2800ms],DWI(TR/TE 2245/90ms,FOV 210×210×118,矩阵140×109像素,bmax1000s/mm2)。DTI扫描采用单次激发SE EPI序列(TR/TE 6636/90,NEX 2;FOV 224×224×120,矩阵112×112,像素大小为2mm×2mm×2mm,层厚2mm,层间距0.2mm,60层连续扫描)。15个方向上施加弥散梯度和一个没有弥散加权的采集,其中b=800s/mm2。
1.2.3 图像后处理 数据处理应用Philips专用后处理软件EWS2.6.3.3对DTI原始采集图像进行后处理,应用弥散对齐软件包对DTI原始图像进行对齐,进行涡流校正以及头动校正,提高图像质量,显示部分各向异性(fractional anisotropy,FA)图,表观扩散系数(apparent diffusion coefficient,ADC)图。在FA图及ADC图上基于感兴趣法分别测得两侧额叶、半卵圆中心、尾状核、豆状核、丘脑等感兴趣区(region of interest,ROI,约8mm2)的FA值及ADC值。所有测量值均由两位与本研究无关的独立研究者完成,一共测量3次,取其平均值。
1.3 统计学处理
采用SPSS19.0统计软件,两组FA值、ADC值的比较采用独立样本t检验,相关性采用Pearson相关分析。以P<0.05为差异有统计学意义。
2 结 果
2.1 两组患者基本资料比较
与非CKD组比较,CKD组GFR明显降低(P<0.001)。两组年龄、性别、糖尿病史、高血压病史、高胆固醇血症、HTG、hs-CRP比较,差异均无统计学意义(P>0.05;表1)。

表1 两组患者基本资料比较Table 1 Comparison of general characteristics between non-CKD group and CKD group
2.2 两组患者各脑区FA值比较
与非CKD组比较,CKD组双侧半卵圆中心、丘脑和右侧额叶FA值明显降低(P<0.05);而两组双侧尾状核、豆状核和左侧额叶FA值比较,差异均无统计学意义(P>0.05;图1,表2)。

图1 半卵圆中心FA图Figure 1 FA of centrum semiovale
表2 两组各脑区FA值比较Table 2 Comparison of the FA values in the brain regions between non-CKD group and CKD group(±s)
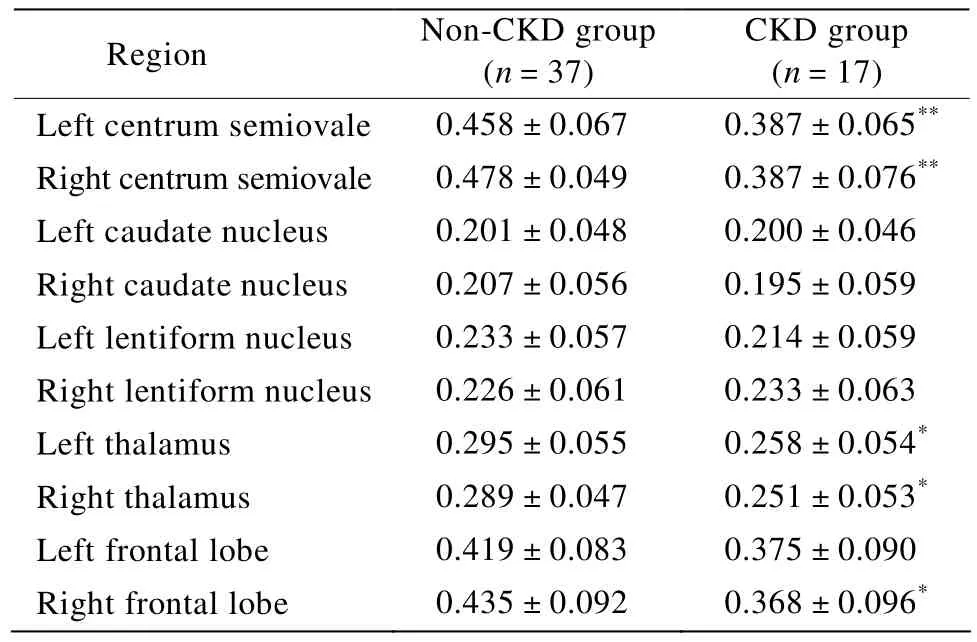
表2 两组各脑区FA值比较Table 2 Comparison of the FA values in the brain regions between non-CKD group and CKD group(±s)
FA:fractional anisotropy;CKD:chronic kidney disease.Compared with non-CKD group,*P<0.05,**P<0.01
Region Non-CKD group(n=37)CKD group(n=17)Left centrum semiovale 0.458±0.067 0.387±0.065**Right centrum semiovale 0.478±0.049 0.387±0.076**Left caudate nucleus 0.201±0.048 0.200±0.046 Right caudate nucleus 0.207±0.056 0.195±0.059 Left lentiform nucleus 0.233±0.057 0.214±0.059 Right lentiform nucleus 0.226±0.061 0.233±0.063 Left thalamus 0.295±0.055 0.258±0.054*Right thalamus 0.289±0.047 0.251±0.053*Left frontal lobe 0.419±0.083 0.375±0.090 Right frontal lobe 0.435±0.092 0.368±0.096*
2.3 两组患者各脑区ADC值比较
与非CKD组比较,CKD组双侧半卵圆中心、右侧额叶ADC值明显升高(P<0.05);而两组双侧尾状核、豆状核、丘脑和左侧额叶ADC值比较,差异均无统计学意义(P>0.05;图2,表3)。
2.4 Pearson相关分析
双侧半卵圆中心及左侧丘脑FA值与GFR呈正相关(r=0.591,P=0.000;r=0.544,P=0.000;r=0.282,P=0.039);双侧半卵圆中心ADC值与GFR 呈负相关(r=-0.490,P=0.000;r=-0.405,P=0.002)。
3 讨 论

图2 半卵圆中心ADC图Figure 2 ADC of centrum semiovale
表3 两组各脑区ADC值比较Table 3 Comparison of the ADC values in the brain regions between non-CKD group and CKD group(10-3mm2/s,±s)

表3 两组各脑区ADC值比较Table 3 Comparison of the ADC values in the brain regions between non-CKD group and CKD group(10-3mm2/s,±s)
ADC:apparent diffusion coefficient;CKD:chronic kidney disease.Compared with non-CKD group,*P<0.05
Region Non-CKD group(n=37)CKD group(n=17)Left centrum semiovale 0.734±0.088 0.895±0.266*Right centrum semiovale 0.733±0.094 0.877±0.270*Left caudate nucleus 0.715±0.094 0.769±0.172 Right caudate nucleus 0.729±0.080 0.784±0.142 Left lentiform nucleus 0.706±0.126 0.753±0.172 Right lentiform nucleus 0.740±0.138 0.801±0.187 Left thalamus 0.767±0.113 0.794±0.115 Right thalamus 0.765±0.083 0.794±0.139 Left frontal lobe 0.778±0.076 0.777±0.124 Right frontal lobe 0.767±0.074 0.822±0.102*
SVD是指脑小血管的各种病变所导致的临床、认知、影像学及病理表现的综合征[5]。影像学表现分为脑白质病变、腔隙性梗死和脑微出血[6]。病变累及颅内小血管(包括小动脉、微动脉、前毛细血管和小静脉)[7]。CKD是脑白质病变、静息性脑梗死与脑微出血的独立危险因素,肾损害可预测SVD的存在和严重性[8]。小血管病是系统疾病,小血管病在某一器官发病的同时也可对其他器官带来损害。脑和肾均属于低阻抗终末器官,其小血管系统的解剖结构和血管调控机制相似,它们在整个心动周期均暴露于高流量血液冲击下,肾的小血管病理变化在脑小血管可能同样存在[9]。Ito等[10]提出了“应变血管假说”,他们认为该假说可以作为脑−心−肾之间的关联机制。另外,一氧化氮(nitric oxide,NO)水平下降或许是CKD与SVD关联中的一个关键因素。NO被认为与微血管的功能障碍或损伤有关。Baylis[11]通过文献综述得出结论:NO缺乏较常见于肾脏疾病患者,NO通过对微循环和血脑屏障进行调节从而延缓SVD的进展。
GFR作为CKD临床指标,不但与肾小球小血管疾病密切相关,也与SVD密切相关,潘晓帆等[12]的研究发现,GFR可能优于心血管危险因素成为小血管疾病的预测指标。Oksala等[13]的研究显示,急性脑梗死患者的SVD与肾功能水平密切相关。伴有SVD和肾功能损害[GFR下降,GFR<60ml(min·1.73m2)的脑卒中患者远期存活率低,而该研究中涉及的SVD包括脑白质病变、腔隙性脑梗死等。Takahashi等[14]对2 106例无卒中史的受试者进行研究表明,无症状脑梗死、皮质下深部白质高信号和脑室旁白质高信号的发病率与GFR的下降显著相关,轻度的肾功能障碍可能独立于高血压而与SVD的增加相关。
DTI是在MRI弥散加权成像基础上发展起来的功能MRI成像技术,首次实现了对脑白质纤维连接的定量分析,能无创性地评估组织结构的完整性与连通性[15]。DTI用所测得的多种参数值进行成像,最常用的是FA值,是指弥散张量中的水分子各向异性部分所占整个弥散张量的比例。FA值越高表明组织的各向异性越强,组织排列得越紧密,FA值的大小与髓鞘、微管、微丝的完整性、神经纤维排列的紧密程度及走行方向密切相关。ADC值反映水分子在组织内的弥散运动能力,ADC值越大,说明组织内所含自由水分子越多,扩散能力越强。将两个参数结合起来可以更准确地了解脑白质的形态改变。
本研究利用DTI,选择性地避开腔隙性梗死和白质病变区,选取T1WI、T2WI看似“正常”的白质区域和部分灰质核团作为ROI进行检查。结果发现,CKD组双侧半卵圆中心、丘脑和右侧额叶FA值显著低于非CKD组,差异有统计学意义;双侧半卵圆中心和右侧额叶ADC值显著高于非CKD组,差异有统计学意义。提示合并CKD的SVD患者常规MRI看似正常的部分区域,在应用DTI技术时可发现神经结构已发生微观变化。de Groot等[16]的前瞻性研究显示,利用DTI测定689例老年人常规MRI所见正常脑白质区域微细结构改变,随访3.5年后发现,FA降低、ADC升高的白质区域更易发展为脑白质病变。本研究还发现,CKD组双侧半卵圆中心及左侧丘脑FA值与GFR呈正相关;双侧半卵圆中心ADC值与GFR呈负相关。提示GFR下降预示着脑微观结构的改变,CKD与SVD密切相关。
综上所述,DTI可在异常信号出现之前极其敏感地检测到SVD患者脑组织微观结构的变化,且DTI参数值与GFR有密切的关系,为评价CKD并发SVD提供研究工具。
【参考文献】
[1]Pantoni L.Cerebral small vessel disease:from pathogenesis and clinical characteristics to therapeutic challenges[J].Lancet Neurol,2010,9(7):689−701.
[2]Mogi M,Horiuchi M.Clinical interaction between brain and kidney in small vessel disease[J].Cardiol Res Pract,2011,2011:306189.
[3]The Diagnosis and Treatment of Cerebral Small Vessel Disease Expert Consensus Group.Expert consensus of diagnosis and treatment of cerebral small vessel disease[J].Chin J Intern Med,2013,52(10):893−896.[脑小血管病诊治专家共识组.脑小血管病的诊治专家共识[J].中华内科杂志,2013,52(10):893−896.]
[4]Miwa K,Tanaka M,Okazaki S,et al.Chronic kidney disease is associated with dementia independent of cerebral small-vessel disease[J].Neurology,2014,82(12):1051−1057.
[5]Wardlaw JM,Smith C,Dichgans M.Mechanisms of sporadic cerebral small vessel disease:insights from neuroimaging[J].Lancet Neurol,2013,12(5):483−497.
[6]Benjamin P,Lawrence AJ,Lambert C,et al.Strategic lacunes and their relationship to cognitive impairment in cerebral small vessel disease[J].Neuroimage Clin,2014,4:828−837.
[7]Hilal S,Ong YT,Cheung CY,et al.Microvascular network alterations in retina of subjects with cerebral small vessel disease[J].Neurosci Lett,2014,577:95−100.
[8]Toyoda K.Cerebral small vessel disease and chronic kidney disease[J].J Stroke,2015,17(1):31−37.
[9]Liu ZB,Zhao YC.Chronic kidney disease and cerebral small vessel disease[J].Clin Misdiagn Misther,2013,26(2):104−107.[刘振宝,赵迎春.慢性肾脏病与脑小血管病[J].临床误诊误治,2013,26(2):104−107.]
[10]Ito S,Nagasawa T,Abe M,et al.Strain vessel hypothesis:a viewpoint for linkage of albuminuria and cerebro-cardiovascular risk[J].Hypertens Res,2009,32(2):115−121.
[11]Baylis C.Nitric oxide deficiency in chronic kidney disease[J].Am J Physiol Renal Physiol,2008,294(1):F1−F9.
[12]Pan XF,Zhou QD,Hua J,et al.Correlative study of renal function and CT quantitative indicators of cerebral small vessel disease[J].Chin J Pract Nerv Dis,2010,13(17):1−3.[潘晓帆,周其达,华 健,等.肾功能与脑小血管疾病CT定量指标的相关性研究[J].中国实用神经病杂志,2010,13(17):1−3.]
[13]Oksala NK,Salonen T,Strandberg T,et al.Cerebral small vessel disease and kidney function predict long-term survival in patients with acute stroke[J].Stroke,2010,41(9):1914−1920.
[14]Takahashi W,Tsukamoto Y,Takizawa S,et al.Relationship between chronic kidney disease and white matter hyperintensities on magnetic resonance imaging[J].J Stroke Cerebrovasc Dis,2012,21(1):18−23.
[15]Lee SK,Kim DI,Kim J,et al.Diffusion-tensor MR imaging and fiber tractography:a new method of describing aberrant fiber connections in developmental CNS anomalies[J].Radiographics,2005,25(1):53−65.
[16]de Groot M,Verhaaren BF,de Boer R,et al.Changes in normal-appearing white matter precede development of white matter lesions[J].Stroke,2013,44(4):1037−1042.

