MALDI质谱分析PEG5000和BSA的实验教学设计
刘雅琴, 邹建凯, 裘雅渔
(浙江大学 化学系,浙江 杭州 310027)
MALDI质谱分析PEG5000和BSA的实验教学设计
刘雅琴, 邹建凯, 裘雅渔
(浙江大学 化学系,浙江 杭州 310027)

基质辅助激光解吸电离飞行时间质谱(MALDI-TOF MS)是质谱分析中新型的大型仪器之一,通过开设新型大型仪器MALDI-TOF质谱的实验课程,有效地开拓学生的专业视野。针对不同的样品选择不同的基质和采取不同的检测模式,本实验以不同分子量范围的两种代表性样品聚乙二醇5000和牛血清白蛋白(66 KD)为例,聚乙二醇5000选择2,5-二羟基苯甲酸作为基质;牛血清白蛋白选择芥子酸为基质,进行质谱检测。有效地让学生了解MALDI仪器的性能和应用范围,为他们今后从事科学研究工作奠定良好的基础,也让大型仪器全面支撑研究生教学,进一步提高了分析仪器的利用率。
MALDI质谱; BSA蛋白; 实验教学; 大型仪器
0 引 言
在化学分析中,质谱与核磁共振、红外光谱、紫外光谱被认为是有机结构分析的四大表征工具。有机质谱具有特别重要的地位,是近代分析中的重要技术之一,20世纪80年代末诞生的基质辅助激光解吸电离技术,使传统的主要用于小分子物质研究的质谱技术发生革命性的变革,扩展到高极性、难挥发和热不稳定的大分子的分析研究[1-3]。近30年来,质谱发展非常迅速,基质辅助激光解吸电离飞行时间质谱(Matrix-Assisted Laser Desorption/Ionization Time of Flight Mass Spectrometry,MALDI-TOF-MS),在大分子领域的应用为质谱的发展注入了新的活力,形成了独特的生物质谱技术。MALDI-TOF-MS具有灵敏度高、准确度高及分辨率高等优点,为生命科学、医学和材料科学等领域提供了一种强有力的分析测试手段,发挥着越来越重要的作用[4-11]。
为了开拓学生的专业视野,我系将新型的有机质谱MALDI-TOF MS仪器加入到研究生的仪器分析实验课程中。本实验首先用标准品进行仪器的质量校准,然后在反射模式下对聚乙二醇5000 (PEG5000)样品进行检测;在线性模式下对牛血清白蛋白样品(BSA)进行检测。通过对MALDI质谱检测参数的微调,分别获得高分辨的PEG5000质谱图和相对分子质量为66KD的大分子BSA质谱图。整个实验时间控制在3 h以内,操作简便,可重复性高,适合在研究生实验教学中应用。
1 实验原理
仪器主要由两部分组成:基质辅助激光解吸电离离子源(MALDI)和飞行时间质量分析器(TOF),如图1所示。MALDI的原理有多种假说,但公认的一个机制是用激光照射样品与基质形成的共结晶薄膜,基质从激光中吸收能量传递给生物分子,而电离过程中将质子转移到生物分子或从生物分子得到质子,而使生物分子电离的过程。它是一种软电离技术,适用于混合物及生物大分子的测定。TOF的原理是离子在电场作用下加速飞过飞行管,根据到达检测器的飞行时间不同而被检测,即所测定的离子的质荷比(m/z)与离子的飞行时间成正比。通常在MALDI源中产生的主要是完整的准分子离子,这也是MALDI质谱图的最大特点之一。由于MALDI所产生的质谱图多为单电荷离子,其质谱图中的离子与多肽和蛋白质的质量常常有一一对应关系[12]。
2 仪器与试剂
Bruker公司的基质辅助激光解吸电离飞行时间质谱仪,型号Ultraflex。聚乙二醇5000购自国药集团化学试剂有限公司(化学纯),牛血清白蛋白(BSA)购自生工生物工程(上海)股份有限公司, 2,5-二羟基苯甲酸(DHB)和芥子酸(SA) 购自美国布鲁克?道尔顿公司(色谱纯)。
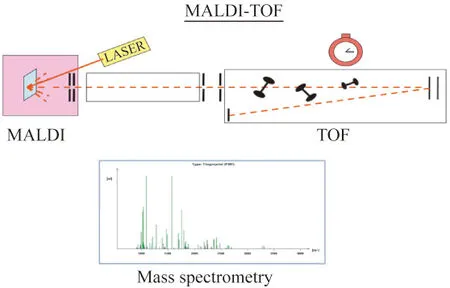
图1 MALDI-TOF 质谱仪的构造和原理
3 实验部分
3.1 实验流程
实验流程见图2。
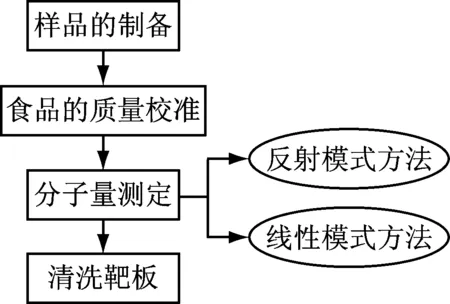
图2 MALDI-TOF的实验流程
3.2 实验步骤
(1) 样品的制备。根据样品的性质和相对分子质量范围,本实验选择两种代表性样品聚乙二醇5000和牛血清白蛋白(66 KD),聚乙二醇5000选择2,5-二羟基苯甲酸作为基质;牛血清白蛋白选择芥子酸为基质。移动1 μL样品和1 μL基质均匀混合,将1 μL混合溶液点在样品靶上,自然干燥,进行质谱检测。
(2) 质量校准。选择相应质量数的校准文件,采集谱图,进行校准。若误差值较大,应反复校准,直到满足要求。如图3所示,外标物为Bradykinin(1~7) (757.399Da),Angiotensin II (1 046.542 Da),Angiotensin I (1 296.695Da),Substance P (1 347.735Da),Bombesin (1 619.822 Da),ACTH_clip(1~17) (2 093.086 Da),ACTH_clip (18~39) (2 465.198 Da) 和 Somatostatin 28 (3 147.471Da)。
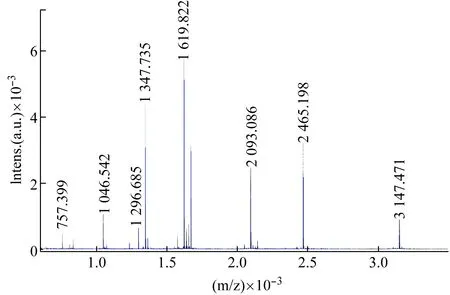
图3 外标物的质量校准质谱图
(3) 相对分子量质测定:采用不同模式MALDI-TOF MS 进行分析,仪器参数设置如下:① 测定PEG5000时,激光波长355 nm,加速电压25.0 kV,反射电压26.5 kV,脉冲离子提取时间130 ns, 聚焦电压8.0 kV,反射检测器电压2.305 kV。② 测定BSA蛋白时,激光波长355 nm,加速电压25.0 kV,脉冲离子提取时间500 ns,聚焦电压34.0 kV。线性检测器电压2.955 kV。在测量过程中可随时调整激光能量和靶板位置以获得最佳信噪比和分辨率。
(4) 测试结束,退靶,取出靶板,关闭软件。普通靶板的清洗方法,顺序依次为: 热水擦洗; 甲醇或乙腈擦洗;丙酮或异丙醇浸没靶板超声20 min;100% Millipore纯水擦洗;自然晾干,放入靶板盒。
4 实验结果与讨论
教学实验必须具有理论依据明确、操作步骤简便、结果稳定、再现性高等特点[13]。为了达到上述要求,对基质的选择、聚乙二醇5000的质谱分析和牛血清白蛋白的质谱分析三个方面做了深入细致地探讨。
4.1 基质的选择
基质的使用是MALDI电离技术的关键,基质吸收了激光的大部分能量并气化,同时将样品分子带入气相,样品分子只吸收少量的激光能量,避免了被分析物分子化学键的断裂。此外,基质在样品离子形成过程中还充当质子化或去质子化试剂,使样品分子带上正电荷或负电荷。目前,常用于分析蛋白质和多肽的基质是一些能够很好的吸收和传递激光能量小分子的有机酸及其衍生物,实际使用时也需要根据被分析物的要求作相应选择。一般说来,基质α-氰基-4-羟基肉桂酸(CHCA)适用于多肽类或相对分子质量小于10KD的样品,芥子酸适用于相对分子质量较大(>10KD)的蛋白质样品和极性聚合物,而2,5-二羟基苯甲酸则适用于有机合成分子或极性聚合物等样品,如表1所示。
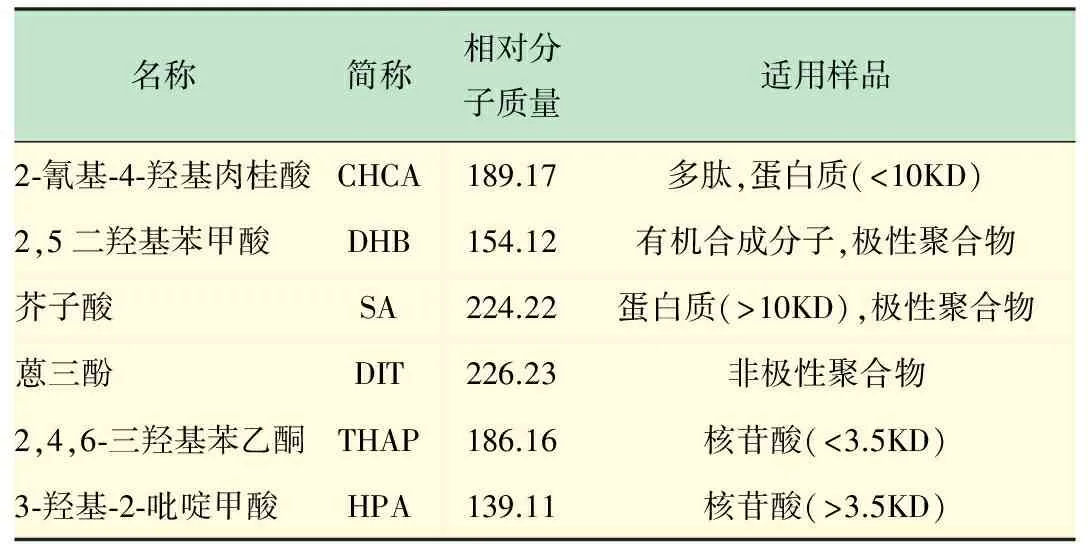
表1 常用基质的基本信息
4.2 聚乙二醇5000的质谱分析
样品聚乙二醇5000的质谱图,如图4所示,最强峰m/z是5166.152,这与样品本身的相对分子质量范围相吻合。其中,质谱峰m/z 5 166.152与5 254.305之间的质量差值为88,可推断是相差2个CH2CH2O结构单元的分子离子峰,这一结果与样品本身的是聚乙二醇的特征相一致。反射模式下,样品分子离子在加速电压的作用下,飞行至管道末端再受到反射电压的作用进入反射场区。在进入反射场区前,即在飞行管道末端的延迟电场补偿了分子离子的初始空间和能量分布[14],待离子达到零动能状态后,再次受到反方向电压的作用运动至反射检测器,其飞行距离比线性模式长。因此反射模式提高了质谱分辨率,特别是分子量在4 000 Da以下的分子[15]。
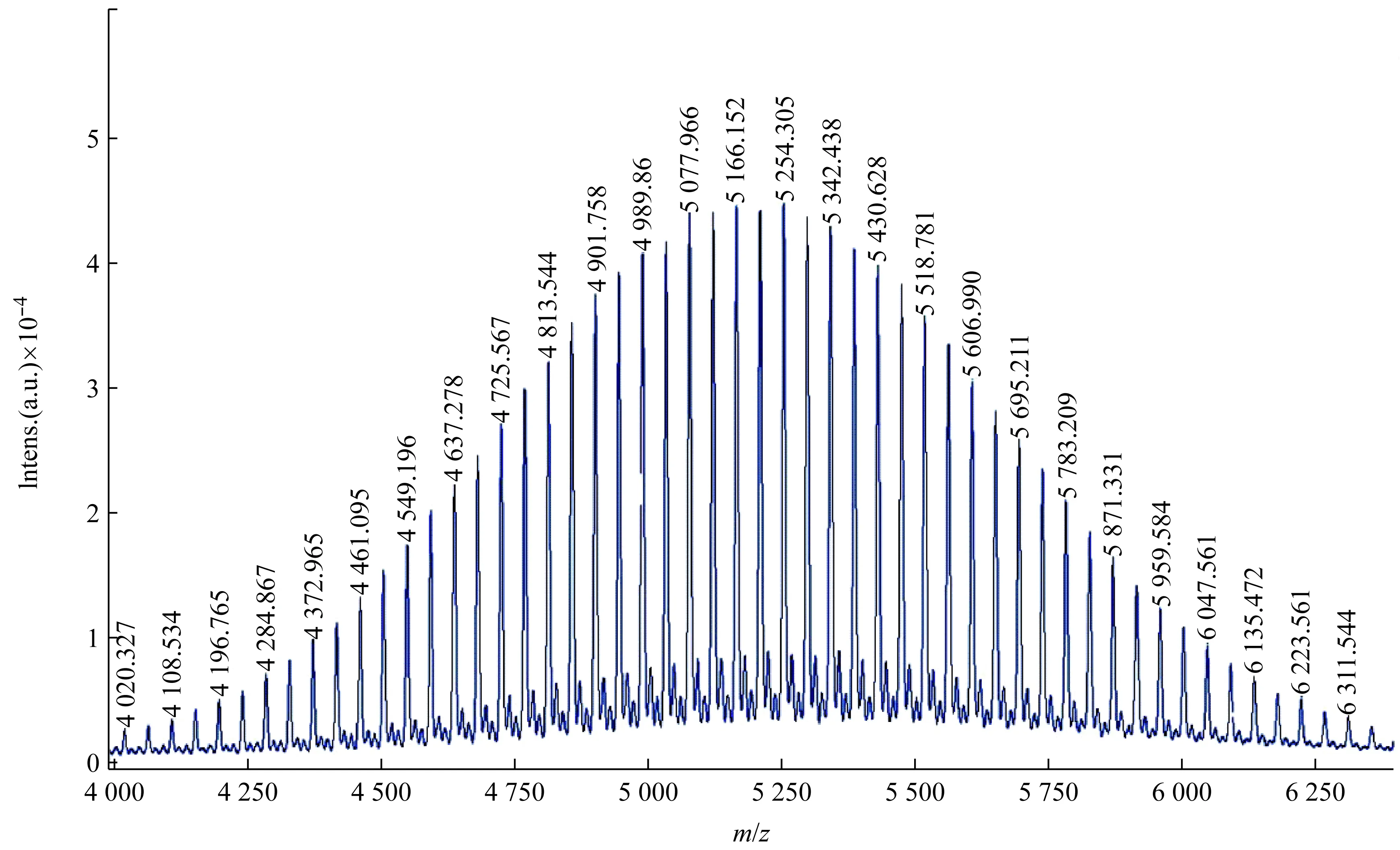
图4 样品聚乙二醇5000的质谱图
4.3 牛血清白蛋白的质谱分析
样品牛血清白蛋白的质谱图,如图5所示,最强峰 m/z 66 161.347对应为牛血清白蛋白的单聚体单电荷分子离子峰,这与文献报道的牛血清白蛋白的单聚体分子量为66~68KD相吻合。质谱峰 m/z 132 573.981对应为牛血清白蛋白的二聚体单电荷峰,质谱峰 m/z 33048.976对应为牛血清白蛋白的单聚体双电荷峰,剩下的可能是杂质峰。在线性模式下,离子未经过反射作用及较短的飞行距离可能更好地保留大分子的高聚物,但其形成的分子离子峰较宽,分辨率较低,无法分辨同位素峰。
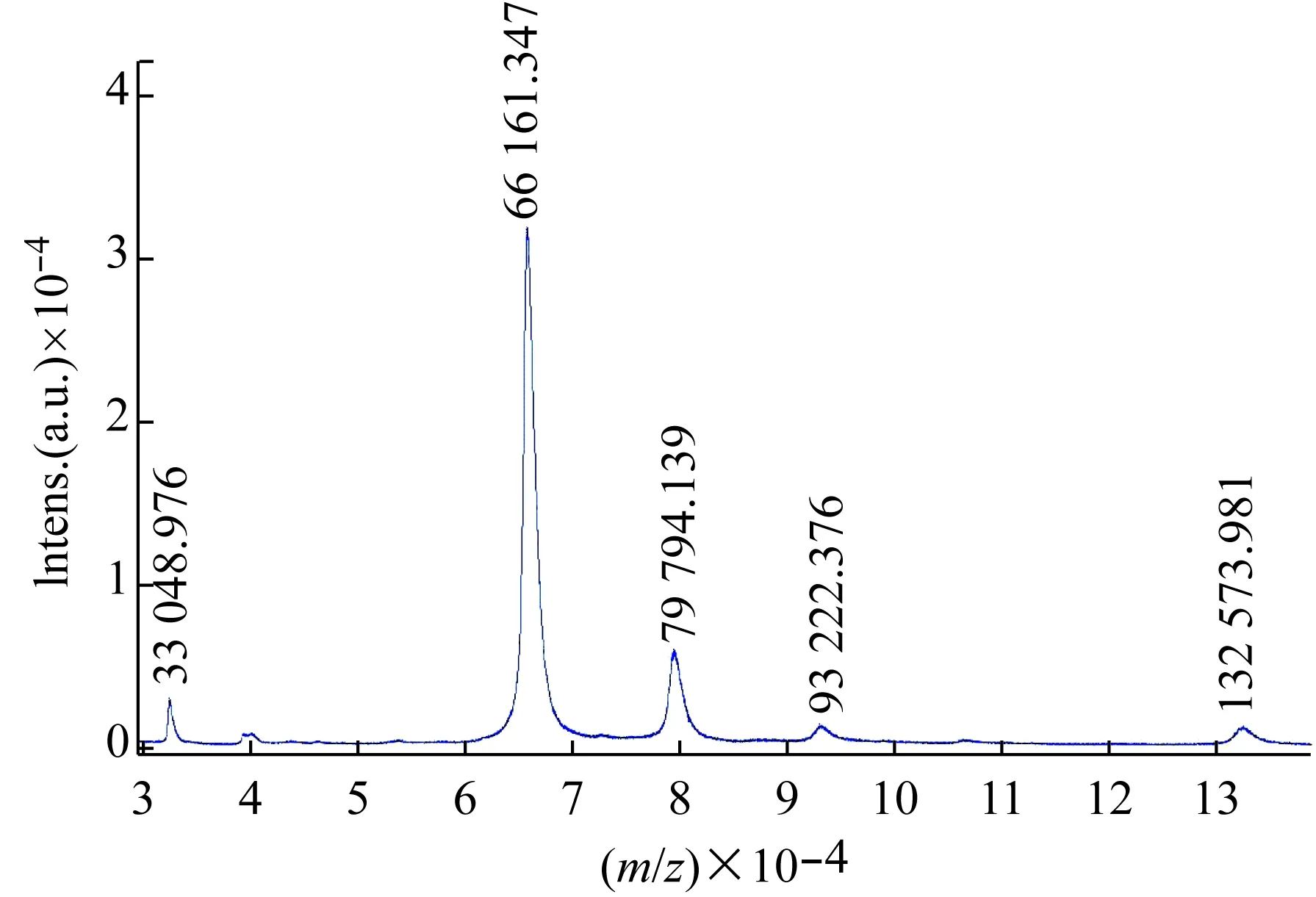
图5 牛血清白蛋白的质谱图
5 结 语
为开拓学生的专业视野,我系将新型大型仪器有机质谱仪MALDI-TOF MS加入到研究生的仪器分析实验课程中。根据样品的性质和分子量范围,本实验选择两种代表性样品聚乙二醇5000和牛血清白蛋白(66 KD)展开实验进行MALDI质谱分析。
综上所述, 本实验过程中,学生可以自主使用MALDI-TOF质谱大型仪器对样品进行测试分析,需要针对样品的性质选择不同的基质,根据样品所处质量范围利用不同检测模式,了解反射模式具有分辨率高而线性模式具有灵敏度高的特点。使他们有效地掌握了相关测试手段,也让大型仪器全面支撑研究生教学,进一步提高了分析仪器的利用率。本实验的设计提出基于科研工作,实验条件简单,涉及有机化学、生物化学、物理知识等多方面内容,将科研与教学有机结合,能够使学生充分了解科学研究的基本步骤及过程,开拓专业视野及培养创新思维具有重要意义[16]。能够有效提高学生的科研兴趣,为他们今后从事科学研究工作奠定良好的基础,培养更多技术型人才。
[1] Liang Li. MALDI mass spectrometry for synthetic polymer analysis [M]. Canada, John Wiley & Sons, Inc., 2010.
[2] 周新文,金 红,杨芃原. 基于MALDI源生物质谱技术平台的建立[J]. 实验室研究与探索, 2011, 30 (11): 398-401.
[3] Dai H, Zhang X Q, Harasymow S,etal. MALDI-TOF mass spectrometry provides an efficient approach to monitoring protein modification in the malting process[J]. International Journal of Mass Spectrometry, 2014, 371:8-16.
[4] Walterova Z, Horsko J. Quantification in MALDI-TOF mass spectrometry of modified polymers.[J]. Anal Chim Acta, 2011, 693(1-2):82-88.
[5] Panda A, Ghosh A K, Mirdha B R,etal. MALDI-TOF mass spectrometry for rapid identification of clinical fungal isolates based on ribosomal protein biomarkers[J]. Journal of Microbiological Methods, 2015, 109:93-105.
[6] Yun M, Feng T, Yan S G,etal. High-throughput genotyping of single-nucleotide polymorphisms in ace-1 gene of mosquitoes using MALDI-TOF mass spectrometry.[J]. Insect Science, 2013, 20(2):167-174.
[7] Agustini B C, Silva L P, Jr B C,etal. Evaluation of MALDI-TOF mass spectrometry for identification of environmental yeasts and development of supplementary database.[J]. Appl Microbiol Biotechnol, 2014, 98(12):5645-5654.
[8] Levchenko S M, Rebriev A V, Tkachuk V V,etal. Studies on interaction of oligoadenylates with proteins in vitro by MALDI-TOF mass spectrometry[J]. Biopolymers & Cell, 2013, 29(1):42-48.
[9] Kirschhofer F, Rieder A, Prechtl C,etal. Quartz crystal microbalance with dissipation coupled to on-chip MALDI-ToF mass spectrometry as a tool for characterising proteinaceous conditioning films on functionalised surfaces.[J]. Analytica Chimica Acta, 2013, 802:95-102.
[10] Sophie M. Frohlich, Victoria Dorrer, Vasiliki-Maria Archodoulaki,etal. Synovial fluid protein adsorption on polymer-based artificial hip joint material investigated by MALDI-TOF mass spectrometry imaging[J]. Eupa Open Proteomics, 2014:70-80.
[11] Almasoud N, Yun X, Nicolaou N,etal. Optimization of matrix assisted desorption/ionization time of flight mass spectrometry (MALDI-TOF-MS) for the characterization of Bacillus and Brevibacillus species.[J]. Analytica Chimica Acta, 2014, 840(1):49-57.
[12] Karas M, Gluckmann M, Schafer J. Ionization in matrix-assisted laser desorption /ionization: singly charged molecular ions are the lucky survivors [J]. J Mass Spectrom., 2000, 35(1): 1-12.
[13] 韩云海,吴焕周,丁晓玲. 化学探索性实验的教学过程设计[J]. 实验室研究与探索, 2007, 26 (1):148-150.
[14] Vertes A, Levine R D, Sublimation versus fragmentation in matrix-assisted laser desorption [J]. Chemical Physics Letters, 1990,171(4): 284-290.
[15] 周海超,林益明,柴纬明. 反射模式与线性模式MALDI-TOF MS联合分析荔枝果核缩合单宁[J]. 化学学报, 2011, 69(24): 2981-2986.
[16] 岑卫健,朱平川. 基于双向电泳-MALDI质谱分析的蛋白组学本科教学实验[J]. 实验科学与技术,2014,12(2): 35-37.
Experiments Teaching on MALDI-TOF MS Analysis of PEG5000 and BSA
LIUYa-qin,ZOUJian-kai,QIUYa-yu
(Department of Chemistry, Zhejiang University, Hangzhou, 310027, China)
Matrix assisted laser desorption ionization time of flight mass spectrometry (MALDI-TOF MS) is one of the new type of precision instruments in mass spectrometric analysis. Through teaching experiment of MALDI-TOF mass spectrometry, the professional vision of students is widened effectively. According to the property of samples, different matrices and detection models are selected. In this paper, the samples of polyethylene glycol 5000 and bovine serum albumin (66KD) were taken as typical examples, the 2, 5-dihydroxybenzoic acid is selected as a matrix of polyethylene glycol 5000, while sinapinic acid as the matrix of bovine serum albumin for mass spectrometric detection. It made students understand the properties and application of the MALDI instrument, and made a good foundation for their future engaged in scientific research. Furthermore, the precision instruments supporting graduate teaching were revealed, by which the utilization rate of analysis instrument was also improved.
MALDI mass spectrometry; bovine serum albumin; experiment teaching; large-scale precision instruments
2014-11-03
浙江省科技厅公益性技术应用研究计划项目(2015C37007);浙江大学资助项目(SYB201402)
刘雅琴(1981-),女,湖北十堰人,博士,助理研究员,主要从事MALDI质谱和核磁共振研究。
Tel.:13777850547,0571-87951264;E-mail:yaqin86@zju.edu.cn
O 657.63;G 642.0
A
1006-7167(2015)10-0183-04

