超表达葡萄糖脱氢酶促进大肠杆菌生长
郑 跃,裴庆慧,葛喜珍,田平芳,*
(1.北京化工大学生命科学与技术学院,北京100029;2.北京联合大学生物化学工程学院,北京100023)
超表达葡萄糖脱氢酶促进大肠杆菌生长
郑 跃1,裴庆慧2,葛喜珍2,田平芳1,*
(1.北京化工大学生命科学与技术学院,北京100029;2.北京联合大学生物化学工程学院,北京100023)
通过PCR扩增了肺炎克雷伯氏菌(Klebsiella pneumoniae)和大肠杆菌(Escherichia coli)各自的葡萄糖脱氢酶基因KPgdh和ECgdh,构建了表达载体pET-28a-KPgdh和pET-28a-ECgdh,转化大肠杆菌E.coli BL21,获得了重组菌BL21(pET-28a-KPgdh)和BL21(pET-28a-ECgdh)。经IPTG诱导,聚丙烯酰胺凝胶电泳显示重组菌实现了葡萄糖脱氢酶的高效表达,且葡萄糖脱氢酶活性分别是空质粒对照菌E.coli BL21(pET-28a)的8.5倍和12倍。重组菌的生长速度快于空质粒对照菌E.coli BL21(pET-28a),并与原代菌E.coli BL21持平。如果扣除质粒复制造成的代谢负荷,过表达葡萄糖脱氢酶促进了大肠杆菌的生长。
大肠杆菌,肺炎克雷伯氏菌,葡萄糖脱氢酶,超表达,细胞生长
葡萄糖脱氢酶(Glucose dehydrogenase)广泛存在于生物体,如牛心脏、大肠杆菌、洋葱伯克霍尔德菌(Burkholderiacepacia)、弱氧化葡糖杆菌(Gluconobacter suboxydans)、枯草芽孢杆菌(Bacillus subtilis)等[1-4]。葡萄糖脱氢酶在食品领域有重要的作用,它参与磷酸戊糖途径,以NAD+(NADP+)为辅基,特异催化β-D-葡萄糖生成葡萄糖酸[5-6],进而与钙盐反应生成可促进人体补钙吸收的葡萄糖酸钙[7]。D-核糖是一种核苷酸衍生物,可用于生产调味品、香精等食品添加剂,还具有保健的功效[8]。葡萄糖脱氢酶是合成D-核糖的限速酶,其活力与D-核糖的产量密切相关[9]。此外葡萄糖脱氢酶和果糖转移酶组成的系统能够有效降低葡萄糖的含量,从而大大提高低聚果糖的纯度[10]。肺炎克雷伯氏菌虽有一定致病性,但能高产3-羟基丙酸、1,3-丙二醇、2,3-丁二醇等高值化合物,是有潜力的工业微生物[11];肺炎克雷伯氏菌能利用甘油、葡萄糖等多种碳源快速生长,较大肠杆菌而言,其生长更旺盛,碳源代谢能力更强。研究其葡萄糖脱氢酶有望获得生长迅速的工程菌。
本研究以大肠杆菌E.coli BL21为宿主,以pET-28a为载体,由IPTG诱导T7启动子来表达不同来源的GDH基因,测定催化活性及生长速度,旨在探索超表达葡萄糖脱氢酶对菌体生长的促进作用,且研究了葡萄糖脱氢酶异源表达对其活性是否存在影响,为葡萄糖脱氢酶的开发及其在食品领域的应用奠定基础。
1 材料与方法
1.1 材料与仪器
大肠杆菌E.coli DH5α、肺炎克雷伯氏菌K.pneumoniae MGH78578//大肠杆菌E.coli BL 21、质粒pET-28a 由本实验室保存;限制性内切酶EcoRⅠ、SacⅠ和HindⅢ TaKaRa公司;T4 DNA连接酶 NEB公司;Taq DNA聚合酶、蛋白质分子质量标记、DNA分子量Marker、硫酸卡那霉素 北京全新拓达公司;质粒提取试剂盒、DNA产物回收试剂盒以及切胶回收试剂盒 北京博迈德生物公司。
JA1003B型电子天平 上海越平科学仪器有限公司;TGL-16B型高速离心机 上海安亭科学仪器厂;LRH70型培养箱 上海一恒科技有限公司;GT9612型PCR仪 BIOGENER;H2O3-PRO金属浴 金银杏生物科技有限公司;THZ-C型恒温振荡器 太仓市仪器设备厂;10011624型分光光度计 上海奥普勒仪器有限公司;FluorChemTM5500凝胶成像仪 安莱(美国);DYY-8C型电泳仪 北京市六一仪器厂;SCL-10A型高效液相色谱 岛津(日本);TY-80A/S型脱色摇床 江苏荣华仪器制造有限公司。
1.2 培养基的配制
LB液体培养基:蛋白胨10 g/L,酵母粉5 g/L,氯化钠10 g/L,pH7.0;LB固体培养基需加入琼脂15 g/L;M9发酵培养基:5×M9盐溶液 200 mL,1 mol/L MgSO4·7H2O 2 mL,20%葡萄糖20 mL,1 mol/L CaCl20.1 mL,添加去离子水至1000 mL;5×M9盐溶液(200 mL):Na2HPO4·12H2O 17.1 g,KH2PO43 g,NaCl 0.5 g,NH4Cl 1 g。
1.3 基因克隆与表达
1.3.1 葡萄糖脱氢酶基因的克隆 根据GenBank公布的肺炎克雷伯氏菌和大肠杆菌的gdh基因序列设计引物。分别在肺炎克雷伯氏菌gdh基因上下游引入EcoRⅠ和SacⅠ酶切位点,大肠杆菌gdh基因上下游分别引入EcoRⅠ和HindⅢ酶切位点。分别以肺炎克雷伯氏菌和大肠杆菌基因组DNA为模板扩增其各自的gdh基因。设计引物如表1所示。
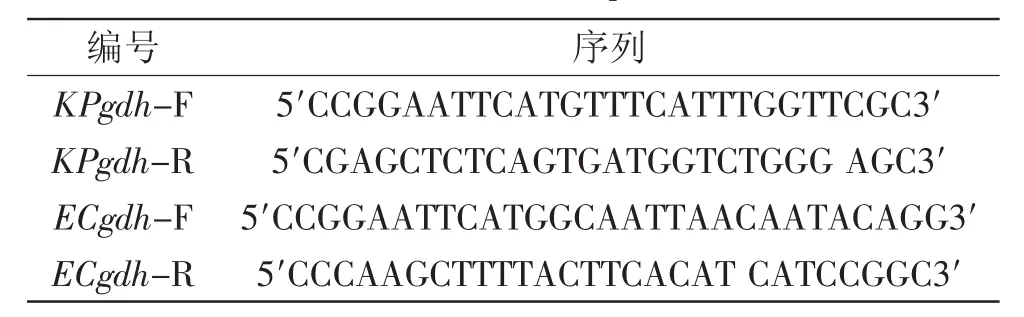
表1 引物序列Table 1 Primer sequences
1.3.2 表达载体的构建 PCR产物回收后酶切,与载体pET-28a连接,连接产物转化至E.coli DH5α,涂布含有硫酸卡那霉素的抗性平板,37℃静置培养18 h,挑取阳性克隆,进行菌落PCR及质粒双酶切鉴定。
1.3.3 重组质粒转化表达宿主 制备大肠杆菌E.coli BL 21感受态,分别将鉴定正确的两个重组质粒转化至E.coli BL21,得到重组菌BL21(pET28a-KPgdh)和BL21(pET28a-ECgdh)。
1.3.4 重组菌的表达 分别接种空白菌E.coli BL21(pET-28a)、重组菌BL21(pET28a-KPgdh)和BL21(pET28a-ECgdh)于M9发酵培养基,pET-28a质粒因采用T7启动子,需用IPTG诱导来表达葡萄糖脱氢酶。由于IPTG对菌体生长有一定影响,故本实验在37℃,200 r/min培养至OD600=0.6时,加入IPTG至终浓度1 mmol/L,37℃低温诱导6 h,收集菌体进行SDSPAGE分析,5%(质量分数)浓缩胶,10%分离胶。
1.4 分析方法
以未转化重组质粒的原代大肠杆菌E.coli BL21及携带空质粒的大肠杆菌E.coli BL21(pET-28a)作为空白对照,每隔3 h测一次菌体浓度和葡萄糖含量,生物量测定采用比浊法[12],葡萄糖含量测定采用3,5-二硝基水杨酸法[13]。取发酵液稀释至合适倍数,生长曲线和葡萄糖含量分别用分光光度计测定吸光度OD600和OD520。
1.5 酶活性的测定
本研究采用超声破碎细胞,取发酵液离心8000 r/min,收集菌体,在4℃条件下用pH7.4的PBS缓冲液重悬,超声破碎,破碎条件为100 W,工作3 s,间隔2 s,循环50次,12000 r/min离心5 min,取上清作为粗酶液。
酶活测定体系为2 mL,即200 μmol/L D-葡萄糖,4 μmol/L NAD,1.2 mmol/L Tris-HCl(pH8.0),20 nmol/L MnSO4,200 μL粗酶液。
酶活测定反应在37℃进行,通过检测340 nm处吸光度的增量来确定反应体系中NADH的生成量,酶单位定义:37℃下,每分钟催化生成1 μmol NADH的酶量即为一个酶活力单位。
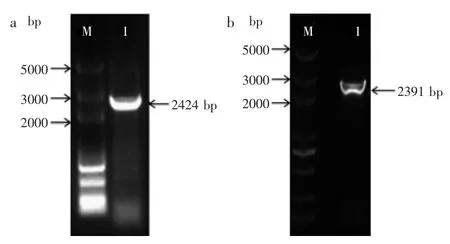
图1 K.pneumoniae和E.coli中gdh基因的PCR扩增Fig.1 PCR amplification of KPgdh and ECgdh genes from K.pneumoniae and E.coli
2 结果与讨论
2.1 gdh基因的克隆
2.1.1 gdh基因的克隆 分别以肺炎克雷伯氏菌和大肠杆菌基因组DNA为模板,PCR扩增葡萄糖脱氢酶基因gdh,结果如图1所示。
2.1.2 表达载体的构建及转化E.coli BL21 提取表达载体质粒并进行双酶切鉴定,结果如图2所示。酶切结果与理论预期相符,表明重组质粒构建成功。将重组质粒分别转化至大肠杆菌中,阳性克隆分别命名为BL21(pET-28a-KPgdh)和BL21(pET-28a-ECgdh),用于蛋白表达及发酵实验。
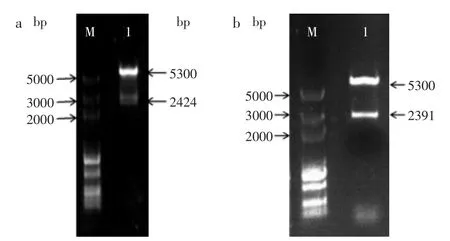
图2 pET-28a-gdh的双酶切鉴定Fig.2 Identification of pET-28a-gdh by restriction digestion
2.2 重组菌中葡萄糖脱氢酶基因的表达
将重组质粒分别转化E.coli BL 21,重组菌和对照菌摇瓶培养,进行总蛋白的SDS-PAGE分析。由图3可知,重组菌中的葡萄糖脱氢酶均高效表达,分子量大小约为87000 u,符合预期。
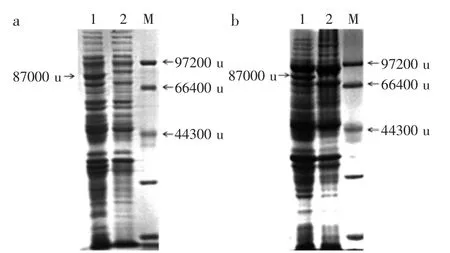
图3 两种重组大肠杆菌的蛋白电泳Fig.3 SDS-PAGE analysis of two recombinant E.coli strains
2.3 重组菌的发酵
用M9培养基发酵,以空质粒E.coli BL21(pET-28a)和原代菌E.coli BL21为对照组,以重组菌BL21(pET-28a-KPgdh)和BL21(pET-28a-ECgdh)为实验组,发酵24 h,每3 h用分光光度计测量其600 nm处的吸光值,绘制生长曲线,结果如图4。由图4可知,原代菌E.coli BL21在培养9~12 h后达到平稳期,而携带空质粒的对照菌E.coli BL21(pET-28a)因质粒负荷而生长滞后。无论重组菌BL21(pET-28a-KPgdh)还是BL21(pET-28a-ECgdh),其生物量均高于携带空质粒的对照菌E.coli BL21(pET-28a),而与原代菌基本持平。重组菌BL21(pET-28a-KPgdh)和BL21(pET-28a-ECgdh)携带的质粒大于空质粒,其中的葡萄糖脱氢酶过表达必然消耗转录和翻译资源,尽管如此,这两菌的生物量均高于空质粒重组菌,表明过表达葡萄糖脱氢酶促进了菌体生长。Zhu等在研究枯草芽孢杆菌的核黄素生成时,发现过表达葡萄糖脱氢酶能促进菌体生长,重组菌的生长速率和生物量均高于对照菌[14]。Duan等的报道也与本实验结果相符[15]。这些结果表明葡萄糖脱氢酶的表达与细胞生长有关。

图4 重组大肠杆菌的生长曲线Fig.4 Growth curve of two recombinant E.coli strains
2.4 葡萄糖剩余量的测定
用M9培养基发酵,以空质粒E.coli BL21(pET-28a)和原代菌E.coli BL21为对照组,以重组菌BL21(pET-28a-KPgdh)和BL21(pET-28a-ECgdh)为实验组,发酵24 h。由图5可知,无论重组菌BL21(pET-28a-KPgdh)还是BL21(pET-28a-ECgdh),其葡萄糖消耗均与原代菌E.coli BL21基本持平,而空质粒重组菌E.coli BL21(pET-28a)的葡萄糖消耗最慢。该结果表明重组菌BL21(pET-28a-ECgdh)和BL21(pET-28a-KPgdh)中葡萄糖脱氢酶超表达促进葡萄糖消耗,也从而促进了菌体生长。
葡萄糖脱氢酶参与磷酸戊糖途径,该途径是葡萄糖消耗的重要途径,结果表明构建的重组菌株在0~9 h的葡萄糖消耗速度大于空质粒菌株,且随着葡萄糖脱氢酶活性的提高,重组菌的生长速度也快于携带空质粒的菌株,基本与原代菌持平。如果扣除质粒复制和转录等造成的代谢负荷,葡萄糖脱氢酶超表达明显促进了菌体生长。
2.5 葡萄糖脱氢酶酶活性的测定
酶活测定反应体系为2 mL,在37℃进行酶催化反应,通过检测340 nm下的吸光度变化来确定反应体系中NADH的生成量,并用考马斯亮蓝R250标定其总蛋白含量,计算比活力。酶活定义为37℃下每分钟催化生成1 μmol NADH的酶量,酶活测定结果如图6所示。由图6可知,重组大肠杆菌BL21(pET-28a-KPgdh)和BL21(pET-28a-ECgdh)的葡萄糖脱氢酶活性分别是空质粒对照菌E.coli BL21(pET-28a)的8.5倍和12倍。换言之,KPgdh的活性低于ECgdh,推断与异源表达有关。由于大肠杆菌对密码子有偏好性,而肺炎克雷伯氏菌葡萄糖脱氢酶基因KPgdh(GenBank accession No.YP_001335612)与大肠杆菌葡萄糖脱氢酶基因ECgdh(GenBank accession No.YP_003052795)的序列同源性仅为53%,KPgdh作为外源基因在大肠杆菌中表达其酶活性会降低。葡萄糖脱氢酶活性也取决于底物、辅因子、能荷水平乃至信号等多种因素。
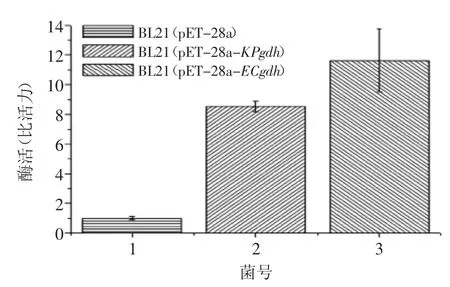
图6 葡萄糖脱氢酶活性Fig.6 Enzymatic activities of GDH
3 结论
本文为研究超表达不同来源葡萄糖脱氢酶对菌体生长的促进作用,分别以肺炎克雷伯氏菌和大肠杆菌基因组DNA为模板,PCR扩增了各自的葡萄糖脱氢酶基因KPgdh和ECgdh,与pET-28a载体连接后转化至大肠杆菌BL21,获得了重组菌BL21(pET-28a-KPgdh)和BL21(pET-28a-ECgdh)。经IPTG诱导,重组菌可实现gdh的高表达,且证实异源表达的葡萄糖脱氢酶活力明显降低。重组菌以葡萄糖作为碳源在迟缓期和对数生长期生长迅速,在此时期葡萄糖消耗速率与野生菌持平,生物量较空质粒对照菌有所提高。该研究具有双重意义:a.葡萄糖脱氢酶是糖代谢的关键酶,本研究发现重组菌中该酶的活性很高且菌体生长加快,因此为葡萄糖的高效利用及促进细菌生长提供了思路;b.葡萄糖脱氢酶在医药和食品工业有着重要作用,但目前价格昂贵,该研究为其发酵生产及在食品领域应用奠定了基础。
[1]Sakamoto K,Miyoshi H,Matsushita K,et al.Comparison of the structural features of ubiquinone reduction sites between glucose dehydrogenase in Escherichia coli and bovine heart mitochondrial complex I[J].Eur J Biochem,1996,237(1):128-135.
[2]Tsuya T,Ferri S,Fujikawa M,et al.Cloning and functional expression of glucose dehydrogenase complex of Burkholderia cepacia in Escherichia coli[J].J Biotechnol,2006,123(2):127-136.
[3]Navanietha Krishnaraj R,Chandran S,Pal P,et al.Molecular modeling and assessing the catalytic activity ofglucose dehydrogenase of Gluconobacter suboxydans with a new approach forpowergeneration in a microbialfuelcell[J].Current Bioinformatics,2014,9(3):327-330.
[4]Park HJ,Jung J,Choi H,et al.Enantioselective bioconversion using Escherichia coli cells expressing Saccharomyces cerevisiae reductase and Bacillus subtilis glucose dehydrogenase[J].J Microbiol Biotechnol,2010,20(9):1300-1306.
[5]Siddappaji MH,Scholes DR,Bohn M,et al.Overcompensation in response to herbivory in Arabidopsis thaliana:The role of glucose-6-phosphate dehydrogenase and the oxidative pentosephosphate pathway[J].Genetics,2013,195(2):589-598.
[6]Stover NA,Dixon TA,Cavalcanti AR.Multiple independent fusions of glucose-6-phosphate dehydrogenase with enzymes in the pentose phosphate pathway[J].PLoS One,2011,6(8):e22269.
[7]Sangeetha PT,Ramesh MN,Prapulla S G.Recent trends in the microbial production,analysis and application of Fructooligosaccharides[J].Trends in Food Science&Technology,2005,16(10):442-457.
[8]周珏,魏转,孙文敬,等.D-核糖的生产及应用[J].食品科技,2014,39(14):273-278.
[9]张锦芳,籍小涛,杜连祥,等.D-葡萄糖脱氢酶活力测定方法的研究-短小芽孢杆菌在D-核糖生产中的应用[J].天津轻工业学院学报,2001,38(3):37-40.
[10]唐江涛,覃益民,杨梅,等.利用重组葡萄糖脱氢酶提高低聚果糖纯度[J].食品研究与开发,2007,28(12):63-67.
[11]Ashok S,Raj S M,Rathnasingh C,et al.Development of recombinant Klebsiella pneumoniae△dhaT strain for the coproduction of 3-hydroxypropionic acid and 1,3-propanediol from glycerol[J].Applied microbiology and biotechnology,2011,90(4):1253-1265.
[12]Spiller E,Schöll A,Alexy R,et al.A microsystem for growth inhibition test of Enterococcus faecalis based on impedance measurement[J].Sensors and Actuators B:Chemical,2006,118(1):182-191.
[13]赵凯,许鹏举,谷广烨.3,5-二硝基水杨酸比色法测定还原糖含量的研究[J].食品科学,2008,29(8):534-536.
[14]Zhu YB,Chen X,Chen T,Shi S B,Zhao XM Over-expression of glucose dehydrogenase improves cell growth and riboflavin production in Bacilla subtilis[J].Biotechnol Lett,2006,28(20):1667-1672.
[15]Duan YX,Chen T,Chen X,et al.Overexpression of glucose-6-phosphate dehydrogenase enhances riboflavin production in Bacillus subtilis[J].Appl Microbiol Biotechnol,2010,85(6):1907-1914.
Overexpression glucose dehydrogenase can promote the growth of recombinant Escherichia coli
ZHENG Yue1,PEI Qing-hui2,GE Xi-zhen2,TIAN Ping-fang1,*
(1.College of Life Science and Technology,Beijing University of Chemical Technology,Beijing 100029,China;2.College of Biochemical Engineering,Beijing Union University,Beijing 100023,China)
The genes encoding glucose dehydrogenase(gdh)from Klebsiella pneumoniae and Escherichia coli were amplified by polymerase chain reaction(PCR).Subsequently,the corresponding expression vectors pET-28a-KPgdh and pET-28a-ECgdh were constructed and cloned into E.coli BL21,resulting in two recombinant strains E.coli(pET-28a-KPgdh)and E.coli(pET-28a-ECgdh).SDS-PAGE analysis showed the high level expression of both KPgdh and ECgdh upon IPTG induction.Compared with the control strain E.coli(pET-28a)which harbored an empty vector,the recombinant strains E.coli(pET-28a-KPgdh)and E.coli(pET-28a-ECgdh)consumed more glucose,and the gdh activity toward glucose increased by 8.5-and 12-fold,respectively.If plasmid burden was not counted,overall these results indicated that gdh overexpression facilitated cell growth.
Escherichia coli;Klebsiella pneumoniae;glucose dehydrogenase;overexpression;cell growth
TS201.3
A
1002-0306(2015)22-0189-05
10.13386/j.issn1002-0306.2015.22.031
2015-02-02
郑跃(1989-),女,硕士,研究方向:微生物与分子生物学,E-mail:yueyue_0307@126.com。
*通讯作者:田平芳(1965-),男,博士,教授,研究方向:合成生物学,E-mail:tianpf@mail.buct.edu.cn。
国家自然科学基金(21076013,21276014)。

