银杏叶多糖分离纯化、结构鉴定及抗氧化活性研究
何 钢,刘 嵬,李会萍,梁 立,郭晓强,颜 军,苟小军
(成都大学药食同源植物资源开发高校重点实验室,四川成都610106)
银杏叶多糖分离纯化、结构鉴定及抗氧化活性研究
何 钢,刘 嵬,李会萍,梁 立,郭晓强,颜 军,苟小军*
(成都大学药食同源植物资源开发高校重点实验室,四川成都610106)
目的:分离纯化银杏叶多糖(GBLP)并对其结构进行表征及抗氧化活性研究。方法:超声辅助提取制备银杏叶粗多糖,经精制除杂和阴离子交换柱分离获得多糖级分,采用高效凝胶过滤色谱(HPGFC)、气相色谱法(GC)分析相对分子质量和单糖组成;采用体外抗氧化方法评价银杏叶多糖抗氧化活性。结果:GBLP经分离后获得三个级分GBLPⅠ、GBLPⅡ、GBLPⅢ,其相对分子质量(Mw)分别为41861、361352、637533。GBLPⅠ由鼠李糖、阿拉伯糖、甘露糖、葡萄糖、半乳糖组成;GBLPⅡ和GBLPⅢ由鼠李糖、阿拉伯糖、甘露糖、半乳糖组成,但其摩尔比不同。体外抗氧化实验表明GBLPⅢ对羟自由基的清除能力最强,其次为GBLPⅡ、GBLPⅠ、GBLP;而GBLPⅡ和GBLPⅢ对超氧阴离子清除能力相对较好,其次为GBLPⅠ、GBLP。结论:银杏叶多糖各级分的单糖组成比例、相对分子质量有差异;对羟自由基的清除作用强于对超氧阴离子的清除作用,对羟自由基的清除作用差异可能与Mw及结构相关。
银杏叶多糖,分离纯化,相对分子质量,单糖组成,抗氧化
银杏(Ginkgo biloba)是裸子植物门、银杏科、银杏属单种植物,有近2亿年的历史,被称为“活化石”。银杏种子和叶具有重要的药用价值。银杏种子含有抗氧化活性和保护DNA受损伤的蛋白质[1]。银杏叶提取物具有活血、止咳、扩张冠状动脉血管、降低血胆固醇、抗抑郁等多种功效,其相关药品已经用于临床治疗。银杏叶主要化学成分有萜类、多酚类、烷基酚、黄酮及黄酮甙类、萜内酯类、多糖类化合物[2-6]。多糖是由多个单糖或单糖衍生物聚合而成的大分子化合物,具有诸多药理活性,银杏外种皮多糖的单糖组成、相对分子质量、结构特点以及抗氧化和抗肿瘤活性已有文献报道[7-9],为其开发利用打下基础。近年来的研究表明银杏叶多糖也具有潜在的药用价值和医药开发价值。研究表明银杏叶多糖具有调节免疫、抗肿瘤、抗氧化、抗炎症、抗衰老等多种功效[10-13]。而对银杏叶多糖的结构研究还不够深入,多糖一级结构特征、空间结构和构效关系研究较少。目前对银杏叶多糖的种类、单糖组成和相对分子质量已有报道,但是各实验室的研究结果存在一定的差异,因此对银杏叶多糖深入研究具有重要的意义。在前人的研究基础上以秋季采收的银杏叶为材料制备银杏叶多糖,并对其进行分离纯化,检测其单糖组成、相对分子质量和体外抗氧化活性,为银杏叶多糖的结构研究和资源利用做铺垫。
1 材料与方法
1.1 材料与仪器
银杏叶 9月中旬采自成都大学校园;鼠李糖、果糖、阿拉伯糖、木糖、甘露糖、葡萄糖、半乳糖、维生素C、浓硫酸、苯酚、氢氧化钠、氯化钠、Tris碱、水杨酸、硫酸亚铁、邻苯三酚、正丁醇、三氯甲烷、三氟乙酸、盐酸羟胺、吡啶、甲醇、乙酸酐、浓盐酸、无水乙醇、过氧化氢 分析纯,成都科龙化学试剂公司;标准葡聚糖(T-10、T-40、T-70、T-500、T-2000) 购自Solarbio公司。
UP-500纯水仪 成都优普科学仪器公司;DL-6M高速冷冻离心机 湖南湘仪仪器公司;CT15RT台式高速冷冻离心机 上海天美仪器公司;UV-2802紫外可见分光光度计 上海尤尼柯仪器公司;KQ-400KDE型超声波清洗器 昆山市超声仪器公司;冻干机 美国Labconco仪器公司;AKTA prime plus蛋白质层析系统 美国通用仪器公司;RE-2000、RE-5210A旋转蒸发器 上海亚荣仪器公司;GC-2010气相色谱仪 日本岛津仪器公司。
1.2 实验方法
1.2.1 银杏叶多糖的制备
1.2.1.1 银杏叶粗多糖的制备 银杏叶经60℃烘干后粉碎,银杏叶粉用石油醚(沸程60~90℃)蒸馏回流2次,每次2.5 h。滤渣置于托盘中挥走石油醚后备用,称取1 kg脱脂处理的银杏叶粉参照文献[7,10]方法,采用温度80℃,料液比1∶50,超声提取时间10 min,超声功率400 W,提取三次合并提取液,提取液经6000 r/min离心15 min,90℃条件下旋转蒸发仪减压浓缩至4 L,加入4倍体积的无水乙醇过夜沉淀多糖,多糖沉淀10000 r/min离心10 min获得粗多糖。采用硫酸-苯酚法[14]测定银杏叶粗多糖提取液中多糖含量,多糖提取得率(%)=(溶液中多糖浓度×提取液总体积)/银杏叶总质量×100。
1.2.1.2 银杏叶多糖的精制 取适量银杏叶粗多糖加蒸馏水复溶,采用Sevag试剂法[9]清除多糖溶液中的蛋白质和核酸等杂质,采用UV光谱仪分析精制多糖溶液,波长扫描范围200~600 nm,除杂多糖溶液在254 nm和280 nm检测无吸收峰为止。除杂多糖溶液按5∶1(mL/g)同D101大孔树脂混合,搅拌均匀,静态吸附色素4~5 h后,多糖溶液连同柱料一起装柱,收集流出液即为脱色多糖溶液。多糖溶液再经透析(透析袋截留分子量8000~14000)去除小分子化合物,袋内溶液经真空冷冻干燥后得到精制多糖。
1.2.2 银杏叶精制多糖的分离纯化 称取0.5 g精制银杏叶多糖(GBLP),加入10 mL蒸馏水充分溶解后10000 r/min离心10 min,上清液用阴离子交换柱DEAE-Sepharose Fast Flow进行分离,以1 mL/min流速进行洗脱。先用蒸馏水洗脱100 mL,然后用0~1.0 mol/L NaCl溶液线性梯度洗脱150 mL,最后再用1.0 mol/L NaCl溶液洗脱50 mL。每支试管收集3 mL。收集液用硫酸-苯酚法测定A490nm值[14],以试管编号为横坐标,A490nm值为纵坐标绘制洗脱曲线。
1.2.3 银杏叶多糖级分相对分子质量测定 银杏叶多糖级分相对分子质量的测定采用高效凝胶过滤色谱法[15](HPGFC)。色谱条件:色谱柱型号YMC Pack-Diol 200(300 mm×8.0 mm,5 μm,200 Å),流动相为超纯水,流速0.8 mL/min,柱温35℃,检测器为示差折光检测器(RI),进样量20 μL。
1.2.3.1 标准曲线的制作 以葡萄糖(Glc)及标准葡聚糖T-10、T-40、T-70、T-500、T-2000为标准品,分别用超纯水溶解配制成2 mg/mL溶液进样,记录洗脱峰的保留时间。葡萄糖标液进样测得Vt,T-2000标液测得外水体积V0。分别用T-500、T-70、T-40、T-10的标准溶液相继进样,分别求得它们的洗脱体积Ve。相对分子质量Mw与其在凝胶柱上的洗脱体积Ve、分配系数Kav存在如下关系:
Ve=a-blnMw
Kav=K1-K2lnMw
Kav=(Ve-V0)/(Vt-V0)
式中:a、b、K1、K2为常数。
以Kav对lnMw进行线性回归处理,得线性回归方程。
1.2.3.2 样品相对分子质量的测定 分别取银杏叶多糖各级分配制成2 mg/mL的溶液,按上述条件进行色谱分析,记录样品保留时间。由样品保留时间计算该银杏叶多糖级分在凝胶柱上的洗脱体积Ve,从而获得分配系数Kav,制作的回归方程即可得该银杏叶多糖级分的相对分子质量Mw。
1.2.4 红外光谱分析 银杏叶多糖各级分经冻干后分别用KBr研磨均匀,压片后进行红外光谱分析,扫描范围为400~4000 cm-1。
1.2.5 糖腈衍生化分析银杏叶各级分单糖组成
1.2.5.1 气相色谱条件 色谱柱:FFAP毛细管柱,长为30 m,膜厚为0.25 μm,内径为0.25 mm。载气:氮气,控制方式:线速度,压力:144.4 kPa,总流量:6.9 mL/min,柱流量:1.29 mL/min,线速度:36.7 cm/s,吹扫流量:3.0 mL/min,分流比:2∶1。程序升温:初始柱温170℃,保持2 min;然后以4℃·min-1的升温速率升至187℃;再以0.5℃·min-1的升温速率升至188℃,保持1 min;以1℃·min-1的升温速率升到196℃,保持2 min;以4℃·min-1的升温速率升到208℃,保持1 min;以0.5℃·min-1的升温速率升至209℃,保持3 min。
1.2.5.2 混合单糖溶液配制 精确称取内标化合物山梨醇10.0 mg于25 mL容量瓶中用无水吡啶溶解并定容至刻度。精确称取单糖标准品(果糖、阿拉伯糖、鼠李糖、木糖、甘露糖、葡萄糖、半乳糖)各100.0 mg于25 mL容量瓶中,用无水吡啶溶解并定容至刻度。并用无水吡啶对混合单糖溶液进行2倍稀释。
1.2.5.3 银杏叶多糖的水解样品制备 准确称取多糖样品10.0 mg于安培瓶中,加入2 mol/L三氟乙酸(TFA)2 mL,充N2封管,于110℃烘箱中水解6 h,水解液10000 r/min离心5 min,取上清液于西林瓶中,加适量甲醇,蒸干备用,待衍生化时用1 mL无水吡啶复溶。
1.2.5.4 糖腈衍生化 分别取上述梯度稀释的混合单糖溶液和多糖水解溶液1 mL于具塞试管中,再分别准确加入1 mL内标溶液和1 mL盐酸羟胺溶液(15 mg/mL),混匀后封管,在80℃水浴中反应30 min;反应后冷却至室温,分别加入0.8 mL乙酸酐溶液,封管后于70℃水浴中乙酰化反应30 min,反应结束后将反应溶液移入西林瓶中,水浴锅蒸干后用1 mL氯仿溶解,然后进行气相色谱分析。
1.2.6 银杏叶多糖抗氧化活性的测定
1.2.6.1 清除羟基自由基(·OH-)的活性测定 向试管中加入一系列不同浓度多糖溶液1.0 mL,FeSO4溶液(1.8 mmol/mL)2.0 mL,水杨酸-乙醇(1.8 mmol/mL)1.5 mL,最后加浓度为0.3%的H2O2溶液0.1 mL启动反应,振荡混合,37℃水浴保温30 min,在波长510 nm下测量各自的吸光度值。以1.0 mL蒸馏水代替多糖溶液,其余操作同上作为空白,VC作阳性对照[16]。
羟基自由基清除率计算公式为:
清除率(%)=[(A0-AS)/A0]×100
式中,A0为空白管的吸光度,AS为样品的吸光度。IC50值的计算,以多糖溶液浓度为横坐标,清除率为纵坐标作图并进行回归分析,清除率为50%时所对应的多糖浓度即为IC50值。
1.2.6.2 对超氧阴离子(·O2-)的清除作用 0.1 mL不同浓度的多糖溶液,加入5 mL 0.05 mol/L Tris-HCl缓冲溶液(pH8.2),25℃水浴10 min,加入0.2 mL 6 mmol/L的邻苯三酚溶液,摇匀后每隔30 s在325 nm处测定吸光度值,4 min内测量完成。以0.1 mL水代替多糖溶液,0.2 mL水代替邻苯三酚作参比液,0.1 mL水代替多糖溶液作对照溶液,其余同上述方法操作,VC作阳性对照[16]。
清除率(%)=(1-样品斜率/对照斜率)×100
式中,斜率指以间隔时间为横坐标,相应吸光度值为纵坐标进行线性回归分析,所得回归方程的斜率。IC50值的计算,以多糖溶液浓度为横坐标,清除率为纵坐标作图并进行回归分析,清除率为50%时所对应的多糖浓度即为IC50值。
1.3 数据处理及分析
各组数据以X±SD表示,数据处理采用Excel软件分析。
2 实验结果
2.1 银杏叶多糖的精制
银杏叶多糖提取液经硫酸苯酚法测得A490nm值代入葡萄糖标准曲线y=2.6771x-0.0136,R2=0.9981,计算银杏叶粗多糖提取得率为6.87%。多糖溶液经Saveg试剂除杂处理和大孔树脂脱色处理后的紫外光谱分析如图1,由图1可知254 nm和280 nm处无吸收峰,表明多糖中蛋白质和核酸等杂质已去除,多糖得到精制。

图1 精制银杏叶多糖溶液紫外光谱图Fig.1 UV spectrum of purifed G.biloba leaf polysaccharides
2.2 精制银杏叶多糖的分离纯化
精制的GBLP经DEAE-Sepharose Fast Flow柱分离结果如图2,由图2可知GBLP经分离后获得三个级分,分别命名为GBLPⅠ、GBLPⅡ、GBLPⅢ。
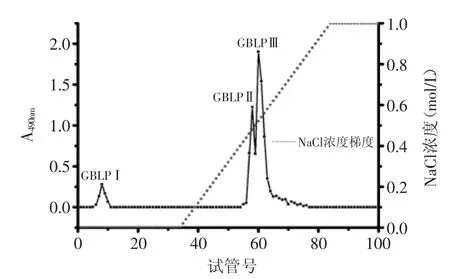
图2 GBLP的洗脱曲线Fig.2 GBLP elution curves
2.3 银杏叶多糖相对分子质量
系列标准葡聚糖T-10、T-40、T-70、T-500、T-2000的保留时间见表1,以分配系数Kav为横坐标,相对分子质量的对数为纵坐标作图,并通过回归处理得线性回归方程为y=-9.1239x+14.254,R2=0.9969(图3)。
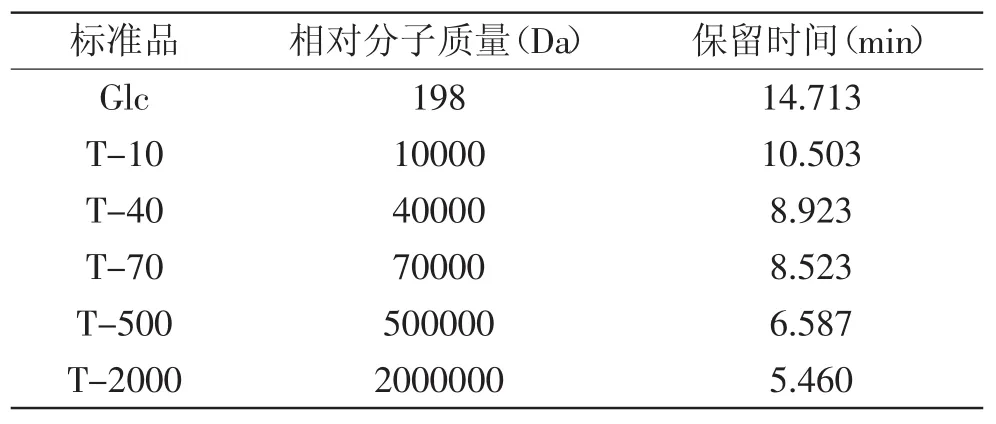
表1 标准样品的HPGFC保留时间Table 1 HPGFC retention time of standard sample
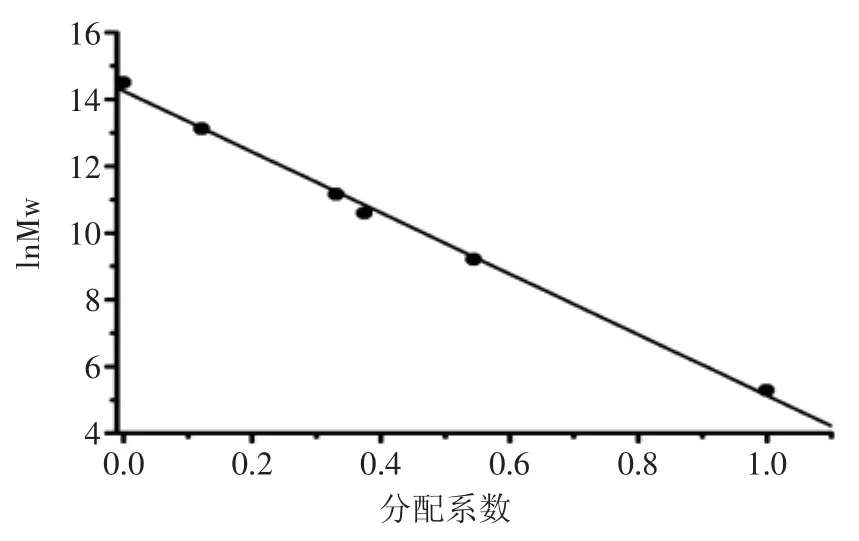
图3 相对分子质量标准曲线Fig.3 Relative molecular mass standard curve
利用高效凝胶过滤色谱法(HPGFC)将银杏叶多糖分离后的各级分样品在相同色谱条件下进样分析,并记录GBLPⅠ、GBLPⅡ、GBLPⅢ色谱峰的保留时间,通过线性回归方程,计算GBLPⅠ、GBLPⅡ、GBLPⅢ的相对分子质量(Mw)分别为41861、361352、637533。
2.4 银杏叶多糖级分红外光谱分析
各多糖级分红外光谱检测结果如图4所示。在3409 cm-1附近出现一个宽峰,是多糖特征的O-H的伸缩振动峰,表明多糖存在分子内和分子间的氢键;2915 cm-1附近弱吸收峰为饱和的C-H伸缩振动峰;1623 cm-1附近的吸收峰为C=O伸缩振动峰,1424、1384 cm-1附近的吸收峰为=CH2的变形吸收峰。在(950~700 cm-1)864 cm-1处具有吸收峰,表明银杏叶多糖含有甘露糖。由红外图谱可知GBLPⅠ、GBLPⅡ、GBLPⅢ具有明显的糖类化合物的特征。
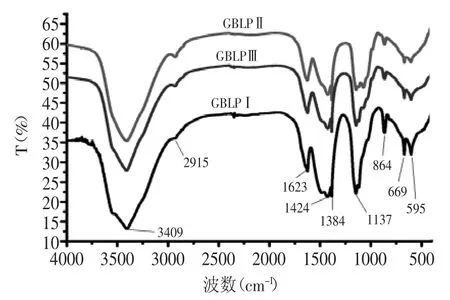
图4 银杏叶多糖红外光谱图Fig.4 IR spectrum of Ginkgo biloba leaf polysaccharides
2.5 银杏叶多糖的单糖组成分析
2.5.1 混合单糖糖腈衍生化产物法标准曲线 混合单糖标准品溶液和银杏叶精制多糖水解产物进行糖腈衍生化后经GC分析,以峰面积为纵坐标,每种单糖进样前浓度与校正因子的积为横坐标进行线性回归,计算回归方程、相关系数。由图5可以看出各单糖及内标化合物在该色谱条件下分离度好,由表2结果可知各单糖线性关系良好。

图5 混合单糖气相色谱图Fig.5 Gas chromatography of mixture of standard monosaccharides
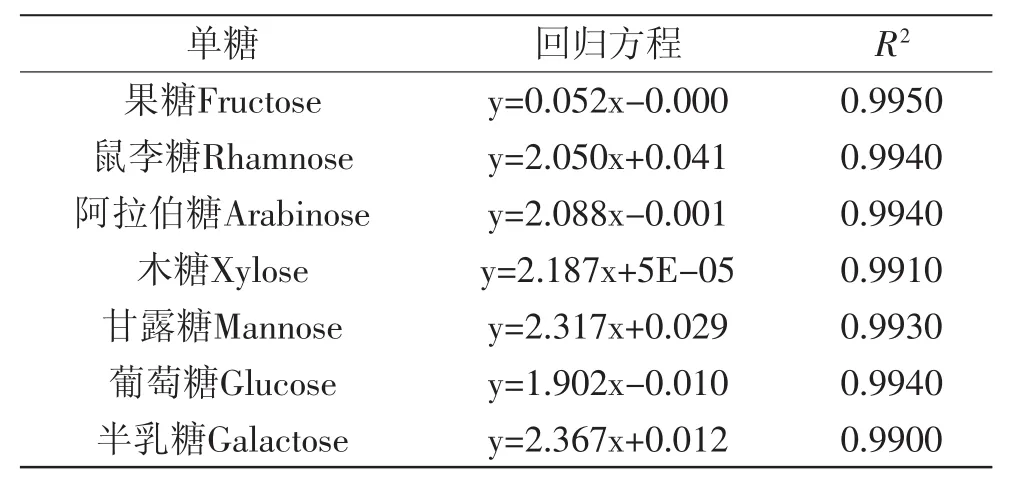
表2 单糖标准品衍生物的标准曲线Table 2 Standard curve of standard monosaccharides derivatization
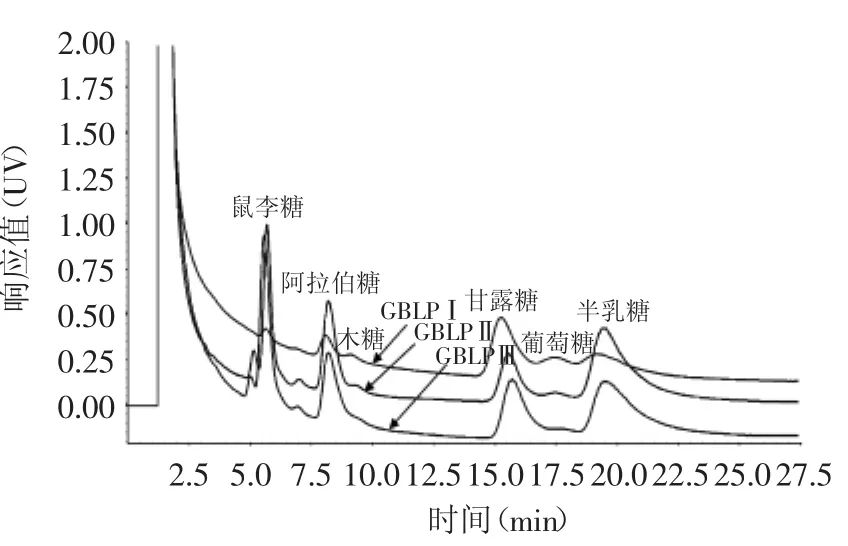
图6 银杏叶多糖各级分的气相色谱图Fig.6 Gas chromatography of Ginkgo biloba leaf polysaccharide components
2.5.2 银杏叶多糖各分离级分的单糖组成 银杏叶多糖分离后的三个级分GBLPⅠ、GBLPⅡ、GBLPⅢ分别经水解,糖腈衍生化后进行GC分析并记录各单糖峰面积,结果如图6。GBLPⅠ由鼠李糖、阿拉伯糖、甘露糖、葡萄糖、半乳糖组成,其摩尔比为:1∶3.5∶18.2∶7.4∶7.5;GBLPⅡ由鼠李糖、阿拉伯糖、甘露糖、半乳糖组成,其摩尔比为:1.5∶1.6∶1∶2.2;GBLPⅢ由鼠李糖、阿拉伯糖、甘露糖、半乳糖组成,其摩尔比为:1.6∶1∶1.1∶1.7。
2.6 银杏叶多糖活性的测定
2.6.1 对羟基自由基的清除作用 银杏叶精制多糖(GBLP)及GBLPⅠ、GBLPⅡ、GBLPⅢ对羟自由基的清除作用结果如图7所示。由图7可知,当VC浓度达0.5 mg/mL时其对羟基自由基清除率达93.28%,清除作用强于银杏叶多糖。银杏叶多糖级分浓度增加清除率增大,GBLPⅢ清除作用强于GBLPⅡ、GBLPⅠ、GBLP,对羟自由基清除率的IC50值分别为0.96、2.10、3.23、3.67 mg/mL。同时也表明银杏叶多糖分离后的各级分对羟基自由基清除活性高于分离前的混合多糖。
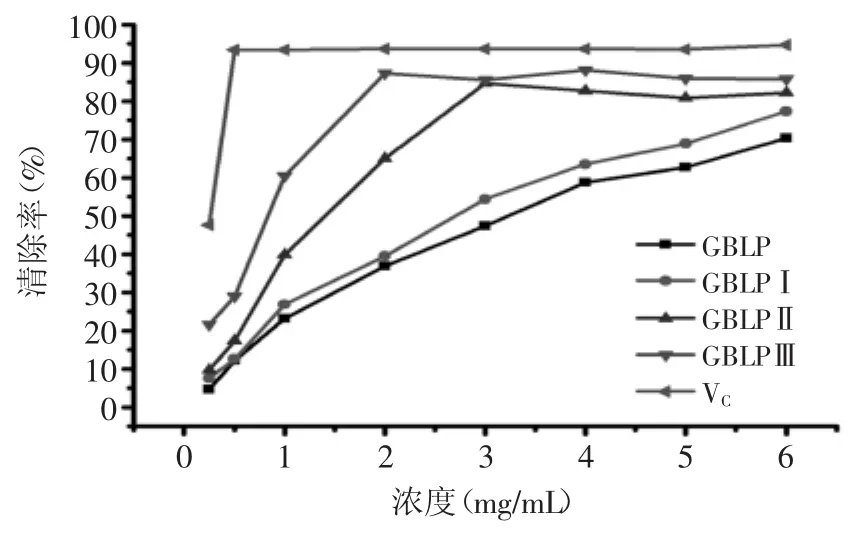
图7 银杏叶多糖对·OH的清除率Fig.7 Hydroxyl radical scavenging activity of GBLP
2.6.2 对超氧阴离子的清除作用 银杏叶精制多糖(GBLP)及GBLPⅠ、GBLPⅡ、GBLPⅢ对超氧阴离子的清除作用结果如图8所示。同阳性对照VC相比较,银杏叶多糖对超氧阴离子的清除作用较差,当样品浓度为6 mg/mL时VC对超氧阴离子的清除率达99.70%,而GBLP为6.96%,GBLPⅠ为7.42%,GBLPⅡ为9.39%,GBLPⅢ为9.00%。在浓度为0.5~6 mg/mL范围内GBLPⅡ和GBLPⅢ对超氧阴离子的清除活性较GBLPⅠ和GBLP高。
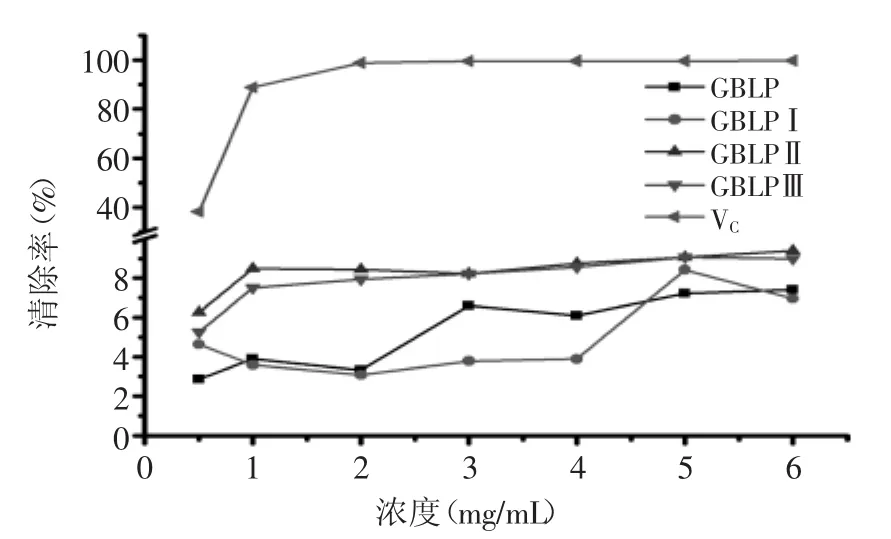
图8 银杏叶多糖对超氧阴离子的清除率Fig.8 Superoxide anion radical scavenging activity of GBLP
3 结论
银杏叶粗多糖经阴离子交换柱分离纯化获得三个级分GBLPⅠ、GBLPⅡ、GBLPⅢ,通过高效凝胶色谱法分析其相对分子质量(Mw)分别为41861、361352、 637533。单糖组成分析和红外光谱数据表明GBLPⅠ可能是以甘露糖为主链组成的杂多糖,而GBLPⅡ和GBLPⅢ可能是以半乳糖为主链组成的杂多糖。单糖组成的研究结果同靳菊情[17]、Josefkraus[18]、杨静峰等[19]报道较一致,而相对分子质量结果有一定差别,可能与测定的方法有关。同VC相比较,银杏叶多糖对羟基自由基和超氧阴离子的清除作用较弱,但是GBLPⅢ对羟基自由基的清除作用强于GBLPⅡ、GBLPⅠ以及GBLP,表明分离后银杏叶多糖级分对羟基自由基清除活性提高。而银杏叶多糖对超氧阴离子的清除作用较弱,GBLPⅡ和GBLPⅢ对超氧阴离子的清除作用强于GBLPⅠ和GBLP。研究结果也表明在一定的浓度范围内银杏叶多糖对羟基自由基和超氧阴离子的清除作用具有明显的剂量效应。银杏叶多糖各级分之间的单糖组成比例、相对分子质量存在明显差异,同时对羟自由基的清除作用也存在差异,这可能与Mw及结构相关。
[1]Wen H,QianC D,BiJ X,et al.Purification and characterization of an antioxidant protein from Ginkgo biloba seeds[J].Food Research International,2010(43):86-94.
[2]Bikram S,Pushpinder K,Gopichand R D,et al.Biology and chemistry of Ginkgo biloba[J].Fitoterapia,2008(79):401-418.
[3]Patricia R,Norma SG,Omar N MC,et al.Antidepressant-like effect of a Ginkgo biloba extract(EGb761)in the mouse forced swimming test:Role ofoxidative stress[J].Neurochemistry International,2011(59):628-636.
[4]Satyan S K,A PS,Fabio C C,et al.Antidepressant and Antistress Activity of GC-MS characterized Lipophilic Extracts of Ginkgo biloba Leaves[J].Phytother Research,2007(21):1061-1065.
[5]Teris A B,Paola M.Chemical analysis and quality control of Ginkgo biloba leaves,extracts,and phytopharmaceuticals[J]. Journal of Chromatography A,2009(1216):2002-2032.
[6]ChenH Y,Jing C,YaoK X,et al.Optimization of multistage countercurrent extraction of antioxidants from Ginkgo biloba L.Leaves[J].Food and Bioproducts Processing,2012(90):95-101.
[7]Jing J C,Tao Z,Bo J,et al.Characterization and antioxidant activity of Ginkgo biloba exocarp polysaccharides[J].Carbohydrate Polymers,2012(87):40-45.
[8]Ai H X,Hua S C,Bu C S,et al.Therapeutic mechanism of ginkgo biloba exocarp polysaccharides on gastric cancer[J]. World J Gastroenterol,2003,9(11):2424-2427.
[9]XiangY W,Guang H M,Ting Z,et al.Isolation,purification and in vitro anti-tumor activity of polysaccharide from Ginkgo biloba sarcotesta[J].Carbohydrate Polymers,2011(86):1073-1076.
[10]FeiY,Rong M Y,Yin Y,et al.Structure characterization and antioxidant activity of a novel polysaccharide isolated from Ginkgo biloba[J].International Journal of Biological Macromolecules,2010(46):436-439.
[11]Bo J,Hong Y Z,Chang J L,et al.Extraction of water-soluble polysaccharide and the antioxidant activity from Ginkgo biloba leaves[J].Medicinal Chemistry Research,2010(19):262-270.
[12]陈群,刘天骄.银杏叶多糖的抗肿瘤和免疫调节作用[J].中药药理与临床,2003,19(5):18-19.
[13]刘春明.银杏叶多糖抗炎症作用的研究[D].长春:东北师范大学,2007.
[14]徐光域,颜军,郭晓强,等.硫酸-苯酚定糖法的改进与初步应用[J].食品科学,2005,26(8):342-346.
[15]郭晓强,颜军,何钢,等.硫酸酯化川芎多糖的制备及其抗氧化活性研究[J].天然产物研究与开发,2013,25(7):955-959.
[16]郭晓强,何钢,倩姚,等.普通念珠藻中多糖的分离纯化研究[J].现代药物与临床,2013(3):328-330.
[17]靳菊情,丁东宁,边小丽,等.银杏叶多糖的化学及清除羟自由基作用[J].西安医科大学学报,2000,21(5):417-419.
[18]Josefkraus.Water-soluble polysaccharides from Ginkgo biloba leaves[J].Phytochemistry,1991,30(9):3017-3020.
[19]杨静峰,张旭,梁忠岩,等.银杏叶水溶性多糖的分离、纯化、初步鉴定及活性研究[J].特产研究,2006,28(4):51-53.
Isolation and purification,structure identification and antioxidant activity of polysaccharides of Ginkgo biloba leaf
HE Gang,LIU wei,LI Hui-ping,LANG Li,GUO Xiao-qiang,YAN Jun,GOU Xiao-jun*
(Key Laboratory of Medicinal and Edible Plants Resources Development of Sichuan Education Department,Chengdu University,Chengdu 610106,China)
Objective:Isolation and purified the polysaccharide from Ginkgo biloba leaf and investigated its structure characterization,antioxidant activity.Method:Extract polysaccharide from G.biloba leaf by ultrasonic assisted,crud polysaccharide was refined and then was isolated by anion exchange column,the relative molecular weight was measured by gel column chromatography,the monosaccharide composition was analyzed by GC,by adopting the method of in vitro antioxidant evaluation of G.biloba leaf polysaccharide antioxidant activity. Result:G.biloba leaf polysaccharide was purified and got three ingredients named GBLPⅠ,GBLPⅡand GBLPⅢ.The relative molecular weight(Mw)was 41861,361352,637533 respectively.GBLPⅠwas consisted of rhamnose,arabia,mannose,glucose,galactose composition.GBLPⅡ and GBLPⅢ were consisted of rhamnose,arabia,mannose,galactose composition,but and the molar ratio was different.The result of antioxidant experiment in vitro showed that the ability of GBLPⅢ scavenging on hydroxyl free radical was strongest,followed by GBLPⅡ,GBLPⅠ,GBLP.While the ability of GBLPⅡand GBLPⅢscavenging on superoxide anion was relatively good,followed by GBLP,GBLPⅠ.Conclusion:The monosaccharide composition and relative molecular mass of the fractions isolated from G.biloba leaf crude polysaccharide was difference.The ability of G.biloba leaf polysaccharide on hydroxyl free radical scavenging was stronger than the scavenging on superoxide anion,the hydroxyl free radical scavenging effect difference might be associated with Mw and structure.
Ginkgo biloba leaf polysaccharide;isolation and purification;relative molecular mass;monosaccharide composition;antioxidant
TS201.2
A
1002-0306(2015)22-0081-06
10.13386/j.issn1002-0306.2015.22.008
2015-03-17
何钢(1982-),男,博士,讲师,研究方向:糖生物化学,E-mail:hegang@cdu.edu.cn。
*通讯作者:苟小军(1974-),男,博士,教授,研究方向:糖生物化学,E-mail:jmee@cdu.edu.cn。
四川省科技厅应用基础计划项目(2015JY0117);四川省教育厅项目(14ZB0374);四川省中医药管理局项目(2014G001)。

