SPE-UPLC法测定豆芽中6-苄基腺嘌呤含量及其残留动态
刘雨思,王 波,闫 衡,刘倩倩,王彦淳,周 围,*
(1.甘肃农业大学食品科学与工程学院,甘肃兰州730070;2.甘肃出入境检验检疫局综合技术中心,甘肃兰州730020)
SPE-UPLC法测定豆芽中6-苄基腺嘌呤含量及其残留动态
刘雨思1,王 波2,闫 衡1,刘倩倩2,王彦淳1,周 围2,*
(1.甘肃农业大学食品科学与工程学院,甘肃兰州730070;2.甘肃出入境检验检疫局综合技术中心,甘肃兰州730020)
采用固相萃取超高效液相色谱法,建立豆芽中生长激素6-苄基腺嘌呤(6-BA)残留量的检测方法,并对不同贮存条件及贮存时间下豆芽中6-BA含量的变化进行动态研究。选用DIONEX Acclaim C16(4.6 mm×150 mm,3 μm)色谱柱,流动相采用甲醇、乙酸铵水溶液,流速为1 mL·min-1,检测波长为265 nm。结果表明,该方法回收率为87.4%~90.0%,相对标准偏差为0.46%~0.60%,方法检出限为0.01 mg·kg-1,6-BA的线性范围为0.05~50 mg·kg-1。该方法简单、快速,可实现对植物生长激素6-BA的准确定量。动态研究结果表明,豆芽中6-BA的含量会随时间的增加而降低,冻藏和冷藏方式下,最小半衰期分别为1.642 d和3.108 d。
超高效液相色谱,6-BA,豆芽,残留动态
豆芽因其富含蛋白质、碳水化合物、脂肪、钙、维生素且口感极佳,为广大消费者所喜爱,市场需求量极大[1]。6-苄基腺嘌呤(6-henzylaminopurine,6-BA)是一种人工合成的植物生长激素[2],具有促进植物生长发育的作用[3],能够明显提高果品及叶片的品质[4],因此被广泛应用于蔬菜生产中。但是,6-BA作为一种生长激素,具有一定毒性,人体过多摄入会刺激皮肤、黏膜,造成食道、胃黏膜损伤,出现恶心、呕吐等现象[5-6]。
目前,豆芽因没有相关的国家检测标准,所以关于6-BA在豆芽生产中的使用存在争议。此前,6-BA被认为是非法添加物,不得在食品生产加工添加使用[7]。但是,对6-BA的进一步研究结果表明,低剂量6-BA的摄入对人体不会造成任何危害[8]。故而2014年11月6日,《食品安全国家标准-豆芽》(草稿)明确将6-BA定性为植物生长调节剂,允许其在豆芽生产中使用,限定含量为不得超过0.2 mg·kg-1[9-14]。然而,对6-BA的检测存在众多难点。由于6-BA在植物中会发生降解现象,残留的6-BA含量较少,且豆芽中含有大量杂质干扰目标物[15],使检测及准确定量其残留量增加了难度,极易造成误判甚至错判,为豆芽带来安全隐患,而目前相关的研究较少。目前,检测6-BA含量的方法主要有HPLC法[16-18]、GC/MS法[19-20]和液质联用法[21-26],但因其灵敏度低、准确度差、分析时间长,难以满足大批量的检测要求。
本实验选用Waters Oasis HLB小柱进行固相萃取[27-28],对6-BA进行富集净化,采用UPLC法对6-BA在豆芽中的降解情况进行研究,并通过LC-MS进行定性分析。为6-BA的检测提供了一种快速有效的方法,并为相关机构制定豆芽中6-BA残留限量标准提供了参考依据。
1 材料与方法
1.1 材料与仪器
6-苄基腺嘌呤 纯度98%,购自美国Dr. Ehrenstorfer公司;乙酸铵 色谱纯,购自德国CNW Technologies公司;甲醇 色谱纯,购自德国Mreck公司;蒸馏水 购自中国广州屈臣氏食品饮料有限公司;所用的豆芽空白样品 绿豆芽,扁豆芽,黄豆芽,均来自实验室自发豆芽;检测豆芽 购买于兰州各地蔬菜市场及大型超市。
ACQUITY UPLC超高效液相色谱仪 美国Waters公司;超高效液相色谱-质谱联用仪 美国安捷伦公司;Oasis HLB固相萃取柱 美国Waters公司;Sartorius BL610电子天平 北京赛多利斯仪器系统有限公司;3K30高速冷冻离心机 德国SIGMA公司;T25BASIC均质机 德国IKA公司;移液枪 美国Thermo Electron公司;50 mL聚乙烯管。
1.2 溶液配制
标准贮备液配制:精确称取0.01 g(精确至0.0001 g)6-BA标准品,置于500 mL容量瓶中,用甲醇∶水(V/V=9∶1)混合液溶解后,充分摇匀,定容至刻度线,配制成20 mg·L-1的6-BA标准储备液,4℃冷藏保存待用。
标准工作储备液配制:准确转移25、5、0.5、0.25、0.1、0.05、0.025 mL标准储备液分别稀释为50、10、1、0.5、0.2、0.1、0.05 mg·L-1的标准工作液,4℃冷藏待用。
1.3 检测步骤
1.3.1 样品提取 称取捣碎混匀的豆芽样品5.00 g(精确至0.01 g)于50 mL聚乙烯离心管中,加入15 mL甲醇水溶液(v/v=7∶3),用均质机均质3 min,然后以13000 r·min-1离心10 min,取全部上清液并用蒸馏水定容至30 mL,待净化[29]。
1.3.2 样品净化 固相萃取柱Oasis HLB(6 cc/200 mg,Waters,美国)按以下方法对样品进行富集净化,过程如下:
活化:分别用5 mL甲醇,5 mL水活化固相萃取柱;上样:提取液全部上柱,上样流速控制在1 mL·min-1以内;淋洗:5 mL水、5 mL甲醇水(v/v=1∶1);洗脱:5 mL甲醇[30-32]。
将上述洗脱液旋转蒸发至近干,准确加入1 mL甲醇,漩涡振荡1 min,用0.45 μm有机滤膜过膜,上机测定。
1.4 色谱条件
1.4.1 超高效液相色谱仪色谱条件 色谱柱:DIONEX Acclaim C16色谱柱(4.6 mm×150 mm,3 μm);流速:1 mL·min-1;进样量:5 μL;柱温:30℃;流动相:A:甲醇,B:乙酸铵水溶液(30 mmol/L)。采用等度洗脱方式,洗脱程序:0~10 min,45%A。检测器:紫外检测器,检测波长265 nm[28]。
1.4.2 超高效液相色谱-质谱联用仪色谱条件 色谱柱:Eclipse Plus C18色谱柱(2.1 mm×50 mm,5 μm);流速:0.2 mL·min-1;进样量:5 μL;柱温:30℃;流动相:A:甲醇,B:乙酸铵水溶液(30 mmol/L)。采用等度洗脱方式,洗脱程序:0~10 min,45%A。
1.5 质谱检测条件
离子源:电喷雾离子源(ESI+);采集方式:MRM;干燥气温度:300℃;干燥气流量:7 L·min-1;鞘气温度:350℃;鞘气流量:11 L·min-1;毛细管电压:3.5 kV。质谱检测参数值见表1。

表1 6-BA质谱检测参数设定表Table 1 MRM parameters of 6-BA
1.6 空白样品豆芽中6-BA的消解
在室温25℃下,用自来水培养6 d后收获,收获后的豆芽分别以冷藏(5℃)和冻藏(-20℃)方式储存,每天检测豆芽中6-BA残留量的变化,以消解动态方程评价消解效果,消解动态方程为C=C0e-kt,式中:C为生长激素残留量,mg·kg-1;C0为生长激素初始浓度,mg·kg-1;k为降解速率常数,d-1;t为时间,d;当C= 0.5×C0时,t为半衰期。
2 结果与讨论
2.1 实验条件选择和优化
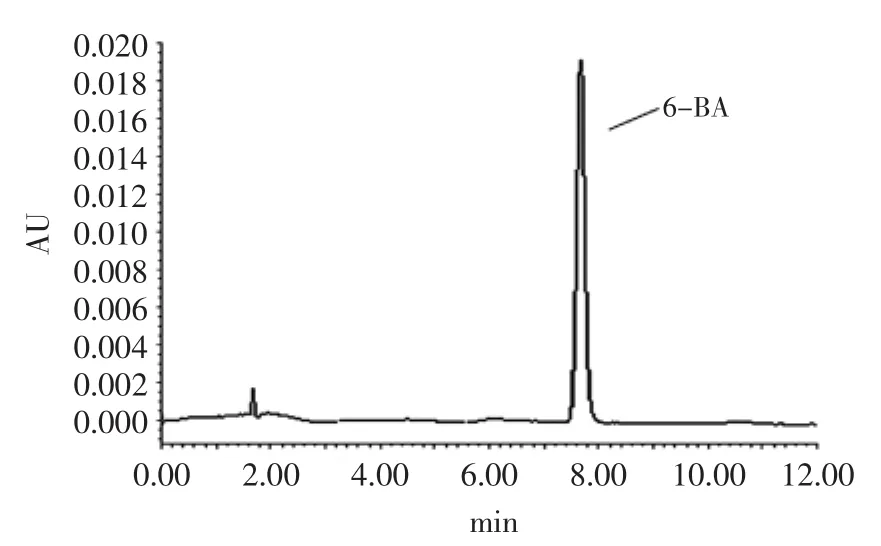
图1 6-BA标准色谱图Fig.1 Chromatogram of 6-BA standard
2.1.1 6-BA标准色谱图 按“1.4.1超高效液相色谱仪色谱条件”所述方法测得6-BA的标准图如图1所示,6-BA添加量为10 mg·kg-1,出峰时间为7.6 min。
2.1.2 色谱柱选择 首先选用MGⅢC18(3.0 mm I.D. ×100 mm,3 μm)色谱分析柱,C18色谱柱是以硅烷化键合型(Si-O-Si-C)存在的,实验所分析的目标化物6-BA在该色谱柱上虽有很好的保留,但样品中的杂质对目标物存在较大的干扰(图2A)。为了使目标物更好的与杂质分离,选用Acclaim®Polar Advantage C16(4.6 mm×150 mm,3 μm)色谱柱,C16柱对极性化合物具有出色的保留能力和分离度,与C18柱相比具有独特的选择性,疏水性比C18柱弱,实验证明目标物在C16柱上保留效果好且峰形良好,有效避免了杂质对6-BA在色谱柱上的干扰,从而满足样品分离的要求(图2B)。
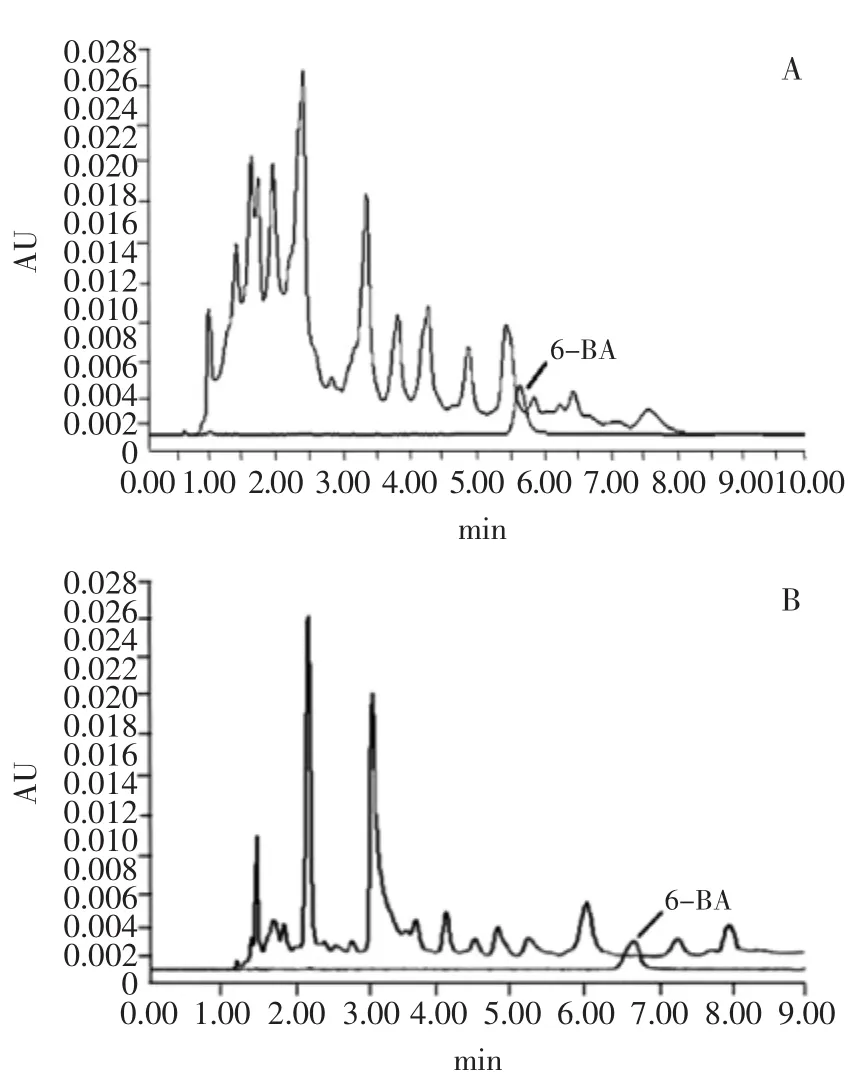
图2 选用不同色谱柱的黄豆芽样品和6-BA标准对比图Fig.2 Comparision of soybean sprouts characterized by twochromatographic columns
2.1.3 萃取溶剂选择 甲醇是一种通用型提取溶剂,且能与水互溶,适合分析含水量较高的豆芽样品。实验分别用酸化甲醇、甲醇∶水(V/V=7∶3)混合液和甲醇∶水(V/V=5∶5)混合液对样品进行提取对比。结果表明,三种提取溶剂对目标化合物的提取均有较好的回收率,平均回收率均在90%以上,但酸化甲醇会提取更多的杂质,干扰6-BA的检测,因此不选用酸化甲醇。水相含量大虽然有利于样品在固相萃取柱上的保留,但会增加水溶性杂质的提取量,且有机相含量大目标物提取率高,故选择甲醇∶水(7∶3)混合液为提取溶剂,而不选择甲醇∶水(5∶5)的混合液。
2.1.4 固相萃取柱的选择 由于豆芽样品种类繁多,成分复杂,干扰物较多,必须对样品进行净化,本实验采用固相萃取技术对样品进行前处理。分别使用Waters Oasis®MAX柱和Waters Oasis®HLB固相萃取柱进行净化。6-BA极性较小,难溶于水,微溶于乙醇,可溶于酸、碱,在酸、碱条件下均稳定。实验表明,样品提取液过柱时,吸附剂为混合型阴离子交换填料的Oasis®MAX固相萃取柱不能对6-BA有较好的保留,无法进行进一步的分析。而使用固相萃取柱为亲水亲脂平衡聚合物的Waters Oasis®HLB柱,其填料为亲脂性二乙烯苯和亲水性N-乙烯基吡咯烷酮两种单体按一定比例聚合成的大孔共聚物,可以极好的保留中强极性的物质,所以采用Waters Oasis®HLB固相萃取柱对样品中6-BA进行净化、浓缩。
2.1.5 固相萃取条件优化 在Waters Oasis®HLB固相萃取柱上,本实验中以甲醇∶水(7∶3)混合液作为提取液,采用甲醇水混合溶液进行淋洗,目的在于增强6-BA与固定相的结合,同时除去不需要的组分和杂质,并通过调节水中甲醇的不同浓度,最大可能的去除杂质而不洗脱分析物。实验选取甲醇∶水(V/V)分别为5∶5、6∶4、7∶3的三种混合液作为淋洗液进行优化,最终以甲醇∶水(5∶5)混合液作为淋洗液。洗脱溶液的选择目的在于使分析物完全洗脱,经筛选实验确定以5 mL纯甲醇溶液洗脱,回收率较好,除杂质效果理想。故最终确定固相萃取条件为5 mL水,5 mL甲醇:水(5∶5)混合液淋洗,5 mL甲醇洗脱。
2.2 方法学考察
2.2.1 线性范围和检出限 选取50、10、1、0.5、0.2、0.1、0.05 mg·L-1的6-BA标准工作液,按“1.4色谱条件”进行测定,绘制样品浓度(横坐标X,mg·L-1)与峰面积(纵坐标Y,AU)标准曲线,进行线性回归分析,且当信噪比为3(S/N=3)时,该方法对6-BA的最低检出限(LOD)为0.01 mg·L-1。分析结果,如表2所示。结果表明,该方法在0.05~50 mg·kg-1线性范围内,线性良好。

表2 线性范围及检出限Table 2 The linear range and limit of detection

表3 方法加标回收率及精密度Table 3 The linear range and limit of detection
2.2.2 样品加标回收率和精密度 本实验中空白样品均来自于实验室自发的黄豆芽、绿豆芽和扁豆芽。在豆芽的成熟期(6 d)后进行样品添加回收测定,分别取三种不同品种的空白豆芽样品,每一个品种取3份,每份5.0 g,分别加入0.5、2.0、10 mg·kg-1的6-BA标准溶液,按照“1.3检测步骤”进行前处理操作后,按“1.4.1超高效液相色谱仪色谱条件”进行测定,以浓度值计算加标回收率,没有基质干扰。为得到测定方法的精密度,实验对每一添加浓度样品重复测定9次。结果表明:6-BA的平均回收率在87.4%~90.0%之间,相对标准偏差(RSD%)在0.46%~0.60%之间。方法的回收率和重现性均较好。所得结果见表3。
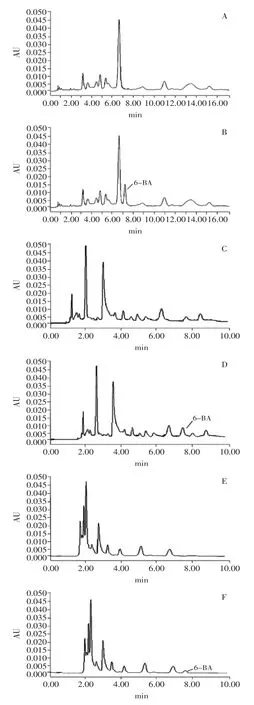
图3 豆芽空白样品及6-BA添加样品对比图Fig.3 Comparision chromatogram of blank sprouts’sample and 6-BA sprouts’sample
综上所述,此方法回收率较高,且精密度良好,因此实验方法能满足各个品种豆芽中6-BA残留量的检测要求。豆芽添加样品及空白样品检测结果如图3所示。结果显示,三种空白样品中均未检测到6-BA,而添加样品中检测到的6-BA色谱峰不受豆芽中杂质干扰,精密度较高,适用于豆芽样品中6-BA的检测。
2.3 6-BA在豆芽中的降解动态
供试的三种不同品种的空白豆芽样品均为实验室自发豆芽,统一在豆芽成熟期后,向三种空白豆芽样品中添加浓度为10 mg·kg-1的6-BA,于添加后1~15 d内每天检测豆芽中6-BA的含量。图4中A为冷藏(5℃)方式,B为冻藏(-20℃)方式,由图4所见,在冷藏条件下6-BA在三种不同的豆芽品种中残留量的变化为,0~4 d含量消解速率极快,4~12 d含量消解速率平缓;在冻藏条件下6-BA在三种不同的豆芽品种中残留量的变化为,0~10 d含量消解速率极快,10~15 d含量消解速率平缓。

图4 不同贮藏方式下6-BA的残留动态Fig.4 Dynamics of residues of 6-BA stored by different conditions注:A为冷藏条件下;B为冻藏条件下。
由表4可知,6-BA在冻藏方式下贮藏的黄豆芽、绿豆芽、扁豆芽中的原始沉积量分别为9.83、9.76、9.83 mg·kg-1,黄豆芽降解速度最快,绿豆芽次之,扁豆芽最慢,半衰期分别为3.108、3.349、3.675 d;6-BA在冷藏方式下贮藏的黄豆芽、绿豆芽、扁豆芽中的原始沉积量分别为9.79、9.59、9.91 mg·kg-1,黄豆芽降解速度最快,绿豆芽次之,扁豆芽最慢,半衰期分别为1.642、1.723、1.808 d。冻藏方式可以较好地减缓6-BA在豆芽中的降解速率。
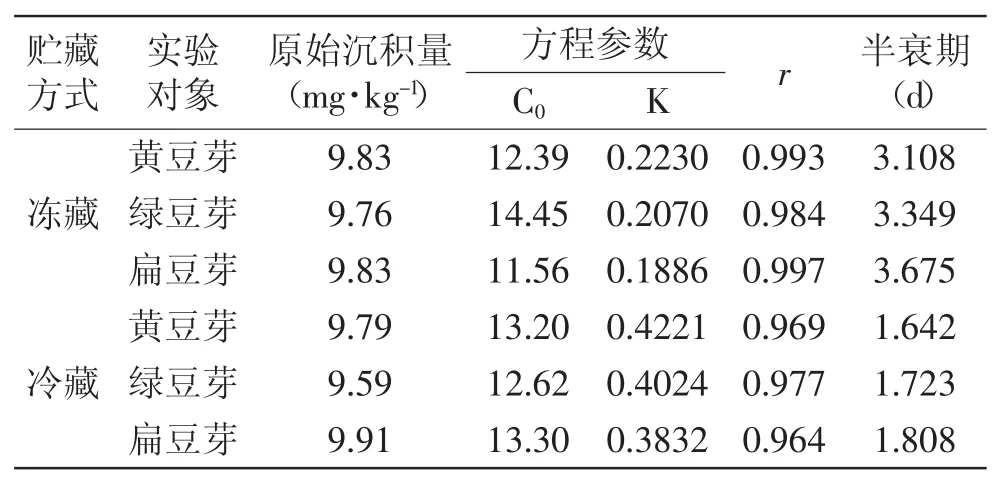
表4 不同贮藏方式下6-BA的的残留动态(n=7)Table 4 Dynamics of residues of 6-BA stored by different conditions(n=7)
2.4 实际样品检测
本实验对各大型超市及蔬菜市场中30批豆芽进行检测,其中,黄豆芽、绿豆芽及扁豆芽分别在超市与蔬菜市场抽取5个样品。检测结果表明,在市场购买的黄豆芽样品及绿豆芽样品中有两批样品检出6-BA,含量分别为5.3 mg·kg-1和2.1 mg·kg-1。
2.5 阳性样品验证
实验首先采用10 mg·kg-16-BA标准溶液,进行MRM质谱条件优化,使用“1.5质谱条件”对1 mg·kg-1标准品和三种不同种类的阳性样品同时进行检测后发现,阳性样品中的目标物质和标准品中的目标物质出峰时间相同,离子丰度均相同(图5),因此可以进一步验证所测阳性样品中的目标物质为所要检测的6-BA。
3 结论
该方法在超高效液相色谱仪上,用离子色谱柱作为分离手段,对植物生长激素6-BA进行了很好的分离分析,操作简单快速,灵敏度高,检出限较低,重现性好,此方法尚未见报道,是分析植物生长中添加6-BA值得推广的方法。本文还跟踪研究了6-BA在豆芽中的降解过程,根据实验结果显示,6-BA在豆芽中会在短时间内大量消解,因此对豆芽中添加的6-BA残留量进行检测时,需要在抽样后尽快进行检测,并注重抽样样品的保存方法,抽样后立即冻藏保存,这样能最真实有效的反映出6-BA在样品中的残留量。
图5 6-BA标准与阳性样品对比谱图(MRM)Fig.5 Comparision spectra chromatogram of 6-BA standard andthe positive sample
[1]邵玉娇,徐倩.黄豆芽和绿豆芽生化指标的检测与分析[J].湖北第二师范学院学报,2009,26(8):64-66.
[2]许守明,王伟,杨蓓,等.植物激素等物质对作物生长的调节研究[J].安徽农学通报,2010,16(11):56-57.
[3]王丽萍,李志刚,谭乐和,等.植物内源激素研究进展[J].安徽农业科学,2011,39(4):1912-1914.
[4]张德纯,刘中笑,林源,等.豆芽菜三个标准的比较分析[J].中国蔬菜,2010,15(3):12-14.
[5]王春阳.七种主要植物激素信号通路的起源与进化[D].泰安:山东农业大学,2013.
[6]刘涛,王日葵.水果成熟衰老与植物激素相关性研究进展[J].农产品加工,2010,208(5):30-37.
[7]GB2760-1996,食品添加剂使用卫生标准[S].
[8]周艳明,忻雪.高效液相色谱法测定果蔬中7种植物激素的残留量[J].食品科学,2010,31(18):301-304.
[9]GB2760-2011,食品添加剂使用标准[S].
[10]DB11/T 379-2006,《豆芽中4-氯苯氧乙酸钠、6-苄基腺嘌呤、2,4-滴、赤霉素、福美双的测定》[S].
[11]DBS12/001-2014,食品安全地方标准工业化豆芽生产卫生规范[S].
[12]DBS22/002-2012,食品安全地方标准豆芽中6-苄氨基嘌呤的测定高效液相色谱法[S].
[13]DB11/377-2000,北京市地方标准《豆芽安全卫士要求》[S]. [14]DB33/625-2003,浙江省地方标准《无公害豆芽质量安全要求》[S].
[15]张颖,赵晋铭,顾振新,等.不同浓度碘处理对绿瓣大豆芽菜生长及营养素的影响[J].江西农业学报,2008,20(7):39-42. [16]谢艳丽,谭曜,周雪晴,等.HPLC法测定胡椒材料中6-苄基腺嘌呤残留量[J].食品科技,2011,36(11):291-293.
[17]汪伟.几种植物生长调节剂的高效液相色谱分析[J].农药,2009,48(2):116-118.
[18]马瑜璐,朱斌,徐昕荣,等.HPLC法检测豆芽、芒果、番茄中2,4-二氯苯氧乙酸的残留量[J].广东化工,2013,15(3):166-167.
[19]王春媛,刘俊亭,高利娜,等.GC-MS检测豆芽中6-苄基腺嘌呤[J].公共安全中的化学问题研究进展,2010,50(5):383-387.
[20]黄何何,徐敦明,周昱,等.高效液相色谱-串联质谱法测定水果中多种天然植物生长调剂的残留量[J].食品安全质量检测学报,2014,5(4):1134-1141.
[21]金米聪,陈晓红,李小平,等.HPLC/APCI/MS法测定水果中6-苄基腺嘌呤[J].仪器分析,2005,23(3):29-31.
[22]柳菡,吴斌,殷耀.高效液相色谱-串联质谱法测定芽苗类蔬菜及其来源豆类中4种非法添加物的残留量[J].色谱,2013,31(1):22-26.
[23]张莹,鹿毅,杨涛,等.高效液相色谱-串联质谱法测定果蔬中7种植物生长促进剂残留[J].分析测试学报,2013,31(4):442-447.
[24]牟艳莉,郭德华,丁卓平.高效液相色谱-串联质谱法检测瓜果中的4种植物生长调节剂的残留量[J].色谱,2013,31(10):1016-1020.
[25]徐生坚,曹慧,陈小珍.超高效液相色谱-串联质谱法测定粮谷中6种植物生长调节剂残留[J].食品科学,2013,34(18):218-221.
[26]张敏,闫超杰,付海滨,等.固相萃取净化-高效液相色谱测定水果中赤霉素、多效唑、烯效唑残留量[J].食品与发酵工业,2014,40(2):192-195.
[27]李金昶,王璐,韩明友,等.固相萃取富集高效液相色谱法测定苯氧乙酸和2,4-二氯苯氧乙酸[J].分析化学研究简报,2001,29(5):580-582.
[28]李小平,陈晓红,姚浔平,等.HPLC法测定豆芽中6-苄基腺嘌呤残留研究[J].中国卫生检验杂志,2005,15(2):149-150.
[29]谢寒冰,周明莹,赵海峰,等.高效液相色谱-四极杆飞行时间质谱法同时检测豆芽中的3种外源植物激素残留[J].色谱,2014,33(5):493-498.
[30]周艳明,忻雪.高效液相色谱法测定果蔬中7种植物激素的残留量[J].食品科学,2010,18(3):301-304.
[31]闵季春,陈石金.高效液相色谱法测定豆芽中2,4-D含量[J].现代农业科技,2014,25(10):282-284.
[32]李广庆,马国辉.固相萃取技术在食品痕量残留和污染分析中的应用[J].色谱,2011(7):606-612.
Determination of 6-BA and its residual dynamics in bean sprouts by SPE-UPLC
LIU Yu-si1,WANG Bo2,YAN Heng1,LIU Qian-qian2,WANG Yan-chun1,ZHOU Wei2,*
(1.College of Food Science and Engineering,Gansu Agricultural University,Lanzhou 730070,China;2.Central Laboratory of Technical Center of Gansu Entry-Exit Inspection and Quarantine Bureau,Lanzhou 730020,China)
This study was aimed to set up a novel method to detect the residual content of 6-Benzylaminopurine(6-BA)of three kind of bean sprouts with the solid-phase extraction-ultra performance liquid chromatography and try to indicate the dynamic variation of content of 6-BA in bean sprout with different storage conditions and interval times.DIONEX Acclaim C16(4.6 mm×150 mm,3 μm)was used and the mobile phases were methanol and ammonium acetate,respectively,with a ratio of 45%methanol.Flow velocity was 1 mL·min-1and the detection wavelength was 265 nm.The results showed that spiked recoveries were 87.4%~90.0%.The relative standard deviation was 0.46%~0.60%.Detection limit and linear range of 6-Benzylaminopurine was about 0.01 mg·kg-1and 0.05~50 mg·kg-1respectively.The novel method was quite easy to use and could be used to detect accurately the content of 6-BA.The content of 6-BA showed the drop trend with the rise of storage time and the minimum half-life period was 1.642 and 3.108 d respectively under the conditions of frozen storage and cold storage.
SPE-UPLC;6-BA;bean sprouts;residual dynamics
TS201.1
A
1002-0306(2015)22-0061-06
10.13386/j.issn1002-0306.2015.22.004
2015-01-08
刘雨思(1988-),女,在读硕士研究生,主要从事环境、食品药品的分析与检测方面的研究,E-mail:lys2931@126.com。
*通讯作者:周围(1957-),男,博士,研究员,主要从事食品营养及食品安全分析方面的研究,E-mail:zhouwei845@163.com。

