新型芳醛并苯甲酰腙类化合物的合成及其抗结核活性*
卢久富,白跃飞,周 鹏
[1.陕西理工学院 化学学院,陕西 汉中 723001;2.东北制药集团股份有限公司,辽宁沈阳110026 3.东北制药(沈阳)施德药业有限公司,辽宁沈阳 110026]
目前临床上常用的抗结核药物有异烟肼、利福霉素、吡嗪酰胺和乙胺丁醇等。现有的抗结核药物存在着活性较差、多重耐药性、治疗周期长且需联合用药等问题,临床效果越来越不能满足人类需要,寻求更好的抗结核药物具有重要的意义[1-2]。
本文以2-氨基-5-取代苯甲酸甲酯(1a,1g,1i)为起始原料,与芳酰氯(2a~2e)经酰化反应后再与R-Br(4a,4b,4d,4f~4i)经胺基化反应制得中间体(5a~5i);5与水和肼反应后再与芳醛(7a,7d,7g和7h)经缩合反应合成了一系列新型的芳醛并苯甲酰腙类化合物(8a~8i,Scheme 1);2-氨基-5-哌啶基苯磺酰胺(Ⅰ)经3步反应合成了新化合物(Ⅳ,Scheme 2),其结构经1H NMR和ESI-MS表征。分别采用MABA和纸片法初步测定了8a~8i和Ⅳ对结核分枝杆菌H37Rv和草分枝杆菌1180的抑制活性。
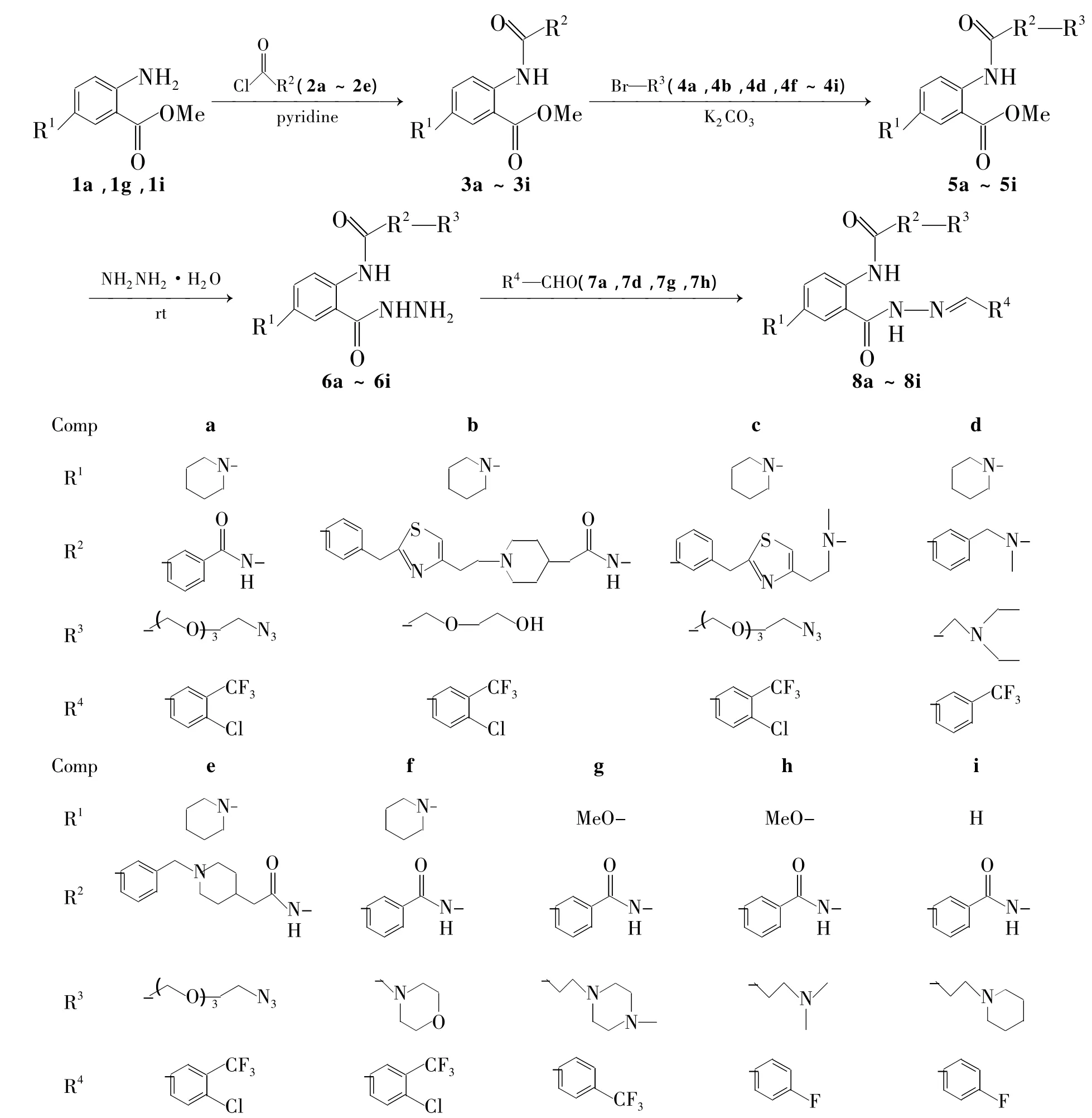
Scheme 1
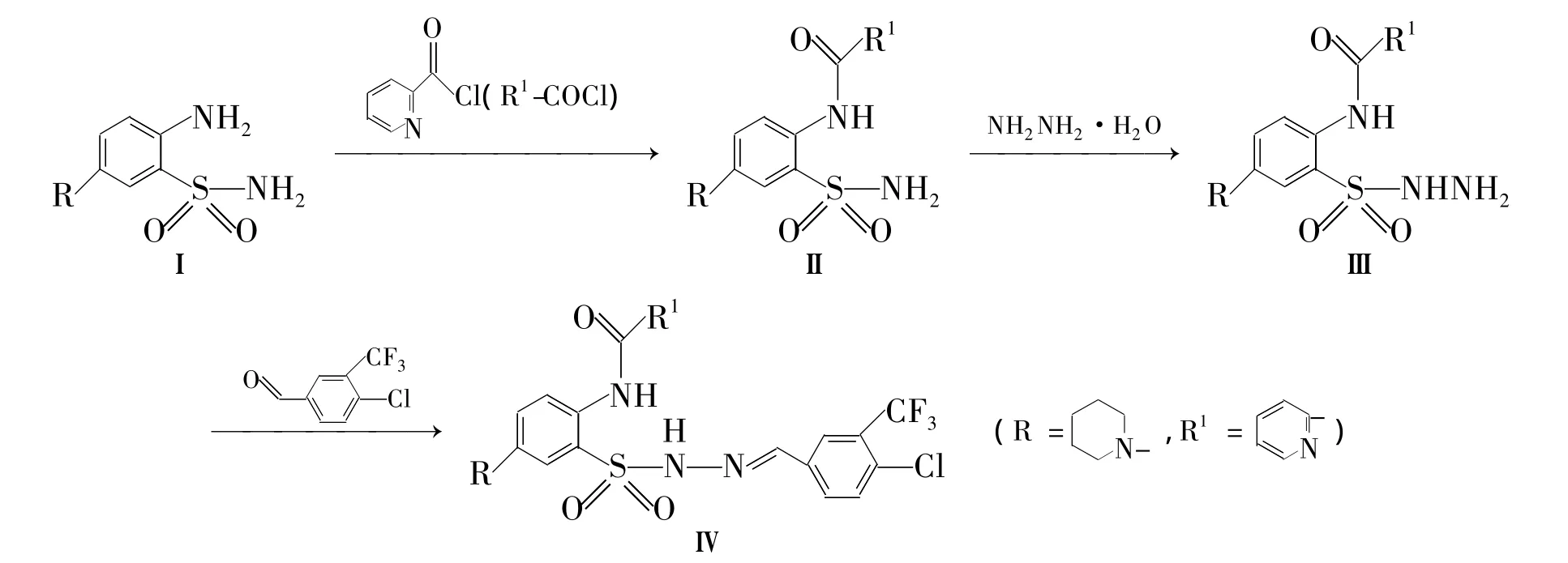
Scheme 2
1 实验部分
1.1 仪器与试剂
ARX-300型核磁共振仪(DMSO-d6为溶剂,TMS为内标);Shimadzu GC-MS2010(EI)型质谱仪。
薄层色谱硅胶GF254,青岛海洋化工厂;柱层层析硅胶,试剂级,160目~200目,安徽良臣硅源材料有限公司;2-氨基-5-哌啶苯甲酸甲酯,上海邦成化工有限公司;3-甲酰胺基苯甲酰氯(2a),东北制药集团股份有限公司;其余所用试剂均为分析纯或化学纯。
1.2 合成[3-4]
(1)3a~3i和Ⅱ的合成(以3a为例)
在圆底烧瓶中加入2a 1.1 g(6.00 mmol)和二氯甲烷30 mL,搅拌使其溶解;加入吡啶1.55 g(19.62 mmol),于室温反应10 min;滴加1a 4.591 g(3.93 mmol),滴毕,于室温反应30 min。真空浓缩除掉二氯甲烷,残余物加入乙酸乙酯100 mL,用水(3×100 mL)洗涤,有机相真空浓缩后经硅胶柱色谱[洗脱剂:V(石油醚)∶V(乙酸乙酯)=1∶100]纯化得白色粉末2-(3-苯甲酰胺基)-5-哌啶基苯甲酸甲酯(3a)958.2 mg,产率 64%,m.p.105℃ ~107 ℃;ESI-MS m/z:382.2{[M+H]+}。
用类似的方法合成3b~3i和Ⅱ。
(2)5a~5i的合成(以5a为例)
在反应瓶中加入3a 76.2 mg(0.2 mmol)和丙酮10 mL,搅拌使其溶解;加入碳酸钾104 mg(0.7 mmol)和1-叠氮基-2-{[2-(2-溴乙氧基)乙氧基]乙氧基}乙烷(4a)59.2 mg(0.21 mmol),于 0 ℃反应1 h[TLC跟踪:展开剂:A=V(二氯甲烷)∶V(甲醇)=20∶1]。过滤,滤液真空浓缩后经硅胶柱色谱(洗脱剂:A=30∶1)纯化得白色粉末2-【3-【2-{2-[2-(2-叠氮乙氧基)乙氧基]乙氧基}乙基羰基】苯甲酰基】-5-(哌啶基-1)苯甲酸甲酯(5a)54.7 mg,产率 47%,m.p.130 ℃ ~132 ℃;ESI-MS m/z:583.2{[M+H]+}。
用类似的方法合成5b~5i和Ⅲ。
(3)6a~6i的合成(以6a为例)
在圆底烧瓶中加入5a 116.4 mg(0.2 mmol)和乙醇15 mL,搅拌使其溶解;加入水合肼500.1 mg(9.98 mmol),于室温反应20 min。滴加水6 mL猝灭反应,用乙酸乙酯(3×100 mL)萃取,合并有机相,用无水硫酸钠干燥,真空浓缩得淡黄色固体6a 111.1 mg,产率 95.0%,m.p.127 ℃ ~129 ℃;ESI-MS m/z:583.2{[M+H]+}。
用类似的方法合成6b~6i和Ⅲ。
(4)8a~8i和Ⅳ的合成(以8a为例)
在圆底烧瓶中加入6a 116.4 mg(0.2 mmol)和乙醇10 mL,搅拌使其溶解;加入4-氯-3-三氟甲基苯甲醛(7a)41 mg(0.21 mmol),于50℃反应2 h。真空浓缩后经硅胶柱色谱(洗脱剂:A=30∶1)纯化得类白色固体8a。
用类似的方法合成类白色固体8b~8i和Ⅳ。
8a:产率 35.0%,m.p.141 ℃ ~143 ℃;1H NMR δ:12.24(s,1H),11.19(s,1H),8.70(s,1H),8.50(s,1H),8.40(s,1H),8.17(s,2H),8.05(m,3H),7.83(s,J=8.4 Hz,1H),7.67(t,1H),7.43(s,1H),7.34(s,1H),3.58 ~3.52(m,12H),3.47 ~3.29(m,8H),1.70 ~1.58(m,6H);ESI-MS m/z:773.2{[M+H]+}。
8b:产率 29%,m.p.137℃ ~139℃;1H NMR δ:12.25(s,1H),1.19 ~1.00(s,1H),9.04(s,1H),8.51(s,1H),8.19 ~8.16(d,J=8.4 Hz,2H),8.07 ~8.04(d,J=8.7 Hz,1H),7.95 ~ 7.81(m,4H),7.58(s,2H),7.35(s,2H),7.26 ~7.23(d,J=9.0 Hz,1H),4.44(s,2H),3.43 ~3.39(m,5H),3.23(s,6H),3.14 ~3.09(m,2H),3.01 ~2.93(m,2H),2.07 ~2.04(d,J=6.6 Hz,2H),1.85 ~1.80(d,J=13.5 Hz,3H),1.68 ~1.59(d,J=2.7 Hz,5H),1.39 ~1.34(d,J=13.5 Hz,2H);ESI-MS m/z:882{[M+H]+}。
8c:产率 34%,m.p.121℃ ~123℃;1H NMR(CDCl3)δ:12.22(s,1H),11.20(s,1H),8.54 ~8.51(d,J=9.0 Hz,1H),8.44(s,1H),8.36(s,1H),8.06 ~8.00(m,2H),7.94 ~7.92(d,J=7.5 Hz,1H),7.77 ~ 7.71(m,2H),7.63~ 7.58(m,2H),7.56 ~ 7.52(m,3H),7.29(s,1H),4.49(s,2H),3.84 ~ 3.67(m,2H),3.65 ~3.44(m,17H),3.25 ~3.21(m,2H),2.99(s,3H),1.91 ~1.73(m,6H);ESI-MS m/z:884{[M+H]+}。
8d:产率 24%,m.p.122℃ ~124℃;1H NMR δ:11.79(s,1H),10.39(s,1H),8.38 ~8.35(d,J=6.0 Hz,1H),8.08(s,1H),7.89 ~7.87(d,J=7.2 Hz,1H),7.75 ~7.64(m,4H),7.59 ~ 7.50(m,2H),7.22 ~ 7.18(m,2H),4.44 ~4.34(s,2H),4.11(s,2H),3.46(s,4H),3.22 ~3.15(m,8H),2.64(s,2H),1.65 ~1.55(m,6H),1.24 ~1.19(m,6H);ESI-MS m/z:639.2{M+H]+}。
8e:产率 28%,m.p.134℃ ~136℃;1H NMR δ:12.24(s,1H),11.21(s,1H),8.49(s,1H),8.17(d,J=6.0 Hz,1H),8.04(d,J=6.3 Hz,1H),7.82(d,J=3.6 Hz,3H),7.77(s,1H),7.72(m,3H),7.51(d,J=3.3 Hz,2H),7.31(s,1H),7.26(s,1H),3.59(m,2H),3.56(m,7H),3.40(m,8H),3.20(m,6H),2.76(d,J=8.4 Hz,2H),1.92(m,2H),1.67(m,6H),1.66(m,4H),1.20(m,2H);ESI-MS m/z:884.2{[M+H]+}。
8f:产率 28%,m.p.126℃ ~128℃;1H NMR δ:12.22(s,1H),11.19(s,1H),8.49(s,1H),8.40(s,1H),8.17 ~8.05(m,5H),7.91 ~ 7.82(m,1H),7.69(s,1H),7.30(s,1H),7.24 ~7.21(d,J=9.0 Hz,1H),4.00(s,1H),3.61(s,8H),3.22(s,6H),1.66 ~1.58(m,6H);ESI-MS m/z:685{[M+H]+}。
8g:产率 25%,m.p.139℃ ~141℃;1H NMR δ:12.21(s,1H),11.17(s,1H),8.50(s,1H),8.40(s,1H),8.38(s,1H),8.35 ~8.14(m,2H),7.91 ~ 7.82(m,7H),4.01(s,3H),3.68 ~ 3.61(m,2H),3.26 ~ 3.22(m,2H),2.46 ~2.44(m,8H),2.38(s,6H);ESIMS m/z:611.2{[M+H]+}。
8h:产率 27%,m.p.122℃ ~124℃;1H NMR δ:12.18(s,1H),11.15(s,1H),8.51(s,1H),8.40(s,1H),8.35(s,1H),8.34 ~8.10(m,2H),7.80 ~ 7.72(m,7H),3.98(s,3H),3.67 ~ 3.62(m,2H),3.25 ~3.20(m,2H),2.32(s,6H);ESI-MS m/z:506.2{[M+H]+}。
8i:产率 22%,m.p.130℃ ~132℃;1H NMR δ:12.20(s,1H),11.19(s,1H),8.52(s,1H),8.41(s,1H),8.36(s,1H),8.32 ~8.13(m,2H),7.91 ~ 7.82(m,8H),3.66 ~3.63(m,2H),3.24 ~3.20(m,2H),2.46 ~2.42(m,4H),1.58 ~ 1.51(s,6H);ESI-MS m/z:516.2{[M+H]+}。
Ⅳ:产率 25%,m.p.135℃ ~137℃;1H NMR δ:12.02(s,1H),11.53(s,1H),8.70(s,1H),8.69(m,1H),8.45(m,1H),8.42(m,1H),8.21(s,1H),7.94(m,1H),7.75(m,2H),7.66(m,1H),7.54(m,2H),3.18(s,4H),1.61(m,6H);ESI-MS m/z:566{[M+H]+}。
1.3 抗结核活性测定
采用MABA法测定8a~8i和Ⅳ对结核分枝杆菌H37Rv的抑制作用。以DMSO为溶剂,配制c为64 mg·mL-1溶液,经稀释加入到接种结核分枝杆菌H37Rv细胞株(在37℃,5%的CO2条件下孵化24 h)的96孔板中,测定化合物对结核分枝杆菌H37Rv的MIC值[5-6]。以异烟肼和利福平为阳性对照药进行测定。
采用纸片法测定8a~8i和Ⅳ对草分枝杆菌M.phlei 1180的抗结核抑制作用。在斜面培养基上取一环M.phlei 1180接种于液体检定培养基中,于37℃恒温振荡培养48 h。分别取等量的菌悬液接种于一系列含有不同浓度化合物的液体检定培养基试管中,于37℃恒温震荡培养20 h,观察菌体生长是否受到抑制。利用所构建的以DNA回旋酶B亚基为靶点的抗结核药物筛选模型进行三次初筛测定化合物对M.phlei 1180的MIC值。以异烟肼和利福平为阳性对照药[5-6]。
2 结果与讨论
2.1 合成
本研究的目的在于提供一类新型抗结核药物结构,通过对其生物活性筛选,研究其构效关系,对寻找新型抗结构药物的结构具有重要的开发应用前景。
2.2 抗结核活性
8a~8i和Ⅳ对H37Rv和M phler 1180的MIC结果见表1。从表1可见,8c对H37Rv的抑制活性最佳,几乎达到对照药的抑菌效果;8d和8e稍次之,其余化合物对H37Rv的抑制作用较弱。原因可能是化合物中有较多的碱原子如N或O原子更有利。

表1 化合物的抗结构活性Table 1 Antituberculous activities of compounds
从表1还可见,8d抑制M phler 1180的活性最佳。其余化合物对M phlei 1180的抑制作用较弱。原因可能是化合物中R2和R3为短侧链的含N结构,有利于抑制M phlei 1180。
3 结论
本文分别以2-氨基-5-取代苯甲酸甲酯或2-氨基-5-哌啶基苯磺酰胺为原料,经4步或3步反应合成了10个新型的芳醛并苯甲酰腙类衍生物。通过生物活性的测定来研究化合物的结构与生物活性的关系,为寻找新的抗结核药物提供参考。
[1] 卢久富.1-芳基-3-取代-5-取代氨基-4-吡唑甲酰胺类化合物及其应用[P].CN 102 558 058,2012.
[2] 孙铁民,白跃飞,袁磊,等.二芳基喹啉类似物的制备与用途[P].CN 102 757 385,2012.
[3]Gason G L,Jeffrey W J,Nicholas R,et al.Compounds and methods for inhibiting phosphate transport[P].WO 2 012 005 475,2012.
[4]Quan M L,Lam P Y,Li Y l,et al.Preparation of arylamides and heterocyclylamides as factor Xa inhibitors for treatment of thromboembolic disorders[P].WO 2 002 000 651,2002.
[5]Y F Bai,Y Chen,L Yuan,W Xu,et al..Synthesis,crystal,computational study and in vitro anti-tuberculosis activity of N-(furan-2-yl-methyl)-N-[phenyl(quinolin-3-yl)methyl] acetamide derivatives[J].Journal of Molecular Structure,2001,1005(1 -3):113 -120.
[6]Y F Bai,L Yuan,Y Chen,et al.Synthesis,crystal and calculated structure,and biological activity of 2-[(6-bromo-2-methoxyquinolin-3-yl)(phenyl)methyl]-2,3,7,7a-tetrahydro-3a,6-epoxyisoindol-1(6H)-one[J].Journal of Chemical Crystallography,2012,42(4):318-322.

