热处理对经历高温锻炼的玉米象保护酶活性的影响
张会娜,吕建华,张晨光,白旭光
(河南工业大学 粮油食品学院,河南 郑州 450001)
0 引言
与传统化学方法防治储藏物害虫相比,热处理杀虫因其无污染、操作简单、杀虫迅速、不破坏环境等优点,可以较好地满足不断增长的市场需求,在粮食储藏空仓处理和加工场所杀虫实践中得到广泛的认可[1].国内外就热处理防治储藏物害虫的技术原理、杀虫效果和应用技术等已经进行了一定的研究[2-5].美国食品药品管理局(FDA)已于2008 年批准在粮食和食品行业采用热处理防治害虫,肯定了高温杀虫的潜在价值[4].热处理杀虫已在北美、欧洲、澳大利亚得到广泛应用.
高温影响昆虫新陈代谢,导致昆虫体内蛋白质的种类和数量、酶活性等发生一系列变化[6].其中超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)是比较重要的3 种保护酶,能保护生物体不受自由基的损害,Fridovich 称这3 种酶为保护酶系统[7].昆虫的耐热性与保护酶系统有关.因此,可将昆虫体内保护酶活性变化作为热处理条件选择的重要指标.
驯化(Acclimation)指生物在亚致死高温或低温范围内长时期(数天或数周,甚至整个世代)暴露,并获得增强的耐热性或耐寒性,同时导致生物体发生可逆和不可逆的生理变化过程.短时锻炼(Hardening)是相对于驯化而言的一种亚致死高温或低温短时间(数小时甚至数分钟)驯化.生物处于亚致死高温环境中一定时间,其自身的耐热性会发生变化.随着全球气候变暖,昆虫对高温的适应能力也有一定的变化.Krebs 和Loeschcke 发现将一种果蝇(Drosophila buzzatii)的蛹放在38 ℃环境中1 h,其成虫的耐热性显著提高[8].作者前期研究结果(待发表)也表明,经过短时的亚致死高温锻炼后,玉米象对高温环境的适应能力显著增强,但短时高温锻炼后的昆虫经过一定时间的热处理后,其体内3 种保护酶SOD、POD、CAT 活性的变化情况还未知.本试验以玉米象为对象,研究热处理对经历过短时高温锻炼的玉米象成虫的影响,以明确对高温和亚致死高温有一定适应能力的玉米象,经过热处理后体内保护酶活性的变化情况,以期在全球平均气温升高、生态环境改变的情况下,为热处理杀虫提供理论依据.
1 材料与方法
1.1 供试昆虫
供试昆虫为河南工业大学储藏物昆虫实验室饲养数代的玉米象,在(28±2)℃、RH(75±5)%的实验室条件下以干净小麦饲养,取羽化后1~2 周的成虫供试.
1.2 试验方法
1.2.1 高温锻炼方法
挑选羽化1~2 周的玉米象成虫(不分雌雄)若干头置于空玻璃瓶中(直径8 cm,高15 cm),在36℃、RH(75±5)%环境中锻炼5 h,取出后在10 min内进行热处理试验.
1.2.2 热处理方法
将玻璃瓶(直径4 cm,高9.5 cm)置于恒温水浴锅中(保证水浸没瓶身高度8 cm 左右),将温湿度计探头置于玻璃瓶中心以测瓶内温度,待达到设定温度并稳定后快速接入20 头羽化后1~2 周的玉米象成虫,用脱脂棉封口减少瓶内温湿度与外界的传递.热处理条件设定为:43 ℃处理时间分别 为165、205、245、285、325、365、405、445 min;47℃处理时间分别为10、20、30、40、50、60、70、80 min;51 ℃处理时间分别为2.0、2.5、3.0、3.5、4.0、4.5、5.0、5.5 min;55 ℃处理时间分别为40、50、60、70、80、90、100、110 s.将在不同处理温度下处理不同时间后的试虫取出,并在液氮中研磨制备酶液,重复3 次.以正常生存环境中的玉米象为对照.
1.3 酶活性测定
1.3.1 酶液的制备
参照李周直等[9]的方法并加以改进.取经过高温处理的玉米象成虫20 头,用pH 7.2 的Tris-HCl缓冲液(内含1%的聚乙烯吡咯烷酮和1%的EDTA)清洗干净,液氮研磨,将研磨液转入2.0 mL预冷的离心管中,用Tris-HCl 缓冲液冲洗研钵后并入研磨液中,用缓冲液补充至2.0 mL,于0~4 ℃以11 000 r/min 离心20 min,取上清液作为提取酶液,储存于4 ℃冰箱中.
1.3.2 蛋白质的测定
参照Bradford 的考马斯亮蓝G-250 方法测定上述酶液的蛋白质质量浓度(mg/mL)[10].
1.3.3 酶活性测定
SOD 活性的测定参考马志卿等[11]的邻苯三酚法.总反应体系为2.2 mL H2O、25 μL 邻苯三酚、2.25 mL pH 8.2 的Tris-HCl 缓冲液(含1% 聚乙烯吡咯烷酮和1% EDTA),50 μL 酶液,于波长为420 nm测定吸光度值.
SOD 活力(OD420·mg-1)=(OD1-OD2)/(OD1×0.5×蛋白质质量浓度),
式中:OD1为邻苯三酚2 min 吸光度;OD2为样品吸光度.一个酶活单位相当于4.525 mL 反应液达到50%的抑制所需的酶量,酶活性以比活力表示.
POD 活性的测定参考Simon 等[12]的愈创木酚法.反应混合液为2.0 mL pH 4.0 的醋酸缓冲液、50 μL 酶液、1.0 mL 0.05 mol/L 愈创木酚、1.0 mL 0.3 mol/L 的H2O2,加入试管立即摇匀并迅速倒入比色皿中,于470 nm 波长下比色,以蒸馏水调零,以缓冲液代替酶液作对照,记录4 min 后的吸光度值.以每分钟吸光度改变1 为一个酶活单位(U),酶活性以比活力表示.
POD 活力(U/mg)=OD1/t×蛋白质质量浓度,式中:OD1为混合液470 nm 的吸光度,t 为反应时间(min).
CAT 活性的测定参考杨兰芳等[13]的标准曲线法.取A、B 两支试管,A 为对照管,B 为样品管.在A中按顺序加入1.5 mL pH 7.8 的Tris-HCl 缓冲溶液(内含1%的聚乙烯吡咯烷酮和1%的EDTA)、0.1 mL 酶液、1.4 mL H2O、1.0 mL 8% H2SO4.B 管里依次加1.5 mL Tris-HCl 缓冲溶液、0.1 mL 酶液、1.1 mL H2O,0.3 mL 0.3 mol/L 的H2O2,摇匀,反应3 min 后加入1.0 mL 8% H2SO4终止反应.用A 管调零,在波长为240 nm 处测定样品管的吸光度.酶活性以比活力表示.
CAT 活力(mg·min·mg-1)=,式中:A2为对照的吸光度;A1为样品的吸光度;t 为反应时间(min);a、b 为标准曲线回归方程中的常数.
1.4 数据处理与分析
对所取得的试验数据采用SAS 9.0 软件进行方差分析,采用Duncan's 新复极差法进行多重比较,检验试验结果的可信度以及各处理间的差异显著性.
2 结果与分析
2.1 43 ℃高温处理对经历高温锻炼的玉米象酶活性的影响
将在36 ℃环境中锻炼5 h 的玉米象成虫置于43 ℃的高温条件下处理不同时间,测定其SOD、POD、CAT 活性,结果见表1.
由表1 可知,在整个热处理时间段,试虫体内的SOD 活性随着处理时间的延长先升高后降低,POD 活性先降低后升高,CAT 活性则先升高后降低再升高.热处理后的玉米象体内SOD 活性较对照组有明显不同,在处理时间为245 min 时达到最大,是对照组的1.64 倍,之后逐步降低.POD 和CAT 在整个处理时间段内活性最低值都出现在热处理时间为365 min 时.

表1 43 ℃高温处理对经历高温锻炼的玉米象保护酶活性影响Table 1 The effect of heat treatment at 43 ℃on protective enzyme specific activities in S.zeamais with high temperature hardening
2.2 47 ℃高温处理对经历高温锻炼的玉米象酶活性的影响(表2)
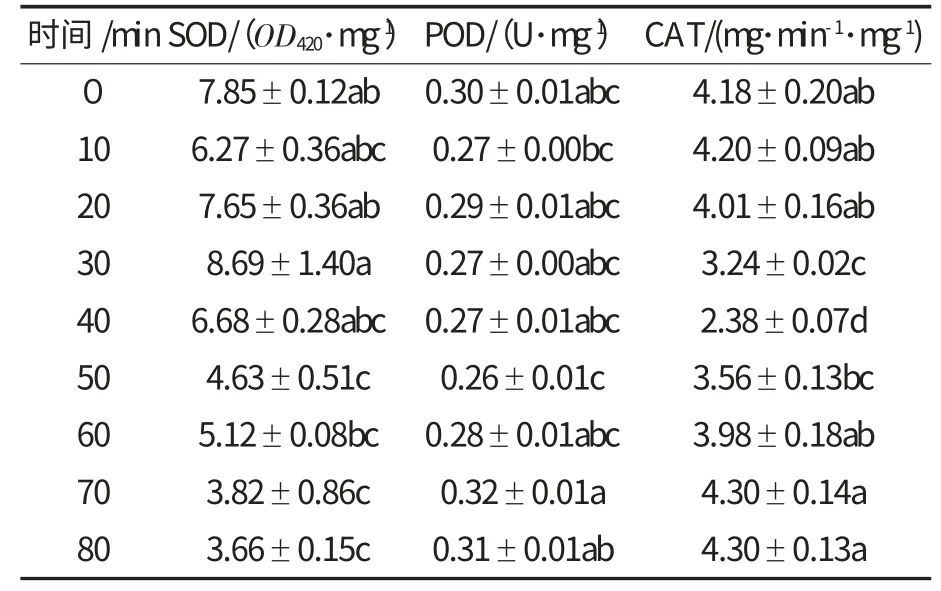
表2 47 ℃高温处理对经历高温锻炼的玉米象保护酶活性的影响Table 2 The effect of heat treatment at 47 ℃on protective enzyme specific activities in S.zeamais with high temperature hardening
由表2 可知,以47 ℃的高温处理玉米象成虫时,随热处理时间的延长,虫体内SOD 活性在0~40 min 时无显著变化,40 min 以后逐渐降低;POD活性整体变化不大,CAT 活性先下降后升高.整个处理过程中SOD 活性有被抑制的现象,除处理时间为20 min 时其活性高于对照组外,其他时间段都低于对照组,且在处理时间为80 min 时酶活性仅为对照组的47%,二者差异显著(P<0.05).热处理时间为50 min 时,POD 活性被抑制,其活性显著低于对照组.CAT 活性在热处理时间为40 min 时达到最低,与其他处理时间差异显著(P<0.05).
2.3 51 ℃高温处理对经历高温锻炼的玉米象酶活性的影响(表3)

表3 51 ℃高温处理对经历高温锻炼的玉米象保护酶活性的影响Table 3 The effect of heat treatment at 51 ℃on protective enzyme specific activities in S.zeamais with high temperature hardening
由表3 可见,在热处理时间段内,SOD 和POD活性整体上呈现先升高后降低的趋势,CAT 活性整体升高.玉米象体内SOD 和POD 活性在整个处理时间段内均高于对照组,且在处理时间不大于3 min 时,SOD 活性无显著差异(P>0.05).51 ℃热处理对玉米象体内CAT 活性的影响较大,表现为除3.5 min 处理外,其他处理时间段CAT 活性显著高于对照组.
2.4 55 ℃高温处理对经历高温锻炼的玉米象酶活性的影响(表4)
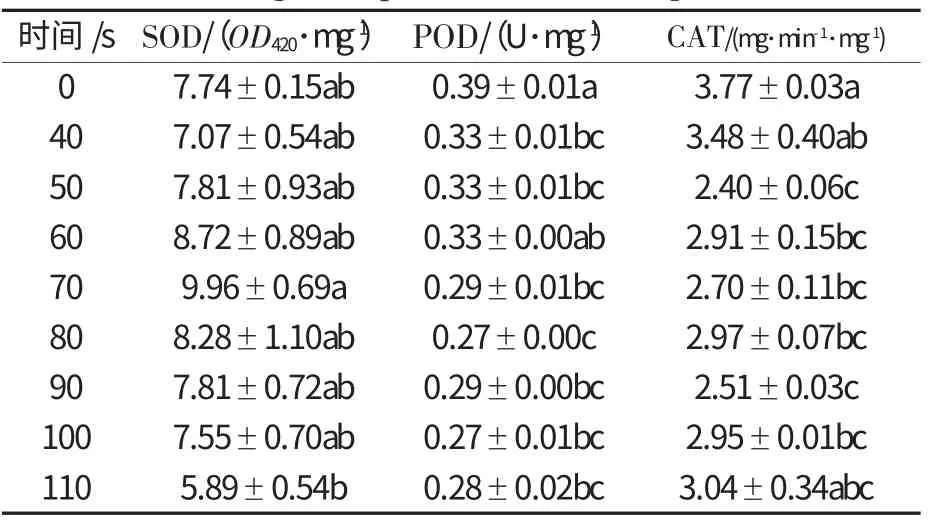
表4 55 ℃高温处理对经历高温锻炼的玉米象保护酶活性的影响Table 4 The effect of heat treatment at 55 ℃on protective enzyme specific activities in S.zeamais with high temperature hardening
从表4 可知,在55 ℃高温处理条件下,SOD 活性随着热处理时间的延长略有升高,但相互之间无显著差异,直到处理110 s 时,活性显著下降.POD 活性在整个热处理期间均显著降低(P>0.05),处理100 s 时活性最低.整个处理过程中,CAT 的活性变化与POD 相似.
3 讨论
昆虫在诸如高温、低温等逆境条件下,其体内具有氧化能力的自由基会增加,当积累到一定程度可导致生物功能分子的氧化损伤[14].SOD、POD和CAT 3 种酶能互相协调,使细胞内自由基的产生与清除处于一种动态平衡,避免细胞遭受自由基毒害,一旦这种平衡受到破坏则可能造成细胞损伤,甚至死亡[9].本试验中,在4 种不同的热处理温度下,随着处理时间的延长,玉米象体内SOD 活性先升高后降低,表明适度的热处理能使SOD 清除自由基的能力增强,持续较长时间的热处理则对SOD 活性产生抑制作用,这与高温条件下椰心叶甲啮小蜂成蜂体内的SOD 活性变化情况一致,表明长时间的高温胁迫,SOD 不能及时清除细胞中的超氧自由基[15].CAT 活性在热处理初始阶段较低,之后有所增强.POD 活性的变化则因温度不同而异,且在51 ℃热处理条件下活性较强.导致SOD、POD 和CAT 酶活性变化的原因可能是,热处理条件下昆虫活性氧增加,SOD 清除O2-形成H2O2,CAT 和POD 清除H2O2,避免其与O2-生成毒性更强的HO·,所以POD 和CAT 的活性变化较SOD 有一定的滞后性[9].热处理温度为55 ℃时,3种酶活性较低,表明试虫体内的抗氧化系统难以应对氧化胁迫,导致自由基积累过多,使试虫生命力降低[16].
适宜的高温锻炼能增强玉米象的耐高温能力,综合作者前期的工作,高温锻炼过的玉米象经热处理后,体内POD 和CAT 活性整体上较未经过高温锻炼的强,表明温和的短时高温锻炼在一定程度上能增强保护酶清除自由基的能力.在我国部分地区,夏季最高温度可达36 ℃以上,长期生存在该环境下的昆虫会有较强的耐高温能力,增加了热处理杀虫的难度.由本试验结果可知,延长热处理时间和提高热处理温度能抑制昆虫体内SOD活性,降低O2-的清除速率,从而使害虫自身的防御能力迅速下降,提高热处理杀虫效果.
生物体对外源性刺激的反应机制是多方面的,且相互联系、互相补充[17].POD 和CAT 作为保护酶系统的重要酶系,在氧化应激中共同清除H2O2以维持自由基在较低水平.本试验中,4 种热处理温度下POD 活性的变化趋势都不一样,其原因究竟是不同温度导致POD 合成发生变化,或是热处理时间导致POD 活性改变,以及氧化修饰损伤影响其功能的发挥等,还有待进一步研究[18].
[1]Beckett S.Insect and mite control by manipulating temperature and moisture before and during chemical -free storage[J].Journal of Stored Products Research,2011,47(4):284-292.
[2]Mahroof R,Subramanyam B,Eustace D.Temperature and relative humidity profiles during heat treatment of mills and its efficacy against Tribolium castaneum(Herbst)life stages[J].Journal of Stored Products Research,2003,39(5):555-569.
[3]Tilley D R,Casada M E,Arthur F H.Heat treatment for disinfestation of empty grain storage bins[J].Journal of Stored Products Research,2007,43(3):221-228.
[4]Tang J,Mitcham E,Wang S,et al.Heat treatments for postharvest pest control:theory and practice[M].Wallingford:CAB International,2006.
[5]王殿轩,王世伟,白春启,等.中温热处理杀虫技术研究应用及注意问题[J].粮食与饲料工业,2014(3):11-14.
[6]杜尧,马春森,赵清华,等.高温对昆虫影响的生理生化作用机理研究进展[J].生态学报,2007,27(4):1565-1572.
[7]Fridovich I.Oxygen is toxic![J].Bioscience,1977,27(7):462-466.
[8]Krebs R A,Loeseheke V.Resistance to thermal stress in Preadult Drosophila buzzatii:variation among populations and changes inrelative resistance across life stages[J].Biol J Linn Soc,1995,56:517-531.
[9]李周直,沈惠娟,蒋巧根,等.几种昆虫体内保护酶系统活力的研究[J].昆虫学报,1994,37(4):399-403.
[10]Bradford M M.A rapid sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J].Anal Biochem,1976,72:255-260.
[11]马志卿,韩秀玲,冯俊涛,等.松油烯-4-醇对粘虫几种代谢酶及酚氧化酶的影响[J].中国农业科学,2008,41(2):437-442.
[12]Simon L,Fatrai Z,Jonas D,et al.Study of peroxide metabolism enzymes during the dev-elopment of Phaseolus vulgaris[J].Biochem Physiol Pflanz BPP,1974:387-392.
[13]杨兰芳,庞静,彭小兰,等.紫外分光光度法测定植物过氧化氢酶活性[J].现代农业科技,2009(20):364-366.
[14]Yang L H,Huang H,Wang J J.Antioxidant responses of citrus red mite,Panonychus citri(McGregor)(Acari:Tetranychidae),exposed to thermal stress[J].Journal of Insect Physiology,2010,56(12):1871-1876.
[15]李志明,陈青,金启安,等.高温对椰心叶甲啮小蜂保护酶系活性的影响[J].热带作物学报,2010(6):994-998.
[16]冯从经,戴华国,武淑文.褐飞虱高温条件下应激反应及体内保护酶系活性的研究[J].应用生态学报,2001,12(3):409-413.
[17]夏长秀,李绍勤,蔡万伦,等.蛇床子素粉剂对玉米象成虫的杀虫活性及酶活性的影响[J].昆虫知识,2009(5):740-744.
[18]Tabatabaie T,Floyd R A.Susceptibility of glut athione peroxidase and glutathione reductase to oxidative damage and the protective effect of spin trapping agents[J].Arch Biochem Biophys,1994,314:112-119.

