花背蟾蜍皮肤结构及其抗氧化和免疫功能的研究
高凤娟, 李丕鹏, 陆宇燕
(沈阳师范大学 两栖爬行动物研究所, 沈阳 110034)
花背蟾蜍皮肤结构及其抗氧化和免疫功能的研究
高凤娟, 李丕鹏, 陆宇燕
(沈阳师范大学 两栖爬行动物研究所, 沈阳 110034)
为了深入了解花背蟾蜍(Bufo raddei Strauch)皮肤显微结构及其相关功能,利用石蜡切片及酶联免疫吸附反应技术,观察了花背蟾蜍背腹侧皮肤及其皮肤腺的显微结构特点,分别测定了背、腹侧皮肤中SOD、CAT、MDA、TLR4和βD-1含量。结果:花背蟾蜍皮肤结构与其他两栖类皮肤结构基本相同,其角质层腹侧较背侧厚,表皮和真皮背侧较腹侧厚;颗粒腺主要存在于背侧,而黏液腺主要存在于腹侧。SOD和TLR4含量腹侧皮肤高于背侧皮肤;CAT含量背侧皮肤较腹侧高;MDA和βD-1含量在背腹皮肤中相近。结论:花背蟾蜍皮肤结构和相关蛋白水平能够较好的适应其生境,并具有一定的抗氧化能力和天然免疫功能。
花背蟾蜍; 皮肤; 显微结构; SOD; TLR4;βD-1
0 引 言
脊椎动物的皮肤对机体有着重要的保护作用,而两栖类由于一心室两心房的特殊结构,皮肤在气体交换中也承担着不可忽视的作用。另外,近年的研究指出,两栖类皮肤腺体可以分泌大量的抗菌肽[1-3],以防御外界微生物的侵入。虽然对两栖类皮肤结构已有很多报道[4-7],但未见对东北地区花背蟾蜍皮肤结构、皮肤抗氧化酶和皮肤与天然免疫有关物质的研究报道。
花背蟾蜍是东北地区的广布种,已经广泛运用于生物学的研究[8-11]。国内对其皮肤的研究仅见对花背蟾蜍蝌蚪发生类坏死的皮肤在恢复过程中的超微结构、花背蟾蜍角膜和皮肤蛋白质组分的分析、花背蟾蜍耳后腺结构的研究和蝌蚪发育过程中皮肤的结构变化[12-15]。本研究旨在深入了解花背蟾蜍皮肤的结构、抗氧化和免疫功能的基本特点,为后续研究奠定基础,并进一步丰富花背蟾蜍的生物学资料。
1 材料与方法
1.1 材 料
成体花背蟾蜍5只,2014年5月采自沈阳北陵公园小湖,均为产卵后的个体,体重为(12±0.21) g,体长为(50±0.45) mm。实验室条件下暂养10日左右,其间喂以面包虫。
1.2 方 法
1.2.1 形态学
以适量的乙醚将实验用花背蟾蜍麻醉后,在躯干前后肢间进行皮肤的环剥。环剥下来的皮肤放置在冰盒(培养皿中放置碎冰,在其上再放置洁净的载玻片)上进行分类处理。
背腹近中线处左侧各取3 cm×0.5 cm的皮肤固定于10%的中性福尔马林溶液中,常规石蜡切片,厚7 μm,H.E染色和AB-PAS染色。利用OLYMPUS BX51-DP71显微镜进行显微观察和照相,Image-Pro Express 6.0进行相关参数的测量。
1.2.2 相关酶含量测定
完成上述取材后的剩余背、腹皮肤分别加入含有一定量的预冷任氏液(4 ℃)的离心管中剪碎,利用BD-1200非接触式超声波破碎仪(水循环制冷)进行破碎,利用TGL-16G-C型冷冻离心机离心(9 000 r/min)10 min取上清,保持于中科美菱超低温冰柜(-86 ℃)冰冻备用。选用鱼抗的酶联免疫吸附试剂盒,利用TECAN infinite F50型酶标仪分别测定超氧化物歧化酶(SOD)、丙二醛(MDA)、过氧化氢酶(CAT)、TOll样受体4(TLR4)、β-防御素1(βD-1)的含量。实验所用试剂盒均购自北京鼎国试剂公司,严格按照说明书步骤操作。
1.2.3 计算公式与数据处理
参照李洋[16]计算腺体的数量密度方法计算花背蟾蜍背腹皮肤中腺体的数量密度,计算公式为:数量密度=腺体个数/(腺体平均直径×材料平均长度)个/mm2。
所有实验数据利用SPSS 22.0分析,符合正态分布的数据进行单因素方差分析,不符合正态分布的进行非参检验,描述性统计值用平均值±标准差表示。
2 结 果
2.1 显微结构
花背蟾蜍皮肤的基本结构与其他两栖类皮肤相似,可分为表皮层和真皮层。
2.1.1 表皮
在表皮细胞最外层是一层由死亡的角质细胞及其分泌物共同构成的角质膜,其表面光滑、厚薄均匀,H.E染色呈透明的淡紫色,与角质化细胞连接紧密,仅局部区域与角质化细胞脱离(图1)。表皮呈为复层扁平上皮,最外层的角质化细胞呈梭形,H.E染色胞质呈伊红色,胞核较小、梭形,深蓝紫色。有些细胞已看不见其核的存在。

(a)—背侧皮肤HE染色; (b)—腹侧皮肤HE染色; (c)—背侧皮肤AB-PAS反色; (d)—腹侧皮肤AB-PAS染色。SC-角质层; TL-过渡层; SB—基底细胞; PC-色素层; SCp—致密层; SS—疏松层; MG—黏液腺; GG—颗粒腺。
表皮最内层的基底细胞呈长柱状或椭圆形,排列整齐,H.E染色胞质呈淡蓝紫色,胞核位于细胞中部,椭圆形,深染。在表皮的基底细胞和角质化细胞之间有1~3层的过渡细胞,此区域由内往外可见细胞呈椭圆形、扁椭圆形以及梭形的过渡变化。H.E染色中胞质也由浅蓝色、浅紫色至尹红色的过渡。胞核深染,由内向外细胞核逐渐变小,形状由长椭圆形逐渐变成梭形,有些细胞核周呈空泡状。在表皮中有色素颗粒分布,常见于背侧皮肤基底细胞层上方区域,腹侧皮肤少见。
2.1.2 真 皮
花背蟾蜍真皮疏松层的疏松结缔较为稀薄,仅在腺体周围清晰可见,H.E 呈浅粉色,AB-PAS染色呈蓝色。疏松层近基底细胞基膜处和皮肤腺周围分布有较多的毛细血管。黑色素细胞主要分布于表皮与真皮疏松层之间,且呈大小不均匀的连续的斑块状分布,在疏松层中偶尔也可见色素细胞的分布。背侧皮肤色素层明显较腹侧密集。 真皮致密层由大量波浪状平行排列的胶原纤维束构成,H.E染色呈淡红色。在这些平行排列的胶原纤维中,每隔一定距离都有一些较细的纤维束垂直于皮肤表面分布,并为平行排列的胶原纤维提供附着。在胶原纤维间可见大量的成纤维细胞,细胞及胞核均呈梭形,胞质淡红色,胞核深蓝紫色。
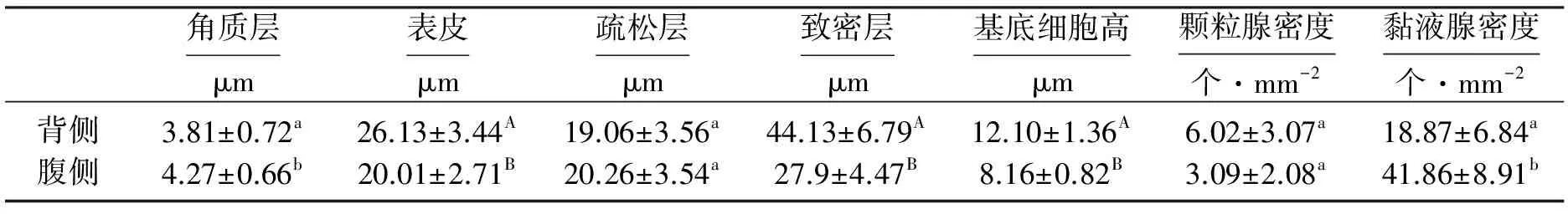
表1 花背蟾蜍背腹侧皮肤各层厚度及腺体密度
注:同一列不同小写字母表示差异显著(P<0.05),不同大写字母表示差异极显著(P<0.01)。
由表1可见,花背蟾蜍背腹侧皮肤各层之间均具有明显的差异。背侧皮肤最表层的角质层厚是腹侧的89.23%,二者之间成显著性差异。背侧真皮疏松层厚为腹侧的94.87%,二者间无显著性差异。背侧表皮层厚是腹侧的130.58%,二者间呈极显著性差异,而背侧表皮的基底细胞厚是腹侧的148.28%,二者间也呈极显著性差异。背侧皮肤致密层的厚是腹侧的158.17%,二者呈极显著性差异。
2.1.3 腺体
皮肤腺体属泡状腺,腺泡分布于真皮疏松层中,可见明显的导管部与表皮细胞相连。花背蟾蜍皮肤腺可区分为黏液腺和颗粒腺2种。一般情况下颗粒腺大于黏液腺。
黏液腺:腺泡近圆形,腺细胞多呈高柱状,H.E染色胞质呈淡蓝紫色,胞核柱状、深染,位于细胞基底。可见类肌细胞和毛细血管分布于腺泡细胞外周。在AB-PAS染色中,个别黏液腺的腺细胞可区分出玫红色、蓝色或玫红蓝相间。
颗粒腺:腺泡呈椭圆形,腺泡腔中充满大小不一的颗粒。H.E染色中,颗粒呈粉红色;在AB-PAS染色中,颗粒呈异质性,较大的颗粒多呈淡紫红色、较小颗粒多为淡蓝色。个别颗粒淡染但其中可见深色的不规则核心结构。大多数腺细胞呈扁平状,H.E染色胞质呈淡蓝紫色,核呈圆形或椭圆形、深染,位于细胞基底部。类肌细胞及毛细血管分布于腺泡细胞外周。
由表1可见,2种腺体在背腹侧皮肤中呈不均匀分布,颗粒腺主要分布于背侧皮肤中,腹侧皮肤颗粒腺较少。
2.2 相关物质含量的测定
背侧、腹侧皮肤中相关物质含量检测结果见表2。在皮肤与抗氧化功能有关的3个参数中,丙二醛(MDA)的含量在背腹侧皮肤中几乎相等;背侧皮肤中超氧化物歧化酶(SOD)含量是腹侧皮肤的87.77%,且二者之间有极显著性差异;而背侧皮肤中过氧化氢酶(CAT)的含量却是腹侧的122.56%,二者间呈显著性差异。花背蟾蜍背腹皮肤与其免疫功能有关的2个参数中,β-防御素在背、腹侧皮肤中含量基本相等;而背侧皮肤中TLR4含量仅为腹侧的57.62%,二者间呈极显著性差异。

表2 花背蟾蜍背腹侧皮肤抗氧化酶、βD和TLR受体含量
注:同一列不同小字母表示差异显著(P<0.05),不同大写字母表示差异极显著(P<0.01)。
3 讨 论
3.1 花背蟾蜍皮肤结构与生活环境的关系
两栖类是脊椎动物完成从水到陆演化的一个重要环节,两栖类皮肤的组织学结构特点也显示了相应的特征:两栖类皮肤裸露光滑,表皮有一定程度的角质化,可以起到防止体内水分流失的作用[17],同时丰富的皮肤腺使两栖类体表保持湿润,以保证皮肤具有一定的气体交换功能[18-19]。花背蟾蜍皮肤明显较其他蟾蜍类薄,甚至比属于水栖类型的黑斑侧褶蛙[16]的皮肤还要薄。这个结果是否与本实验用花背蟾蜍均为刚完成产卵、还处于繁殖季节有关,还需要进行进一步的研究。
3.2 花背蟾蜍皮肤抗氧化能力
由于臭氧层的削弱,地面承受的紫外辐射明显增强。紫外线中能抵达地球表面的主要成分是长波紫外线(UVA)和中波紫外线(UVB),由于二者物理性质的差异,对生物体的影响也具有明显的差异。其中UVA虽然其本身能量很低,对细胞和生物大分子没有直接的损伤效应,但其具有很强的穿透力,可以通过细胞所含有的内源性发色团的作用,诱导产生氧自由基。氧自由基对细胞膜中不饱和脂肪酸具有极强的氧化作用,使其产生丙二醛(MDA),其是细胞膜受氧化程度的标志物之一[20-21]。同时生物体的细胞中也存在着一套抗氧化内体系,能及时清除过多的氧自由基,以维护细胞的正常功能[10]。抗氧化酶系中的SOD在细胞中主要是清除活性氧自由基,使其形成H2O2后再由CAT进一步还原为H2O[22-23]。因此,检测花背蟾蜍皮肤中MDA 、SOD、CAT的含量可以反映花背蟾蜍皮肤的抗氧自由基的能力。本研究结果显示花背蟾蜍背腹侧皮肤中MDA含量基本相同,提示经过实验室暂养的花背蟾蜍背腹侧皮肤细胞膜脂氧化程度基本相同。但SOD和CAT却表现出背腹侧的明显差异,在背侧皮肤中作用于氧自由基的SOD含量低于腹侧,而作用于H2O2的CAT却高于腹侧。这是否是背腹侧皮肤结构的差异以及与环境接触的方式不同等原因导致腹侧皮肤抗氧化酶的活性较背侧高以防止氧自由基对细胞的破坏作用还有待于深入研究。
3.3 花背蟾蜍皮肤免疫能力
皮肤对于两栖类来说不仅仅是体表的保护层,更重要的是还承担着部分天然免疫的功能。皮肤中腺体的分泌物在保持体表湿润有利于气体交换和分泌大量的皮肤抗菌肽以保护两栖类避免微生物的侵害发挥着极其重要的作用[24]。β-防御素是抗菌肽之一,广泛存在于生物体直接和间接与外界接触的位置,它可以直接攻击侵入的微生物,还有趋化活性和免疫激活的功能。而β-防御素表达目前研究比较透彻的是经过NF-KB信号转导通路进行诱导。此通道中关键的蛋白是作为膜整合蛋白的病原模式识别受体,Toll样受体(TLRs)就是其中的一类[25-26]。本研究中花背蟾蜍TLR4的含量腹侧皮肤远高于背侧,而2个部位的βD-1含量基本相同。揭示了花背蟾蜍腹侧皮肤有着很强的免疫应激能力,这种应激能力的储备可能与其运动方式有一定的联系。由于蟾蜍类的肩带是固胸型。因此,它们在运动中常常以爬行的方式进行,这样就有很多机会与凸凹不平的地面接触,从而也避免不了被微生物侵入。腹侧皮肤中储存有一定量的βD-1和可以诱导其表达的TLR就可以及时利用天然免疫功能防止机体的进一步被感染。
[ 1 ]刘炯宇,江建平,谢锋,等. 两栖动物皮肤结构及皮肤抗菌肽[J]. 动物学杂志, 2004,39(1):112-116.
[ 2 ]白冰,王剑. 两栖动物皮肤几类生物活性多肽的研究进展[J]. 科技信息, 2011(5):115.
[ 3 ]赖仞,赵宇,杨东明,等. 六种常见两栖类动物皮肤分泌物的生物活性比较(英文)[J]. 动物学研究, 2002,23(2):113-119.
[ 4 ]吴文英,李丕鹏,陆宇燕,等. 黑龙江林蛙繁殖期两性皮肤组织结构的差异比较[J]. 野生动物, 2011,32(3):141-145.
[ 5 ]崔立勇,佟庆. 东北林蛙的皮肤结构[J]. 畜牧兽医科技信息, 2013(8):116.
[ 6 ]牛熙,徐云龙,冉雪琴,等. 务川臭蛙皮肤及指趾组织学特征[J]. 四川动物, 2012,31(5):755-759.
[ 7 ]张贤芳,张耀光,王志坚,等. 中华蟾蜍皮肤的组织学观察[J]. 西南农业大学学报, 2002,24(5):454-457.
[ 8 ]王晓茹,陆宇燕,聂颖,等. UVA对花背蟾蜍微核及核异常的诱导[J]. 四川动物, 2010,29(3):357-362.
[ 9 ]万丽霞,李宏伟,孙立新,等. 花背蟾蜍繁殖与食性研究[J]. 生物学通报, 2014,49(7):3-5.
[10]屈婷婷,李丕鹏,聂颖,等. 长波紫外线照射对花背蟾蜍肾脏结构损伤[J]. 生态学杂志, 2012,31(6):1480-1486.
[11]冯磊,戴昕鹏,张军,等. 重金属污染条件下花背蟾蜍跳跃能力与骨骼肌ATP酶和AChE活性变化研究[J]. 四川动物, 2012,31(4):553-557.
[12]仝允栩,杨增明. 花背蟾蜍蝌蚪发生类坏死的皮肤在恢复过程中的超微结构[J]. 实验生物学报, 1988,21(4):31-36,38,43.
[13]詹玉田,葛瑞昌,张晖. 花背蟾蜍角膜和皮肤蛋白质的SDS-PAGE分析[J]. 兰州大学学报, 1990,26(4):132-134.
[14]吴文英,李丕鹏,陆宇燕. 花背蟾蜍和中华蟾蜍皮肤腺体及耳后腺体的组织学研究[J]. 蛇志, 2011,23(1):20-25.
[15]李妍,李丕鹏,崔惠生,等. 花背蟾蜍蝌蚪皮肤的结构与发育[J]. 动物学杂志, 2013,48(4):588-596.
[16]李洋,金磊,李昌春,等. 黑斑蛙、虎纹蛙和牛蛙皮肤的比较组织学[J]. 安徽师范大学学报:自然科学版, 2009,32(5):466-470.
[17]解谦. 脊椎动物从水生到陆生的结构演变[J]. 山西农业大学学报:自然科学版, 2003,23(4):383-385.
[18]曹燕,谢锋,江建平. 齿突蟾属四个物种皮肤的组织学观察[J]. 四川动物, 2011,30(2):214-219,321.
[19]林文达,朱静,郭爱伟,等. 云南昆明地区三种蛙皮肤显微结构的比较[J]. 四川动物, 2008,27(3):420-421,423,481.
[20]LIU Cunbao,HONG Jing,YANG Hailong,et al. Frog skins keep redox homeostasis by antioxidant peptides with rapidradical scavenging ability[J]. Free Radic Biol Med, 2010,48(9):1173-1181.
[21]聂颖,李丕鹏,陆宇燕,等. 长波紫外线辐射对脊椎动物的影响[J]. 生态学杂志, 2010,29(5):1021-1027.
[22]宋刚,张迎梅,朱丽娜,等. 黄河上游环境污染对花背蟾蜍抗氧化酶活性及丙二醛含量的影响[J]. 四川动物, 2007,26(2):434-437.
[23]GUO Wentao,AO Mingzhang,LI Wei,et al. Major biological activities of the skin secretion of the Chinese giant salamander, Andrias davidianus[J]. Verlag der Zeitschrift für Naturforschung, 2012,67(1):86-92.
[24]金莉莉,王秋雨. 蛙科两栖动物皮肤抗菌肽的分子多样性及功能[J]. 遗传, 2008,30(10):1241-1248.
[25]贾红敏,卢立志,石放雄,等. 动物TLR4基因多态性及其抗病相关性研究进展[J]. 生命科学, 2010,22(6):546-550.
[26]段婷婷,李丕鹏,陆宇燕. 脊椎动物β-防御素的研究进展[J]. 沈阳师范大学学报:自然科学版, 2014,32(2):139-143.
Microstructure of toad (Buforaddei) andits antioxidant and immune function
GAOFengjuan,LIPipeng,LUYuyan
(Institute of herpetology, Shenyang Normal University, Shenyang 110034, China)
In order to understand the skin structure and function of the toad (Buforaddei), the conventional paraffin section technique and ELISA were adopted to observe the microstructural characteristics of its dorsal skin, ventral skin and skin glands; and determine the contents of SOD, CAT, MDA, TLR4 andβD-1 of the dorsal skin and ventral skin, respectively. The results show that the toad skin structures are similar to other amphibians. That is the ventral cuticle thicker than the dorsal, the dorsal epidermis and dermis thicker than the ventral, granular glands mainly in the dorsal skin, and mucous glands in the ventral skin. SOD and TLR4 examined in the ventral skin are higher than in the dorsal skin, CAT containing in the dorsal skin is higher than in the ventral skin, but MDA andβD-1 are similar in these two areas. In conclusion, the structures and related protein levels of the toad skin closely adapt to the living environment, and have the antioxidant capacities and natural immune functions.
Buforaddei; skin; structure; SOD; TLR4;βD-1
2015-04-07。
国家自然科学基金资助项目(30870276)。
高凤娟(1990-),女(蒙古族),辽宁阜蒙县人,沈阳师范大学硕士研究生; 通信作者: 陆宇燕(1962-),女,上海人,沈阳师范大学教授,硕士研究生导师。
1673-5862(2015)03-0324-05
Q246; Q136; Q954.539
A
10.3969/ j.issn.1673-5862.2015.03.002

