鸭瘟病毒PCR快速检测方法的建立及应用
于新友 李天芝 刘吉山 沈志强,
(1山东绿都生物科技有限公司 山东滨州 256600 2山东省滨州畜牧兽医研究院 山东滨州 256600)
鸭瘟(duckplague,DP)是由鸭瘟病毒(DPV)引起的鸭、鹅等水禽的败血性、高度致死性传染病[1],其特征为两腿麻痹、下痢、流泪和部分病鸭头颈肿大[2]。是危害养鸭业最严重的传染病之一[3],是OIE规定的B类传染病,给世界各国养鸭业造成了较大经济损失[4]。1923年,Baudet[5]首次报道荷兰的家鸭暴发鸭瘟。目前,该病呈世界性分布,1957年我国首次报道该病。检测DPV的常规方法有病毒分离、酶联免疫吸附和琼扩试验等,这些方法均有较多缺点如耗时长、检测敏感性较低及准确性差等,尤其对处于潜伏期的鸭不能检出其体内的DPV感染。PCR具有检测速度快、特异性好和灵敏度高等优点,已经广泛应用于细菌、病毒的诊断检测并展示其良好的应用前景。而应用PCR技术对鸭瘟进行诊断,能快速地检测出是否有DPV,是常规检测方法无法比拟的。因此,建立1种DPV病毒PCR检测方法对于DPV的早期临床诊断,从而采取适当的措施,防止鸭瘟的大规模暴发有很重要的意义。
本研究根据GenBank公布UL30(EF554403)基因序列,设计了1对特异性引物,建立了1种特异、敏感的DPV检测方法,旨在为DPV的早期诊断、流行病学调查等提供1种有效的分子生物学检测方法。
1 材料和方法
1.1 病毒株与病料
鸭瘟病毒、鸭细小病毒、鸭圆环病毒、小鹅瘟病毒、鸭肝炎病毒、鸭H9亚型禽流感病毒和鸭副黏病毒由本实验室分离、保存,临床检测病料2014年采自山东省各地鸭场临床诊断为DPV感染的鸭的肝脏、脾脏等。
1.2 工具酶及试剂盒
pMD18-T载体、限制性内切酶、PCR相关试剂、DNAMarKer,DNA凝胶回收试剂盒为大连宝生物公司产品,AxyPrep体液病毒DNA/DNA小量试剂盒为爱思进生物技术(杭州)有限公司产品。
1.3 PCR引物设计与合成
参照 GenBank中登录的 DPV 基因序列(EF554403),应用PrimerPremier5.0基因分析软件,设计1对引物,扩增DPV UL30基因部分片段510bp,引物由上海生工生物工程股份有限公司合成。上游引物:5′-CGACTACATCCATACCCACT-3′,下游引物:5′-TATGCTTCAGCTAGAGTA-3′。
1.4 病毒基因组DNA的提取
按AxyPrep体液病毒DNA/DNA小量试剂盒使用说明书提取DPV的DNA,并提取其他几种病毒的核酸。
1.5 DPVUL30基因的PCR扩增及条件优化
以DNA为模板进行PCR扩增,反应体系为25μL。各参数为95℃预变性5min,然后进入95℃30s、47℃30s,72℃30min循环,共35个循环,最后72℃延伸10min。取3μL产物,1%琼脂糖凝胶电泳,紫外成像。同时对各扩增条件进行优化,包括退火温度(43~53℃梯度温度,每2℃为1个梯度)、引物浓度(0.2~1.2μmol/L,每0.2μmol/L为1个梯度)等,反应体系均为25μL。
1.6 PCR扩增产物的检测及鉴定
首先取扩增产物3μL在1%的琼脂糖凝胶上电泳,利用凝胶成像系统扫描进行初步鉴定。然后用DNA凝胶回收试剂盒回收目的片段。将目的片段与pMD18-T克隆载体于16℃连接过夜,转化DH5α 感受态。挑取单个的转化菌落,加LB溶液,37℃培养16h,用质粒提取试剂盒抽提质粒DNA用PCR方法进行鉴定,将阳性克隆送上海生工生物工程股份有限公司进行测序鉴定。将测序结果与参照的DPV序列同源性比较。
1.7 特异性试验
分别提取鸭细小病毒、鸭圆环病毒、小鹅瘟病毒、鸭肝炎病毒、鸭源H9亚型禽流感病毒和鸭副黏病毒的核酸,用已建立的方法进行扩增。
1.8 敏感性试验
提取DPV病毒DNA后定量,然后10倍梯度稀释提取的病毒基因组DNA,使其分别相当于含有10ngDNA、1ngDNA、100pgDNA、10pgDNA、1pgDNA和0.1pgDNA的含量,分别进行PCR检测,确定其敏感性。
1.9 重复性试验
用建立的PCR检测方法对鸭细小病毒、鸭圆环病毒、小鹅瘟病毒、鸭肝炎病毒、鸭H9亚型禽流感病毒、鸭副黏病毒、鸭瘟3份阳性病料及3份阴性病料,重复检测3次,以验证本方法的重复性和稳定性。
1.10 临床样品的检测
取疑似送检病料15份,利用建立的PCR方法进行检测,对扩增产物全部进行测序鉴定,并利用生物学软件BLAST进行序列分析。
2 结果与分析
2.1 扩增产物的检测
PCR扩增产物经过1%琼脂糖凝胶电泳,扩增产物在510bp处可见特异性DNA扩增条带,与预期大小相符(图1)。
2.2 特异性试验
利用所设计的引物及所确定的最佳反应条件分别对鸭瘟病毒、鸭细小病毒、鸭圆环病毒、小鹅瘟病毒、鸭肝炎病毒、鸭源H9亚型禽流感病毒和鸭副黏病毒分别进行PCR扩增。结果7个毒株中只有鸭瘟病毒能扩增出相应的片段,大小为510bp,而其他均未扩增出相应的片段(图2)。说明本研究建立的方法特异性好。
2.3 敏感性试验
取3μLPCR产物经1%琼脂糖凝胶电泳分析,分别在约510bp附近出现特异性条带,与预期产物大小相符。从结果可以看出,引物的PCR检测灵敏度可以达到1pgDNA(图3)。
2.4 重复性试验
经过3 次重复操作,结果一致,说明建立的方法是稳定、可靠的。
2.5 临床样品的检测
用建立的DPVPCR检测方法,共检测了15份在不同地方采集的鸭病料,检出阳性样品3份。
3 讨论
传统DPV诊断方法,如病毒分离鉴定、酶联免疫吸附和琼扩试验方法,操作繁琐,操作耗时长,重复性不好,限制了传统方法在实际中的应用。PCR检测方法具有检测速度快、敏感高和特异好等优势,能在数小时内检出病原。因此,建立1种快速、简单和敏感的DPVPCR检测方法十分必要。
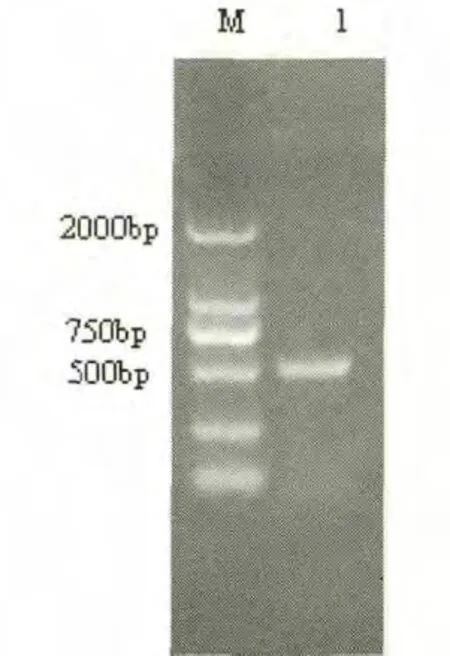
图1PEDV扩增结果

图2 特异性试验
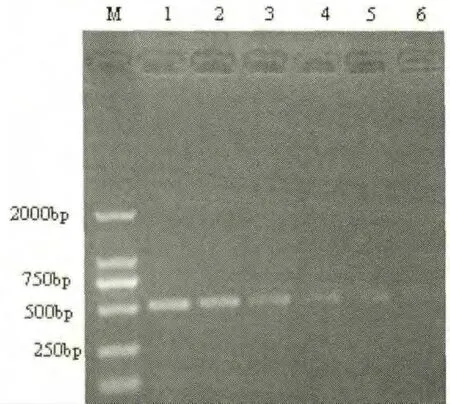
图3 敏感性试验
本试验对GenBank公布的DPV基因序列进行比对,发现DPVUL30基因相对比较保守,查找出其高度保守区域,参照GenBank中登录的DPV基因序列(EF554403)利用PrimerPremier5.0设计1对引物,通过PCR扩增出目的基因,连接到pMD18-T载体,送样测序,对测序结果与模板序列进行比对,其同源性为100%,对退火温度优化,发现只有当退火温度值为47℃时,才能获得较为理想的产物,即使相差2℃也不能获得理想的试验结果。对引物浓度进行优化,在引物浓度为0.2~1.2μmol/L对PCR扩增效率的影响不大,在0.6μmol/L时扩增效率相对较高,而在1.2μmol/L时扩增效率相对较差。敏感性试验结果显示,引物的检测灵敏度可以达到1pgDNA。特异性试验结果显示,本试验所建立的PCR检测DPV的方法能够扩增出510bp目的片段,而对常见的鸭病病毒如鸭细小病毒、鸭圆环病毒、小鹅瘟病毒、鸭肝炎病毒、鸭源H9亚型禽流感病毒和鸭副黏病毒均无扩增产物,证明本方法具有很好的特异性。用建立的DPVPCR检测方法,共检测了15份在不同地方采集的鸭病料,检出阳性样品3份。因此,本试验所建立的方法为DPV的诊断、流行病学调查等提供了1种简单、快速的分子诊断方法。
[1]殷震,刘景华.动物病毒学(第二版)[M].北京:科学出版社,1997.
[2]PlummerPJ,AlefantisT,KaplanS,eta1.Detection ofenteritisvirusbypolymerasechainreaction[J].Avian Diseases,1998,42:554-564.
[3]甘孟侯.中国禽病学[M].北京:中国农业出版社,1999,109-119.
[4]岳华,汤承,余勇,等.禽病临床诊断彩色图谱[M].成都:四川科技出版社,2002.
[5]BaudetA E R F.Mortality in ducksin the Netherlandscausedbyafiltrablevirus;fowlplague[J].TijdschrDiergeneeskd,1923,(50):455-459.
- 养禽与禽病防治的其它文章
- 温差对肉鸡养殖的影
- 种蛋保存和消毒的技术要点

