选择性培养基结合特异引物法分离鉴定家兔肠道脆弱拟杆菌*
张煜坤,张晓霄,徐秀容*
(1.西北农林科技大学 动物科技学院,陕西 杨凌712100;2. 鹿儿岛大学农学部,日本 鹿儿岛890-0065)
选择性培养基结合特异引物法分离鉴定家兔肠道脆弱拟杆菌*
张煜坤1,张晓霄2,徐秀容1*
(1.西北农林科技大学 动物科技学院,陕西 杨凌712100;2. 鹿儿岛大学农学部,日本 鹿儿岛890-0065)
脆弱拟杆菌作为严格厌氧菌,对培养环境要求苛刻,分离培养有较大难度。试验通过改进的选择性培养结合特异引物方法分离兔源脆弱拟杆菌,并利用16 s rDNA测序对其进行鉴定,为后续研究其与宿主关系奠定基础。试验从健康青年家兔肠道中采集内容物,先接种于含液态选择性培养基的厌氧管中,进行富集培养1~2 d,然后将培养的菌液稀释后接种到选择性培养基平板上,于厌氧罐中培养1~3 d,待长出菌落后,观察菌落形态,挑选符合脆弱拟杆菌菌落特点的单一菌落,培养后提取DNA,以脆弱拟杆菌特异引物进行PCR检测。对扩增出特异条带的菌株,扩增其16 s rDNA序列,并进行测序,测序结果与GenBank中脆弱拟杆菌序列进行比对,以鉴定分离的菌株。结果表明,细菌为大小不一的杆菌,革兰氏染色呈阴性。特异引物PCR产物电泳检测显示,挑取的27株单一菌落中,有7株可以扩增出符合目的片段大小的产物。随机选取两株进行16s rDNA测序,其序列与GenBank中的递交的脆弱拟杆菌序列相似度大于99%,与其他细菌相似度均小于93.43%,可确定分离到的菌株为脆弱拟杆菌。
家兔;脆弱拟杆菌;分离;鉴定
腹泻是威胁家兔健康的主要疾病,尤其是断奶仔兔,养殖中60%~70%的健康问题是由腹泻引起,而且腹泻引起的死亡可高达80%。目前,由于使用抗生素带来的食品安全和抗药性等问题,使人们越来越关注抗生素替代品的研究和应用,这些替代品包括各种益生菌。与猪和鸡等其他单胃动物不同,家兔肠道中优势菌为拟杆菌,乳酸菌数量很少,而且没有检测到双歧杆菌[1-2]。脆弱拟杆菌对人和大多数动物是一种常见的厌氧病原体[3-5],但作为家兔肠道尤其是盲肠中的主要优势菌,对家兔盲肠发酵及肠道免疫系统发育等可能起着重要的作用,分离兔源脆弱拟杆菌将为这些基础研究创造条件,继而为开发家兔特异益生菌研究提供理论依据。脆弱拟杆菌为严格厌氧菌,通过焦性没食子酸降低干燥器内氧分压改进简易厌氧装置,为无厌氧设备的实验室进行严格厌氧菌的培养创造条件。目前特定菌种的分离多采用传统的选择性培养基方法,然后通过生化形态鉴定其种属,但传统的鉴定方法不仅过程繁琐,而且准确性较差,近年来分子技术在细菌分类上的应用研究结果显示,菌落形态和生化反应相同的细菌可能属于不同的菌种。利用选择性培养基方法结合特异引物PCR方法,可以更快速更准确地分离目的菌种。James等[6]筛选出脆弱拟杆菌的选择性培养基,并用此培养基分离到脆弱拟杆菌。尽管在该培养基中添加了庆大霉素及促拟杆菌生长的成分,提高了脆弱拟杆菌的检出率,但分离出的菌株并非都是脆弱拟杆菌。Joseph等[7]根据脆弱拟杆菌的Leu基因设计了脆弱拟杆菌的特异性引物,利用该引物进行荧光定量PCR,对肠道中脆弱拟杆菌进行定量分析,定量结果均与实际结果一致,可以准确的分析出样品中脆弱拟杆菌的数量。目前该特异引物主要用于检测粪便[8-11]及水体污染[12-14]样品中脆弱拟杆菌的数量,还没有将其用于脆弱拟杆菌分离鉴定的研究报道。由于脆弱拟杆菌严格厌氧,因此从动物肠道中分离该菌以及通过生化培养鉴定都比较困难,尤其在无特定厌氧装置的情况下。因此本研究设计出快捷的分离和鉴定兔源脆弱拟杆菌的方法,为脆弱拟杆菌在家兔肠道中的功能研究以及家兔特异益生菌开发等提供基础。
1 材料与方法
1.1 简易厌氧罐
本试验采用干燥器法。该方法造价低,操作较方便,密封性较好。利用焦性没食子酸和氢氧化钠反应消耗氧气的特点,快速创造厌氧环境。厌氧环境的创造方法:计算干燥器体积,根据其体积(1 000 mL空间用焦性没食子酸10 g,用10%氢氧化钠溶液100 mL)称取焦性没食子酸和配制氢氧化钠溶液;然后将氢氧化钠溶液倒人干燥器底部,盛有焦性没食子酸的平皿轻轻浮于液面之上,放好隔板,将接种好的平板置于隔板上,并在隔板上点燃一支蜡烛,把干燥器盖盖上密封。轻轻摇动干燥器,使焦性没食子酸和氢氧化钠溶液混合并反应,待蜡烛熄灭后置于37 ℃培养箱。
1.2 试验用选择性培养基制备与养分优化
选择性培养基需促进脆弱拟杆菌生长繁殖并抑制其他菌的生长,本研究采用的FRAG选择性培养基是根据James等[6]试验配方进行养分优化。优化方法是增加血红素、维生素K和吐温80以促进脆弱拟杆菌生长;脆弱拟杆菌抗庆大霉素、耐胆盐,添加庆大霉素抑制非抗性菌,加入胆盐抑制不耐胆盐的微生物生长。
1.3 选择性培养基的厌氧优化
按文献[15]所示方法选择培养基进行厌氧优化处理:(1) 添加0.05%~0.1%的琼脂(可减少分子氧的溶解,维持氧化还原电势(Eh));(2)添加0.5% L-半胱氨酸盐酸盐、0.5~1.0%葡萄糖和硫酸亚铁溶液等还原剂以降低氧分压;(3)培养基煮沸10~15 min以去除较多溶解氧。FRAG 选择性培养基组成与配制:准确称量表1各种成分(庆大霉素待灭菌后冷却至约55 ℃再加入),补水至100 mL,用 l mol/L 的NaOH溶液调整pH至7.2~7.4。配制好培养基后转入厌氧管,并根据厌氧管大小通入足够无氧氮气,然后在121 ℃下灭菌20 min。灭菌后在液体培养基上加1~2 cm厚的液体石蜡,密封备用。固体选择培养基:在液体培养基基础上每100 mL中加1.5 g琼脂,灭菌后在厌氧罐中冷却至55 ℃加入庆大霉素,充分混匀后铺平板。平板快速放入厌氧罐中冷却凝固备用。
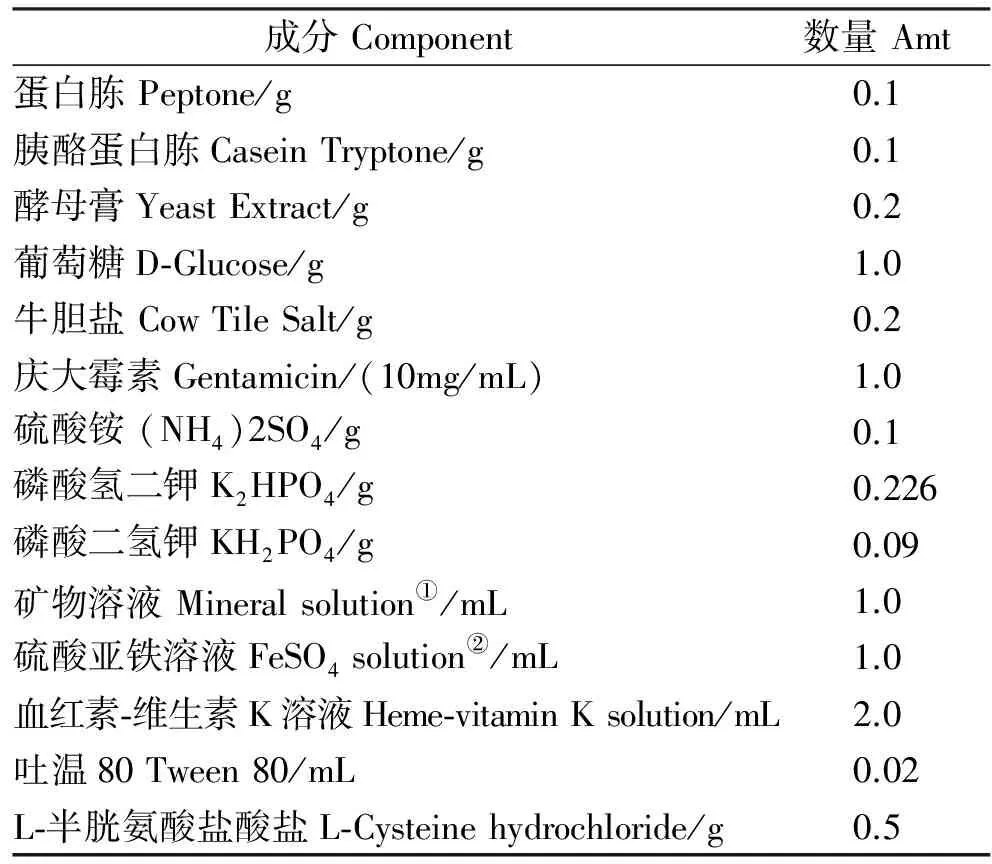
表1 FRAG 培养基组成
注:①100 mL水中加下列成分配成矿物溶液: NaCl, 9.0 g; CaCl2.2H2O, 0.27 g;MgCl2.6H20, 0.2 g; MnCl2.4H20, 0.1 g; and CoCl2.6H20,0.1 g。此溶液4 ℃保存。②100 mL水中加0.04 g FeS04.7H20配成硫酸亚铁溶液,4 ℃保存。
Notes:①The mineral solution contained the following in 100 ml of water: NaCl, 9.0 g; CaCl2.2H2O, 0.27 g;MgCl2.6H20, 0.2 g; MnCl2.4H20, 0.1 g; and CoCl2.6H20,0.1 g. This solution was stored at 4 ℃. ②The FeSO4solution contained 0.04 g of FeS04.7H20 in 100 ml of water and was stored at 4 ℃.
1.4 试验动物
健康的青年家兔3只,供采集肠道内容物。14日龄和30日龄(断奶)健康仔兔各30 只,供毒性检测试验。
1.5 试验方法
1.5.1 样品采集及细菌培养 试验兔耳缘静脉注射空气处死,迅速打开腹腔,分离结扎各个肠段,无菌操作,迅速采集盲肠内容物。
无菌条件下将采集的内容物迅速接种到厌氧管底部,37 ℃恒温培养1~2 d,再将培养的菌液梯度稀释,接种到含固态选择培养基的平板上,在厌氧罐中37 ℃恒温培养2~3 d。
1.5.2 菌落观察与挑纯 待长出菌落后,观察各平板上菌落生长的形态,结合镜检,筛选出优势菌株,进一步对优势菌株进行分离纯化,以保证分离到单一菌株。
1.5.3 菌株的鉴定 对所分离的优势菌株,挑取菌落进行革兰氏染色,镜检。
特异引物法鉴定:将镜检符合脆弱拟杆菌的菌落在液态培养基中进行培养并提取DNA,以脆弱拟杆菌的特异引物Leu-f/ Leu-r(CACTTGACTGTTGTAGATAAAGC/CATCTTCATTGCAGCAT TATCC)[7](目的片段为135 bp)进行PCR,对PCR产物进行电泳检测。
16S rDNA测序进一步鉴定:随机选取2株经特异引物鉴定为阳性的菌株提取细菌DNA,用16S rDNA通用引物Eubac 27F/Eubac 1492R(AGAGTTTGATCCTGGCTCAG/CGGTTACCT TGTTACGACTT)[19]进行PCR扩增并进行测序。将测序结果用NCBI中的BLAST软件与GenBank中的16srDNA序列进行比对分析。
1.5.4 分离菌株对家兔毒性试验 将保存菌液活化培养后,充分混匀,取0.1 mL分别接种于含5.0 mL厌氧菌培养基的厌氧管中,37 ℃恒温培养。利用细胞计数板测定菌液浓度,然后测定不同浓度菌液的OD值,利用菌液OD值与菌液浓度关系计算细菌含量。
选择无疫情、饮水无病原菌污染的阴性兔场。随机选取14日龄和30日龄(断奶)体况相近健康仔兔各30 只,分别随机分为A、B、C 3组。试验期为10 d,饲料中不添加抗生素及微生态制剂,每天11∶00~11∶30灌服菌液。A组灌服无菌培养基,B组灌服含1×108脆弱拟杆菌菌液,C组灌服2×108脆弱拟杆菌菌液。观察各组幼兔粪便的变化及临床反应,记录健康和死亡情况;称重,记录体重变化。
2 结 果
2.1 选择性培养基分离与形态鉴定
稀释的内容物接种在液体选择性培养基中培养12 h可见厌氧管底部有少量浑浊,24 h浑浊度明显增加。将该菌液稀释接种于固体平板选择性培养基12 h后可见到菌落长出,24~36 h可挑单一菌落。
从图1可看出,通过严格厌氧和优化培养基培养出的细菌,革兰氏染色呈阴性,菌体为长短不一的多形性的杆菌,与脆弱拟杆菌相似。
2.2 特异引物扩增分析
从图2可以看出,以脆弱拟杆菌特异引物Leu-f/ Leu-r为引物,以提取的细菌DNA为模板进行PCR,27个菌落中有7个菌落获得了大于100 bp小于250 bp的单一特异条带,与目的片段(135 bp)长度相符。
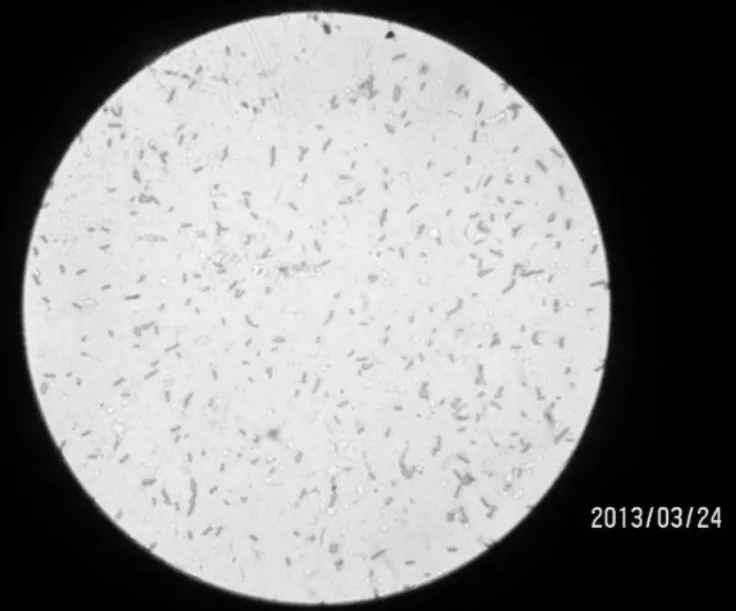
图1 细菌革兰氏染色 (×1000)

图2 细菌DNA PCR产物电泳图像
2.3 16S rDNA测序鉴定
经过活力筛选后,选出两株活力最强的菌株进行测序。测序结果见GenBank (登录号KF706546,KF727478)。序列比对分析结果(表2)显示,被鉴定菌株的16S rDNA序列与GenBank中的已有脆弱拟杆菌16S rDNA序列相似性大于99%,而与最相近的非脆弱拟杆菌16S rDNA序列相似性小于93.43%,可确定所分离的菌株为脆弱拟杆菌。
2.4 毒性检测结果
分别从14日龄和30日龄开始灌服的各组幼兔粪便无异常、采食正常、精神良好,各处理组均没有病变和死亡仔兔。14~24日龄和30~40日龄各处理组间ADG差异均不显著(P<0.05)。
3 讨 论
3.1 培养条件的控制
脆弱拟杆菌为中度厌氧菌,可在2%~8%氧分压(平均3%)下生长,在空气中暴露60~90 min会死亡[15],因此脆弱拟杆菌的培养以快速取样和严格厌氧为核心。首先是创造厌氧培养环境。专业的厌氧培养箱或者工作站价格昂贵,操作与维护复杂,在分析了所培养厌氧菌的要求后设计的简易培养罐适合小型实验室及野外采样等少量培养。焦性没食子酸和氢氧化钠溶液反应后可吸收大量氧气,加上蜡烛的燃烧耗氧,可使罐内氧分压达到脆弱拟杆菌的生长要求。其次,需优化选择性培养基养分。脆弱拟杆菌抗庆大霉素,添加庆大霉素可抑制非抗性菌生长;脆弱拟杆菌耐胆盐,培养基中加入20%胆汁或2 g/L 胆盐可促进本菌生长,抑制不耐胆盐的微生物;本试验还添加了0.02%吐温80,增加了维生素K、氯化血红素促进其生长。选择性培养基的厌氧优化也是促进脆弱拟杆菌生长繁殖的关键。培养基煮沸可去除较多溶解氧,煮沸10~15 min可使Eh降低至10~100 mV;添加0.5%L-半胱氨酸盐酸盐、0.5~1.0%葡萄糖等还原剂及硫酸亚铁溶液可降低Eh;添加0.05%~0.1%的琼脂可减少分子氧的溶解,维持Eh;接种时接种在培养基底部有利于厌氧菌生长;在液体培养基上加1~2 cm厚的液体石蜡隔绝氧的溶解;配制好培养基后转入厌氧管,通入足够无氧氮气排出空气,减小氧分压,条件允许情况下接种等步骤可在氮气保护下进行。

表2 序列比对结果

表3 灌服脆弱拟杆菌对仔兔平均日增重的影响
由于液态培养基中的氧分压要低于平板培养基表面,因此平板培养分离单菌落前,先用液态选择性培养基进行培养,可提高目的菌种的数量和比例。
3.2 鉴定方法
传统的细菌鉴定方法是根据菌落形态、镜检和系列生化试验结果进行综合判断,鉴定过程繁琐,而且随着分子生物学技术在细菌鉴定上的应用发现,具有相同菌落形态、镜检结果和生化反应的细菌,可能不属于同一种细菌,这说明传统鉴定方法存在局限性。由于细菌16s rDNA序列中的可变区域变异速度较快,不同菌种间往往存在差异,因此16srDNA序列测定方法成为鉴定细菌菌种的重要方法。本研究在镜检基础上,先利用经过验证的脆弱拟杆菌特异引物进行PCR检测,然后对能够扩增出特异片段的菌株进行16srDNA序列测定,可快速筛选出目的菌种。
在本研究中用脆弱拟杆菌选择性培养基培养出来的、具有脆弱拟杆菌菌落特点和镜检特点的27个菌株中只有7个菌株属于脆弱拟杆菌。这说明,相关研究推荐的脆弱拟杆菌选择性培养基分离到的细菌并非为单一的脆弱拟杆菌。
4 结 论
简易厌氧罐和厌氧管在严格的厌氧控制下可有效培养拟杆菌类厌氧菌。优化的选择培养基可降低氧化还原电势,促进厌氧菌生长,但该选择性培养基并非为脆弱拟杆菌的专一性培养基,而脆弱拟杆菌特异引物PCR方法可以排除其中非脆弱拟杆菌;16s rDNA序列测序结果可鉴定本试验分离到的脆弱拟杆菌。本试验分离的脆弱拟杆菌菌株对家兔无致病致死等毒副作用,且对家兔日增重无影响。
[1] Gouet P,Fonty G.Changes in the digestive microflora of holoxenic rabbits from birth until adulthood[J].Annales de Biologie Animale Biochimie Biophysique,1979,19:553-566.
[2] Boulahrouf A,Fonty G,Gouet P.Establishment,counts, and identification of the fibrolytic bacteria in the digestive tract of rabbit-Influence of feed cellulose content[J].Current Microbiology,1991,22:1-25.
[3] Duerden B.Virulence factors in anaerobes [J].Clinical Infectious Diseases,1994,18(S4): 253-259.
[4] Falagas M,Siakavellas E.Bacteroides,prevotella,and porphyromonas species:a review of antibiotic resistance and therapeutic options [J].International Journal of Antimicrobial Agents,2000,15:1-9.
[5] Jousimies-Somer H, Summanen P, Citron D, et al.Wadsworth-KTL anaerobic bacteriology manual[M].6th ed. Belmont, CA:Star Publishing Company, 2002.
[6] James M,Busch E,Blazevic D.Medium for selective isolation and presumptive identification of the Bacteroides fragilis group[J].Journal of Clinical Microbiology,1982,15(1):123-129.
[7] Joseph P,Victoria M.Comparative evaluation of conventional and real-time PCR assays for detecting bacteroides fragilis in clinical samples[J].Journal of Clinical Microbiology.2013, 51(5):1 593-1 595.
[8] Merino V,Nakano V,Liu C,et al.Quantitative detection of enterotoxigenic Bacteroides fragilis subtypes isolated from children with and without diarrhea [J].Journal of Clinical Microbiology, 2011,49:416-418.
[9] Akpmar M,AktaE,Cömert F, et al.Evaluation of the prevalence of enterotoxigenic Bacteroides fragilis and the distribution bft gene subtypes in patients with diarrhea[J].Anaerobe,2010,16:505-509.
[10] Durmaz B,Dalgalar M,Durmaz R.Prevalence of enterotoxigenic Bacteroides fragilis in patients with diarrhea: a controlled study [J].Anaerobe,2005,11:318-321.
[11] Zhang G,Svenungsson B,Kärnell A,et al.Prevalence of enterotoxigenic Bacteroides fragilis in adult patients with diarrhea and healthy controls [J].Clinical Infectious Diseases, 1999,29:590-594.
[12] Lee C,Lee J.Evaluation of new gyrB-based real-time PCR system for the detection of B. fragilis as an indicator of human-specific fecal contamination[J].Journal of Microbiological Methods, 2010, 82:311-318.
[13] Lee C,Marion J,Lee J.A novel genetic marker for the rapid detection of Bacteroides fragilis in recreational water as a human-specific faecal indicator[J].Journal of Water and Health,2011,9:253-264.
[14] Siefring S,Varma M,Atikovic E, et al.Improved real-time PCR assays for the detection of fecal indicator bacteria in surface waters with different instrument and reagent systems[J].Journal of Water and Health,2008,6:225-237.
[15] 丛玉龙.医家金鉴-检验医学卷(下册)[M].北京:军事医学科学出版社,2007.
[16] 农业部厌氧微生物重点开放实验室《产甲烷细菌及研究方法》编著组. 产甲烷细菌及研究方法[M].成都:成都科技大学出版社, 1999.
[17] 闵 航.厌氧微生物学[M].浙江:浙江大学出版社,1993.
[18] 中国科学院微生物所《菌种保藏手册》编著组.菌种保藏手册[M].北京:科学出版社,1980.
[19] Claudia M,Jaime R,Romilio T.Polymorphism in repeated 16S rRNA genes is a common property of type strains and environmental isolates of the genus Vibrio[J]. Microbiology, 2002, 148: 1233-1239.
Isolation and Identification of Rabbit IntestinalBacteroidesFragilisby Selective Medium Combining with Specific Primers
ZHANG Yu-kun1,ZHANG Xiao-xiao2,XU Xiu-rong1*
(1.CollegeofAnimalScienceandTechnology,NorthwestA&FUniversity,Yangling,Shaanxi712100,China; 2.FacultyofAgriculture.KagoshimaUniversity,Kagoshima890-0065,Japan)
As a strictly anaerobic acterium,Bacteroidesfragiliswas difficult to isolate and cultivate because of the strict growing condition. This experiment was conducted to isolate and identify rabbit originalBacteroidesfragilisby combining specific culture medium and molecular techniques. The isolated rabbit originalBacteroidesfragiliswill provide the material to further research on the relationships between bacteria and its host. The intestinal content was collected from healthy young rabbit and inoculated to the liquid selective medium in anaerobic tube, and cultured for 1-2 days. Subsequently, the cultured bacteria were inoculated to the plate culture medium and cultured for 1-3 days in a simple anaerobic jar. After colonies were formed, 27 colonies were picked out from it, and then one part of each colony was used for preservation and the remaining was cultured to extract genomic DNA for PCR detection usingBacteroidesfragilisspecific primers. Finally, 16s rDNA sequences of the PCR-positive colonies were cloned using universal primers and sequenced. There were 7 strains withBacteroidesfragilisspecific bands when detecting the PCR products. Aligning the 16s rDNA sequence of these strains with the database in GenBank showed that it has more than 99 % similarity with the 16s rDNA sequence ofBacteroidesfragilisin GenBank and the highest similarity with other bacteria is 93.43%.
rabbits;Bacteroidesfragilis; isolation; identification
2014-10-09,
2014-11-28 [基金项目] 陕西省科技攻关项目(2013K02-18);西北农林科技大学基本科研业务费专项资金项目(QN2011061)
张煜坤(1989-),男,河北张家口人,硕士,主要从事动物肠道微生物与免疫营养研究。E-mail:zhangyukun672@163.com
*[通讯作者] 徐秀容(1969-),女,湖北英山人,副教授,硕士生导师。E-mail:xuxiurong@yahoo.com
S811.6
A
1005-5228(2015)03-0058-05

