一种基于感光干膜-铟锡氧化物电极的简易细胞阻抗传感器实现细胞形态学和阻抗信息同时检测*
李 远,胡 帆,廖 娟,胡礼仪,刘北忠
重庆医科大学附属永川医院中心实验室
一种基于感光干膜-铟锡氧化物电极的简易细胞阻抗传感器实现细胞形态学和阻抗信息同时检测*
李 远,胡 帆,廖 娟,胡礼仪,刘北忠*
重庆医科大学附属永川医院中心实验室
加工一种基于感光干膜-铟锡氧化物DFP-ITO(Dry Film Photoresist-Indium Tin Oxide)电极的细胞阻抗生物传感器并实现细胞形态学和阻抗信息同时检测。35 μm厚的感光干膜层压在ITO导电玻璃表面上作为绝缘层,通过照相制版技术在感光干膜绝缘层上蚀刻不同直径圆孔;以DFP-ITO作为工作电极,通过夹具和测量小池与Ag/AgCl参比电极、Pt丝对电极相连构成三电极阻抗测量系统;考察了不同直径DFP-ITO工作电极阻抗谱特征;通过细胞粘附实验及细胞毒性实验考察了感光干膜细胞生物相容性;通过光学显微镜和阻抗谱技术分别对接种在DFP-ITO电极上人肺癌细胞株A549粘附、增殖过程中的形态学和阻抗信息进行检测和分析。研究结果发现不同直径DFP-ITO电极具有相似的阻抗特性;充分固化的感光干膜表面适宜A549细胞粘附且无明显的细胞毒性;基于DFP-ITO电极构建的细胞阻抗传感器能够通过光学显微镜获取A549细胞形态学数据,同时通过阻抗谱技术能够解析A549细胞粘附、增殖过程中的细胞质膜电容、细胞-细胞间隙电阻、细胞-ITO电极间隙电阻变化。本文发展了基于DEP-ITO电极的细胞阻抗传感器结构简单,可实现细胞形态学和阻抗信息的双通道获取,未来可用于细胞生理病理学行为和药物细胞毒性研究。
生物传感器;电化学阻抗检测;感光干膜;铟锡氧化物;阻抗;细胞形态学
细胞阻抗传感器作为一种具有连续性、无侵袭性特点的体外细胞分析技术能够对细胞粘附、增殖、凋亡等生物学行为进行检测[1-3],在药物筛选[4]、毒物测试[5]、细胞生理参数分析[6]等领域中得到广泛研究及应用。细胞阻抗传感器技术最先由Giaever和Keese等报道[7],该技术构建的细胞阻抗生物传感器由一对金材质的双电极系统构建,包括一个面积为250μm直径的工作电极和一个大面积的对电极。当细胞在电极表面发生形态学改变时,细胞作为具有频率依赖性的电学元件,它的存在导致系统的阻抗谱发生改变,通过对系统阻抗谱进行解析来获取细胞对应的生物学行为,该技术被称为电子细胞-基底阻抗传感技术ECIS(Electric Cell-Substrate Impedance Sensing)。尽管基于ECIS技术的细胞阻抗传感器具有测量细胞-细胞粘附、细胞-基质粘附、细胞膜性质等功能而被广泛报道[8-9],然而以贵金属金作为电极材料,不但成本高,而且透光性差,限制了基于光学手段的细胞形态学观察。
铟锡氧化物(ITO)是一种具有良好透光性、生物相容性的导电材料,因此可作为一种电极材料构建各种细胞生物传感器[10-12]。ITO导电膜通过平面磁控技术溅射在玻璃表面,具有表面电阻均匀、良好透光率和热稳定性,市场上可获得不同导电率的商品化ITO导电玻璃。ITO能够在中性电解质溶液中保持电势稳定性,因此可作为电极材料检测培养环境中的细胞的电学特性,同时ITO电极材料良好的透光性能与光学显微镜集成,通过数字图像技术获取ITO电极上细胞的形态学信息[13]。此外,Gross等[14]将聚硅氧烷树脂涂覆的ITO微电极用于记录神经元细胞峰电位;CHoi C K等[11]通过光刻技术和反应离子蚀刻技术加工了光学透明的ITO氮化硅电极作为内皮细胞阻抗生物传感器。研究发现ITO电极材料比金电极具有更优的透光性,能够检测细胞松弛素D对猪肺动脉内皮细胞的响应行为。尽管上述研究报道了ITO电极材料在细胞阻抗生物传感器的应用价值,但ITO电极加工需依赖昂贵的溅射和光刻设备,且工艺复杂,限制了ITO电极在细胞阻抗生物传感器的制备及推广。
感光干膜作为一种光聚合物材料主要应用于印刷电路板工艺。相对于液体光刻胶,感光干膜具有诸多优势,如良好的适应性,基材粘附性、平整性、感光材料均匀分布性、低曝光功耗及低成本[15]。更为重要的是,感光干膜光刻不需要超洁净空间和昂贵的光刻设备,作为液态光刻胶的替代物还可应用在微流体通道加工[16]、电铸模具[17]等。
本文提出了一种基于感光干膜的ITO电极加工工艺,并将制备的感光干膜-ITO(DFP-ITO)电极作为细胞阻抗传感器以实现细胞形态学和阻抗信息的双通道获取。为此,首先表征了不同直径的DFP-ITO电极阻抗特征,其次通过细胞粘附实验及细胞毒性实验对感光干膜细胞生物相容性进行评价;在此基础上,通过光学显微镜和电化学阻抗谱技术分别获取了DFP-ITO电极表面上人肺癌细胞株A549粘附和增殖过程中细胞形态学和阻抗信息。
1 方法和材料
1.1 感光干膜ITO电极加工
ITO导电玻璃购于珠海凯为光电科技有限公司(中国),ITO导电膜厚(220±30)nm,面电阻≤7 Ω/m2,玻璃基底厚度为1.1 mm。ITO导电玻璃分别用丙酮、无水乙醇、去离子水超声清洗15 min,烘干待用。感光干膜型号为HQ-6100,购于长兴化学工业股份有限公司,感光层厚度为35 μm,是一种低成本负性光刻胶。DFP-ITO电极加工流程示意如图1所示:①感光干膜通过办公覆膜机(100 ℃)压贴在导电玻璃ITO膜表面,目测感光干膜与ITO膜紧密贴附且两者间无气泡;②矢量图绘制软件Coreldraw 12.0(Corel公司,Canada)绘制出ITO电极和引线接口图案,通过喷墨打印机打印(ESPON 1390,Japan)以2 880 dpi分辨率打印在透明胶片上制成光掩膜,透过光掩膜对感光干膜进行紫外照射30 s;③将照射后的感光干膜在30 ℃下用1%的碳酸钠显影5 min,使未经紫外照射的ITO区域暴露,获得DFP-ITO电极。随后将电极用去离子水冲洗2次,60 ℃烘干,紫外照射60 s使感光胶完全固化。
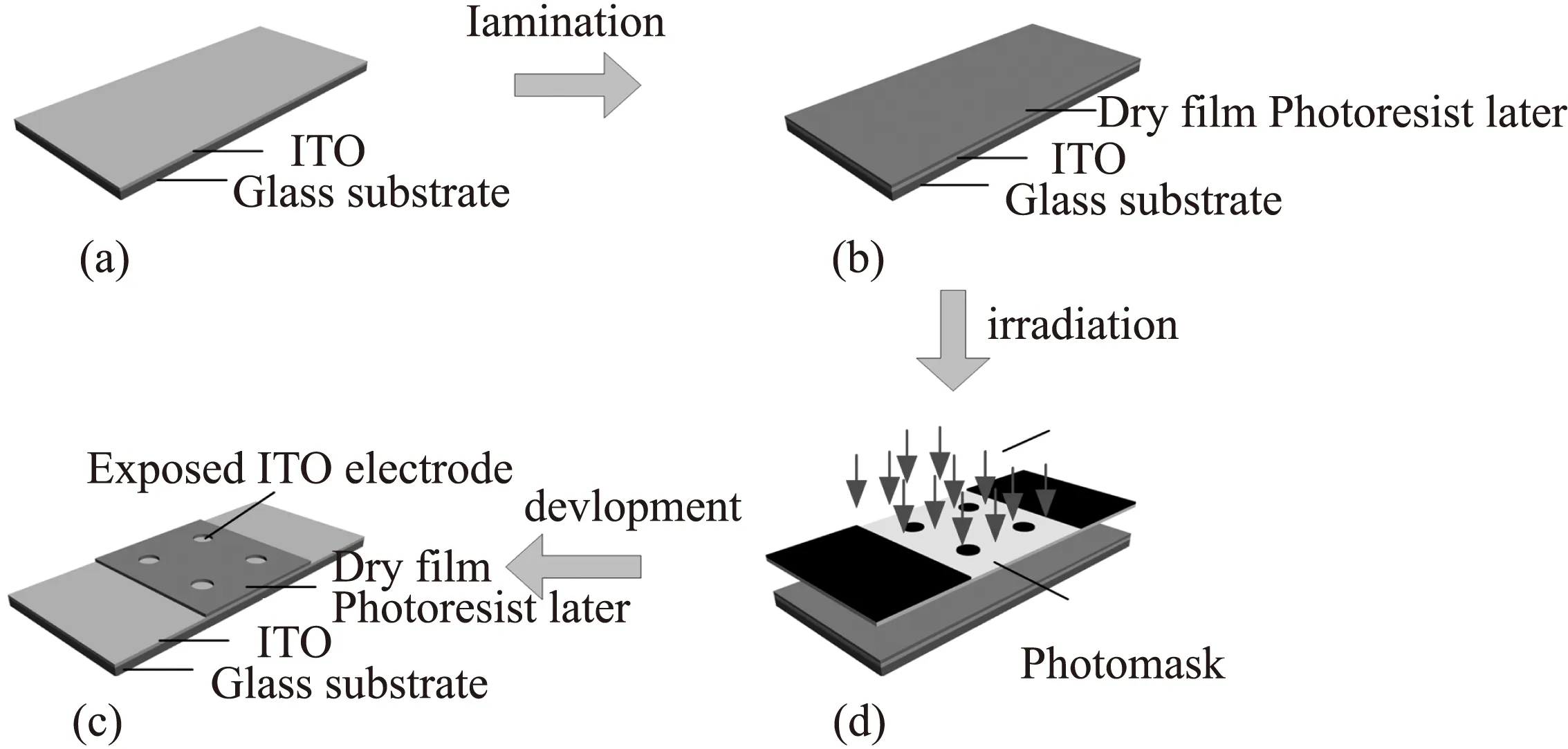
图1 DFP-ITO电极加工流程示意图
1.2 A549细胞培养
人肺癌上皮细胞A549由重庆医科大学附属永川医院中心实验室常规培养。细胞用含10%胎牛血清(杭州四季青)、100 U/mL青霉素和100 μg/mL链霉素的DMEM培养液(Gibco)中在37 ℃,5%二氧化碳条件下进行培养。待细胞生长至对数生长期,0.25%胰酶(含0.02% EDTA)消化细胞,1 500 rad/min离心4 min,按1∶3进行传代。本文使用的A549细胞传代次数为4至10代,使用时将A549细胞用DMEM细胞培养液制成不同浓度的细胞悬液。
1.3 感光干膜细胞相容性检测
感光干膜的细胞生物相容性采用细胞粘附实验和细胞毒性实验进行验证。细胞粘附实验流程:将感光干膜剪切为面积为8 mm×8 mm方片,按上述DFP-ITO电极加工流程对感光干膜进行紫外照射、显影处理后,放置于96孔板内,70%(v/v)浓度乙醇消毒。将100 μL A549细胞以浓度为2.5×105cells/mL接种在感光干膜表面,37 ℃、5%浓度二氧化碳条件下培养24 h使细胞贴壁,用浓度为10 μmol/L罗丹明123(Sigma)的PBS溶液对细胞线粒体进行荧光染色,倒置荧光显微镜(IX-71,奥林巴斯)观察感光干膜表面上贴壁的细胞形态学和细胞荧光图像;细胞毒性实验流程:将100 μL A549细胞以浓度为5×104cells/mL密度接种在96孔板中,细胞培养箱中孵育2 h使细胞贴壁。随后将感光干膜浸没于细胞培养液中作为实验组,同时以不含感光干膜的细胞孔为阴性对照组,只含感光干膜不含细胞的孔为空白组,每组设5个复孔,分别培养24、48和72 h后,将感光干膜从孔中取出,并在每孔中加入10 μL Cell Counting Kit-8(CCK-8)分析液(碧云天生物技术公司),轻摇混匀,37%、5%二氧化碳细胞培养箱中孵育2 h,多功能酶标仪(Varioskan,Thermo Scientific)测定溶液在450 nm的吸光度。感光干膜细胞毒性定义为:细胞毒性(%)=1-(实验组OD值-空白组OD值)/(阴性对照组OD值-空白组OD值)×100%。
1.4 DFP-ITO电极上细胞形态学和电化学阻抗谱检测
为便于细胞培养及电化学阻抗谱测量,将DFP-ITO电极和测量小池通过聚甲基丙烯酸甲酯(PMMA)夹具固定,使DFP-ITO电极置于测量小池底部,测量小池体积为500 μL。DFP-ITO电极测量小池组装示意图和实物图如图2所示。

图2 DFP-ITO电极细胞培养及电化学阻抗谱测量小池,测量小池含4个独立测量单元
在细胞加载到DFP-ITO电极前,用70%乙醇对测量小池消毒5 min,随后用灭菌去离子水清洗测量小池2次;将200 μL A549细胞悬液以浓度2.5×105cells/mL加载到含DFP-ITO电极的测量小池内,放置在超净台内室温条件下静止30 min后使细胞均匀沉降到电极表面,随后放入37 ℃,5%二氧化碳细胞培养箱中进行培养,分别在2 h、24 h、48 h后将DFP-ITO电极取出放置到倒置荧光显微镜载物台上进行细胞形态学观察和图像获取。
DFP-ITO电极上A549细胞阻抗信息通过电化学阻抗谱EIS(Electrochemical Impedance Spectroscopy)技术进行测量。电化学阻抗谱测量采用了CS315电化学工作站(武汉科斯特仪器有限公司),电化学阻抗谱测量系统采用三电极系统,以接种了细胞的DFP-ITO电极作为工作电极,将Ag/AgCl丝参比电极(直径:0.5 mm,长度:10 mm)和铂丝对电极(直径:1.0 mm,长度:10 mm)插入测量小池内进行电化学阻抗谱测量。测量以0.01 mol/L PBS作为支持电解质溶液,以幅值为10 mV正弦波为激励信号,扫描频率范围为1 Hz~105Hz,阻抗谱测量数据用ZView 2.0软件进行分析。
2 结果及讨论
2.1 DFP-ITO电极的加工及阻抗表征
在细胞阻抗传感器研究中,金电极具有优良的导电性、生物相容性而被广泛用于检测细胞粘附、增殖、肿瘤细胞间质转化、细胞对药物响应等信息[1-4,6]。其基本策略是将测量得到的阻抗数据谱数据与理论等效电路拟合来间接获取细胞信息,具有无侵入性、连续性检测的优点[18]。然而,金材料电极透光性差,限制了金材料电极上细胞形态学的观察[10-13]。而事实上,细胞的形态学数据是一类重要的细胞生物学行为信息,通过形态学数据能够获取细胞的增殖、凋亡、亚细胞微观结构、细胞蛋白表达等信息[19]。相比阻抗学数据,形态学数据更为直观、更易理解。因此,构建一种能够同时获取细胞的阻抗信息和形态学的细胞阻抗生物传感器将有助于提高生物传感器的准确性和多功能性。
ITO电极由于具有良好的导电性和透光性,因此具有作为电极材料具有实现细胞阻抗谱信息和形态学信息同时检测的潜力而被研究报道[10-13]。为实现细胞阻抗谱信息采集,需要加工ITO工作电极。加工ITO电极主要采用两类方法:一类是top-down途径,即在ITO板上通过化学刻蚀加工出ITO电极[11];另一类是bottom-up途径(approach),即在图形化的基底上通过溅射方式加工出ITO电极[12]。然而,蚀刻和溅射形成的ITO电极接触电阻较大,导致细胞阻抗传感器灵敏度降低;另外,蚀刻和溅射途径加工ITO电极采用液态光刻胶作为电极图像牺牲层,以光刻技术为基础,加工工艺、成本较高。表1为文献报道的采用ITO微电极构建细胞阻抗生物传感器涉及到的加工工艺及参数比较,可见本研究发展的以感光干膜作为绝缘层,以商品化ITO导电玻璃为基底,通过对感光干膜进行选择性紫外照射、显影获得ITO电极的方法不需要对ITO进行刻蚀,降低了工艺复杂性和ITO电极的接触电阻,且能够获得最小直径为100μm的ITO电极。

表1 ITO电极构建细胞阻抗生物传感器比较
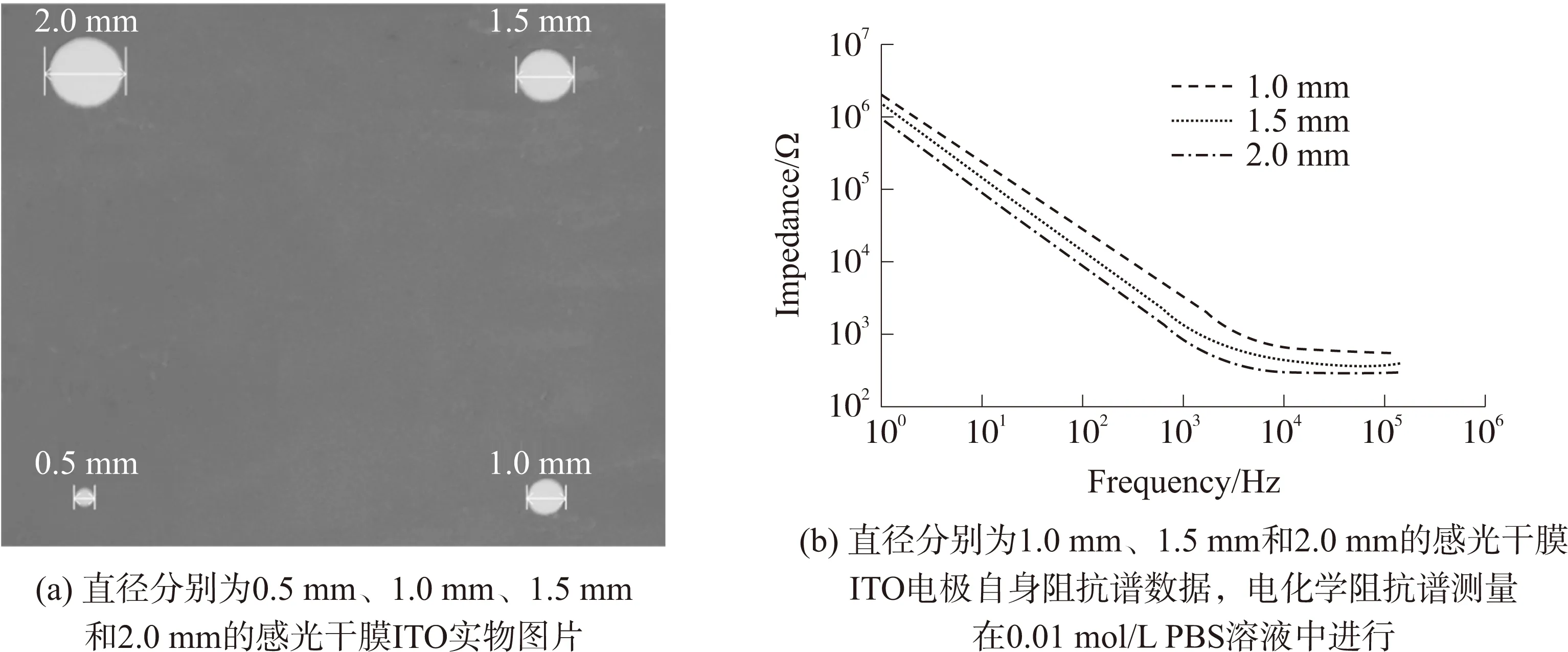
图3 不同直径DFP-ITO电极图片和阻抗谱特征
构建细胞阻抗生物传感器需要考虑一系列重要参数,其中工作电极面积是影响细胞阻抗传感器灵敏度重要参数之一[20]。本研究首先加工了0.5 mm、1.0 mm、1.5 mm和2 mm 4种不同直径的DFP-ITO电极,结果如图3(a)所示。实验发现,0.5 mm直径感光干膜ITO电极与参比电极间在支持电解质溶液中出现过高的开路电位(open circuit potential),提示0.5mm直径的DFP-ITO电极与电解质溶液接触阻抗大,推测其原因与感光干膜厚度和疏水性质有关。图3(b)为直径分别为1.0 mm、1.5 mm、2.0 mm的DFP-ITO电极阻抗谱,显示不同直径电极间的阻抗具有相似的频率依赖特性,其整个频率范围内电极阻抗值与直径成反向关系,其原因在于ITO电极与电解质溶解界面形成的电荷双分子层有关。该结果与文献报道的金电极结果相似[20-21]。当细胞在ITO电极表面粘附与铺展时,由于面积小的ITO电极对细胞形态学变化表现出更高的灵敏性[20]。因此后续细胞阻抗测量实验选择直径为1.0 mm ITO电极。
2.2 感光干膜细胞生物相容性评价
感光干膜是一种基于丙烯酸酯的光聚合物,除应用于PCB工艺中,在其他细胞生物学研究领域中也有报道,如微流控芯片[15]。然而,感光干膜的细胞生物相容性却未见报道。本研究从细胞粘附和细胞毒性考察了感光干膜细胞生物相容性,实验结果如图4所示。
图4(a)为A549细胞接种在感光干膜24 h细胞发生粘附的明场和荧光显微图片,结果显示细胞能在感光干膜粘附并铺展,罗丹明123对细胞线粒体荧光染色显示粘附在感光干膜表面A549细胞具有良好的生物活性,该结果说明感光干膜可为A549细胞提供适宜的生长界面。
图4(b)为两种不同处理的感光干膜的细胞毒性结果。实验发现,未经过后曝光步骤的感光干膜细胞毒性显著高于经过后曝光处理的感光干膜,且随孵育时间延长,细胞毒性效率更为明显,孵育72h两种感光干膜的细胞毒性间比值约为4.86。该结果说明感光干膜的后曝光是影响其细胞毒性的关键因素,原因在于后曝光步骤能够使感光分子完全聚合,避免未聚合的光敏分子在细胞培养时释放进细胞培养液对细胞产生细胞毒性。同时,实验还发现未经过后曝光处理的感光干膜在培养液中浸泡24 h后开始出现软化、表面开始皱褶,而后曝光处理的感光干膜形态未发生改变(数据未给出)。事实上,后曝光处理的感光干膜仍具有轻微的细胞毒性(72 h为12.6%),推测原因为感光干膜吸附了培养液中蛋白分子对细胞生长造成轻微抑制。因此,细胞接种前用空白培养液对感光干膜进行预孵育降低其对细胞生长抑制效应。

图4 感光干膜的细胞生物相容性
2.3 DFP-ITO电极上A549细胞粘附增殖行为的形态学和阻抗谱检测
ITO作为电极材料构建细胞阻抗生物传感器最具吸引力的特点在于可实现细胞形态学和阻抗信息的双通道检测。为对该技术进行原理验证,本文构建了基于DFP-ITO电极的细胞阻抗传感器,并检测了A549细胞的粘附、增殖过程中细胞形态学和阻抗信息。图5为A549细胞接种在ITO电极上2 h、24 h和48 h时的形态学显微图片,显示A549细胞在ITO电极上均匀铺展,通过显微镜能够观察到细胞的铺展(2 h)、增殖(24 h)及细胞单层形成(48 h)。该结构说明ITO作为电极材料适宜细胞粘附与增殖,其良好的透光性便于获取细胞形态学数据。
当A549细胞在DFP-ITO电极表面粘附和增殖时,细胞作为具有频率依赖性的电学原件导致系统阻抗谱发生改变,因此可通过阻抗谱技术对DFP-ITO电极上细胞的粘附、增殖行为进行检测和解析。
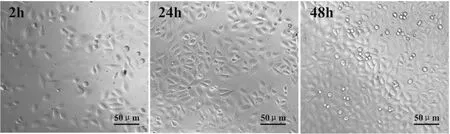
图5 利用光学显微镜观察DFP-ITO电极表面的A549细胞分别在2 h、24 h和48 h时的形态学信息

图6 DFP-ITO电极上细胞粘附增殖行为电化学阻抗谱检测
图6(a)为A549细胞接种在DFP-ITO电极上0、2 h、24 h和48 h对应的电化学阻抗谱复平面图,可见A549细胞在ITO电极上的增殖导致系统阻抗谱高频部分发生改变。在复平面图扩展标度(expanded scales)中更清楚显示A549细胞增殖导致系统阻抗谱的高频部分形成半圆,且随着细胞增殖高频部分半圆直径增大。该结果说明电极界面上细胞增殖导致电极界面上离子电荷转移过程速度减慢,其原因与细胞质膜电容特征有关[22]。另外,在低频区域,A549细胞的增殖未对系统阻抗谱产生明显变化,其原因在于细胞在低频部分其电学特性为典型绝缘体,电极与电解质溶液的离子电流主要通过细胞间隙进行转移而未穿过细胞,因此阻抗谱的低频区域不能够反映出细胞行为学变化。
为进一步分析DFP-ITO电极上不同阶段A549细胞的容抗特性,本研究采用了文献[18]报道的细胞等效电路模型,如图6(b)所示。细胞等效电路由一个RC并联电路和一个R元件串联组成,其中,R′s理论上解释为细胞-电极的间隙电阻,Rcell解释为细胞-细胞电阻,Ccell解释为细胞质膜的电容效应。通过曲线拟合技术将系统阻抗谱半圆部分与细胞等效电路模型进行拟合,A549细胞不同生长阶段等效电路元件值如图6(c)所示。从结果可知,随着A549细胞在ITO电极界面的粘附和增殖,Ccell值缓慢增加,而Rcell值和R′s值逐渐增加。形成细胞单层后Ccell值约为2.8 nF,Rcell值约为754 Ω,约为216 Ω。同时,当A549细胞从贴壁后(2 h)至形成细胞单层(48 h)间,Rcell值持续增加说明细胞-细胞间的间隙逐渐缩小,细胞融合度增加;R′s值持续增加则提示细胞-ITO电极间距离缩小,细胞粘附强度增强。相反,Ccell值对A549细胞的增殖至形成细胞单层的形态学变化不敏感。此外,仔细分析数据还发现从细胞接种(0 h)至细胞贴壁(2 h)间的各元件值改变较小,说明本系统对于该过程的细胞生物学行为检测灵敏度不足,其原因在于本系统使用ITO电极面积(0.785 mm2)较大,A549细胞在ITO电极表面粘附不足以改变系统的阻抗谱。因此,在不影响电极透光性的前提下通过电极修饰提高检测细胞阻抗传感器检测灵敏度还正在研究中。
综上结果分析可知,以DFP-ITO电极为基础构建的细胞阻抗传感器能够耦合光学显微成像技术和电化学阻抗谱技术,实现细胞形态学和阻抗信息的同时检测。在同一电极上获取的细胞形态学数据和阻抗信息互为补充、验证,提高细胞信息检测的全面性和准确性。
3 结论
本文发展了一种结构简单、易于加工的DFP-ITO电极细胞阻抗传感器,通过对A549细胞粘附、增殖的形态学和阻抗信息的测量对构建细胞阻抗传感系统进行原理性验证。研究采用感光干膜作为绝缘层降低ITO电极加工难度、成本和时间,且感光干膜表面适宜A549细胞粘附,对A549细胞生长且无明显细胞毒副作用;细胞阻抗传感器以ITO作为电极,通过光学显微镜可电极上A549细胞的形态学信息;利用电化学阻抗谱技术和细胞等效电路拟合能够检测DFP-ITO电极上A549细胞的粘附和增殖过程中阻抗信息;本文发展的DFP-ITO电极细胞阻抗传感器结构简单、易于加工,能够同时获取细胞形态学和阻抗特征值,可在普通实验室推广并用于细胞生理病理行为、药物筛选等研究领域。
[1] Pradhan R,Rajput S,Mandal M,et al. Electric Eell-Substrate Impedance Sensing Technique to Monitor Cellular Behaviours of Cancer Cells[J]. RSC Advances,2014,4(19):9432-9438.
[2] Nguyen T A,Yin T I,Reyes D,et al. Microfluidic Chip with Integrated Electrical Cell-Impedance Sensing for Monitoring Single Cancer Cell Migration in Three-Dimensional Matrixes[J]. Analytical Chemistry,2013,85(22):11068-11076.
[3] Tran T B,Nguyen P D,Um S H,et al. Real-Time MonitoringinvitroCellular Cytotoxicity of Silica Nanotubes Using Electric Cell-Substrate Impedance Sensing(ECIS)[J]. Journal of Biomedical Nanotechnology,2013,9(2):286-290.
[4] Liu Q,Yu J,Xiao L,et al. Impedance Studies of Bio-Behavior and Chemosensitivity of Cancer Cells by Micro-Electrode Arrays[J]. Biosensors and Bioelectronics,2009,24(5):1305-1310.
[5] 苏凯麒,邹玲,王琴,等. 基于细胞阻抗传感器的腹泻性毒素检测系统设计与实现[J]. 传感技术学报,2014,27(3):283-288
[6] 王天星,黎洪波,苏凯麒,等. 基于细胞电阻抗传感器的细胞多生理参数分析系统设计[J]. 传感技术学报,2014,27(12):1589-1595.
[7] Giaever I,Keese C R. Monitoring Fibroblast Behavior in Tissue Culture with an Applied Electric Field[J]. Proceedings of the National Academy of Sciences,1984,81(12):3761-3764.
[8] Heijink I H,Brandenburg S M,Noordhoek J A,et al. Characterisation of Cell Adhesion in Airway Epithelial Cell Types Using Electric Cell-Substrate Impedance Sensing[J]. European Respiratory Journal,2010,35(4):894-903.
[9] Asphahani F,Zhang M. Cellular Impedance Biosensors for Drug Screening and Toxin Detection[J]. Analyst,2007,132(9):835-841.
[10] Choi C K,Margraves C H,Jun S I,et al. Opto-Electric Cellular Biosensor Using Optically Transparent Indium Tin Oxide(ITO)Electrodes[J]. Sensors,2008,8(5):3257-3270.
[11] Choi C K,English A E,Jun S I,et al. An Endothelial Cell Compatible Biosensor Fabricated Using Optically Thin Indium Tin Oxide Silicon Nitride Electrodes[J]. Biosensors and Bioelectronics,2007,22(11):2585-2590.
[12] Moore E,Rawley O,Wood T,et al. Monitoring of Cell GrowthinvitroUsing Biochips Packaged with Indium Tin Oxide Sensors[J]. Sensors and Actuators B:Chemical,2009,139(1):187-193.
[13] Choi C K,English A E,Kihm K D,et al. Simultaneous Dynamic Optical and Electrical Properties of Endothelial Cell Attachment on Indium Tin Oxide Bioelectrodes[J]. Journal of Biomedical Optics,2007,12(6):064028-064028-8.
[14] Gross G W,Wen W Y,Lin J W. Transparent Indium-Tin Oxide Electrode Patterns for Extracellular,Multisite Recording in Neuronal Cultures[J]. Journal of Neuroscience Methods,1985,15(3):243-252.
[15] Vulto P,Glade N,Altomare L,et al. Microfluidic Channel Fabrication in Dry Film Resist for Production and Prototyping of Hybrid Chips[J]. Lab on a Chip,2005,5(2):158-162.
[16] Stephan K,Pittet P,Renaud L,et al. Fast Prototyping Using a Dry Film Photoresist:Microfabrication of Soft-Lithography Masters for Microfluidic Structures[J]. Journal of Micromechanics and Microengineering,2007,17(10):N69-N74.
[17] Leech P W,Wu N,Zhu Y. Application of Dry Film Resist in the Fabrication of Microfluidic Chips for Droplet Generation[J]. Journal of Micromechanics and Microengineering,2009,19(6):065019.
[18] Karimullah A S,Cumming D R S,Riehle M,et al. Development of a Conducting Polymer Cell Impedance Sensor[J]. Sensors and Actuators B:Chemical,2013,176:667-674.
[19] Pasqualato A,Palombo A,Cucina A,et al. Quantitative Shape Analysis of Chemoresistant Colon Cancer Cells:Correlation between Morphotype and Phenotype[J]. Experimental Cell Research,2012,318(7):835-846
[20] Yeon J H,Park J K. Cytotoxicity Test Based on Electrochemical Impedance Measurement of HepG2 Cultured in Microfabricated Cell Chip[J]. Analytical Biochemistry,2005,341(2):308-315.
[21] Huang X,Greve D W,Nguyen D D,et al. Impedance Based Biosensor Array for Monitoring Mammalian Cell Behavior[C]//Sensors,2003,Proceedings of IEEE. IEEE,2003,1:304-309.
[22] Ding L,Hao C,Zhang X,et al. Carbon Nanofiber Doped Polypyrrole Nanoscaffold for Electrochemical Monitoring of Cell Adhesion and Proliferation[J]. Electrochemistry Communications,2009,11(4):760-763.

李 远(1985-),男,重庆医科大学,博士研究生,主要研究方向为微流控芯片及细胞生物传感器,liyuan_1985999@163.com;

刘北忠(1970-),男,重庆医科大学,教授,主要研究方向为生物医学微纳米技术与系统、肿瘤分子诊疗靶点筛选等,lbzemail@163.com。
A Simple Cellular Impedance Biosensor Based on Dry FilmPhotoresist-Indium Tin Oxide Electrode for Detecting CellularMorphology and Impedance Information Simultaneously*
LIYuan,HUFan,LIAOJuan,HULiyi,LIUBeizhong*
(Central Laboratory of Yongchuan Hospital,Chongqing Medical University,Chongqing 402160,China)
This study describes the fabrication of a simple cellular impedance biosensor based on dry film Photoresist-indium tin oxide(DFP-ITO)electrode for detecting the cellular morphology and impedance information simultaneously. A dry film photoresist layer of 35 microns thickness was laminated on the surface of the ITO conductive glass as an insulating layer,and then circular holes with different diameters were etched on the insulation layer by photolithography technique. The exposed ITO electrode,as a working electrode,was connected to an Ag/AgCl reference electrode and a Pt counter electrode through a clamp and a measuring pool to constitute a Three-electrode impedance measurement system. The impedance of the DFP-ITO electrodes was investigated by impedance spectroscopy technology. The biocompatibility of the dry film photoresist was investigated by experiments of cell adhesion and cell toxicity. The biological behavior information about cell adhesion and proliferation of the A549 lung cancer on the DFP-ITO electrode was analyzed by optical microscope and impedance spectroscopy technology respectively. Results showed that the DFP-ITO electrodes with different diameters had similar impedance characteristics. Fully cured dry film photoresist could provide an appropriate surface for A549 cell adhesion and had no obvious cytotoxicity. The cellular impedance sensor based on the DFP-ITO electrode could be used to obtain the morphological data and analyze the changes of the cytoplasm membrane capacitance,cell-cell gap resistance and cell-ITO electrode gap resistance during the process of adhesion and proliferation of A549 cell by optical microscope and impedance spectrum technology respectively. The cellular impedance biosensor based on DFP-ITO electrode has a simple structure and can realize the Dual-channel acquisition of cell morphology and impedance information. It can be used in the fields of cellular physiological and pathological behavior and drug cytotoxicity in the future.
biosensor;electrochemical impedance detection;dry film photoresist;indium tin oxide;impedance;cell morphology
项目来源:重庆市自然科学基金面上项目(cstc2012jjA10046);重庆市永川区创新能力建设平台项目(Ycstc,2014bf5001);重庆市级大学生创新创业训练计划项目(201410631012);重庆医科大学大学生科研与创新实验项目(201413)
2014-12-19 修改日期:2015-03-01
C:7230J
10.3969/j.issn.1004-1699.2015.06.001
TP212.3
A
1004-1699(2015)06-0779-08

