硫化氢对糖尿病大鼠心肌纤维化及PPARγ、NF-κB表达的影响*
肖 婷, 罗 健, 吴志雄, 李 芳, 张晶晶, 杨 军
(南华大学附属第一医院心血管内科,湖南 衡阳 421001)
硫化氢对糖尿病大鼠心肌纤维化及PPARγ、NF-κB表达的影响*
肖 婷, 罗 健, 吴志雄, 李 芳, 张晶晶, 杨 军△
(南华大学附属第一医院心血管内科,湖南 衡阳 421001)
目的: 初步探讨硫化氢(H2S)对糖尿病心肌纤维化的影响及其作用机制。方法: 采用链脲佐菌素(STZ)单次腹腔注射的方法制作大鼠糖尿病模型,以硫氢化钠作为外源性H2S供体。将 40只雄性SD大鼠随机分为对照组、STZ组、STZ+H2S组及H2S组,每组各10只。8周后处死大鼠,HE染色及VG染色观察心肌胶原分布情况,并用图像分析系统测量心肌间质胶原容积分数。Western blotting 观察大鼠心肌组织中Ⅰ型胶原、PPARγ和NF-κB的表达水平。结果: 与对照组相比,STZ组大鼠心肌组织胶原纤维明显增多,Ⅰ型胶原表达水平明显升高(P<0.05),PPARγ表达明显减少(P<0.05),NF-κB蛋白表达水平明显升高(P<0.05)。与STZ组相比,STZ+H2S组心肌胶原纤维较少,Ⅰ型胶原表达明显降低(P<0.05),PPARγ表达显著上调(P<0.05),NF-κB蛋白表达显著降低(P<0.05),而H2S组大鼠心肌组织Ⅰ型胶原、PPARγ以及和NF-κB蛋白表达水平较对照组均无显著差异。结论: 硫化氢可改善糖尿病心肌纤维化,其内在机制可能与PPARγ-NF-κB途径有关。
硫化氢; 糖尿病心肌纤维化; Ⅰ型胶原; 过氧化物酶体增殖物激活受体γ; 核因子κB
心肌纤维化是糖尿病所致心脏损害的重要特征,大量的胶原沉积于心肌间质,从而影响心肌收缩及舒张功能,导致心功能不全,也与心律失常,甚至心源性猝死的发生密切相关。心肌纤维化是一个复杂的病理过程,其中炎症反应常与心肌纤维化并存,炎症反应在糖尿病心肌纤维化的发生发展过程中具有十分重要的作用。
过氧化物酶体增殖物激活受体(peroxisome proliferator-activated receptors,PPARs)是一类由配体激活的核转录因子,属于核受体超家族成员,PPARγ已被证实在调节糖代谢、脂代谢和炎症反应等过程中发挥着重要的作用。细胞核因子κB(nuclear factor-κB,NF-κB)也是调控机体免疫和炎症反应的重要转录因子。进一步的研究表明,PPARγ对炎症反应的抑制作用主要是通过抑制NF-κB的活化来完成的,PPARγ通过与其配体结合而被激活,可使NF-κB活性下降或抑制其活化,从而减少细胞因子的表达,最终缓解炎症反应[1]。
硫化氢(hydrogen sulfide,H2S)是作为一种新型的气体信号分子,参与心血管系统生理及病理过程的调节。它可通过扩血管、抗氧化、抗凋亡等机制,在高血压和心肌缺血再灌注等心血管疾病中发挥一定的心肌保护作用[2]。近来徐文明等[3]发现H2S 可通过抑制 NF-κB 通路保护心肌细胞对抗阿奇霉素引起的炎症反应与细胞毒性。然而,硫化氢对糖尿病心肌纤维化的影响及其内在调控机制,目前尚不清楚。
本研究通过观察糖尿病大鼠心肌组织I型胶原、PPARγ及NF-κB表达情况,及硫化氢对其表达影响,初步探讨硫化氢对糖尿病心肌纤维化的影响及其作用机制。
材 料 和 方 法
1 实验动物、药品与试剂
40只雄性SD大鼠,体重250~300 g,由长沙SJA实验室动物中心提供。动物饲养于(23±1) ℃的环境中,白天黑夜各12 h;实验动物均可自由获得水和食物。
链脲佐菌素(streptozotocin,STZ)购自MP Biomedicals;硫氢化钠(H2S供体)购自Sigma;兔源Ⅰ型胶原、PPARγ及NF-κB I抗购自武汉博士德公司;鼠源GAPDH I抗购自广州晶欣生物科技有限公司;抗兔II抗和抗鼠II抗购于武汉博士德公司;BCA蛋白定量试剂盒、细胞裂解液购于碧云天公司。
2 方法
2.1 模型建立及处理方案 将实验大鼠适应性饲养1周,期间自由进食、饮水。随后,将大鼠随机分4组:对照组(control组)、糖尿病组(STZ组)、糖尿病硫化氢干预组(STZ+H2S组)及硫化氢对照组(H2S组),每组各10只。大鼠禁食12 h 后,糖尿病大鼠模型通过单次腹腔注射STZ(40 mg/kg,溶解于柠檬酸钠缓冲液中,pH 4.4)构建,非糖尿病大鼠单次腹腔注射相同剂量的柠檬酸钠。3 d后经由尾静脉取血,血糖高于16.7 mmol/L的大鼠视为糖尿病动物造模成功,用于后续试验。STZ+H2S组和H2S组大鼠每日腹腔注射硫氢化钠(100 μmol/kg),对照组和STZ组仅注射同等剂量的生理盐水。第8周末,采用10%水合氯醛(350 mg/kg)行腹腔注射麻醉,迅速打开胸腔,摘取心脏后用冰生理盐水冲洗,滤纸吸干,除去心脏周围组织和大血管,取适量组织于甲醛中固定后用于制作石蜡切片,剩余组织保存在-80 °C冰箱,用于免疫印迹测定蛋白等。
2.2 心肌组织病理学观察 分别取4组大鼠左心室心肌组织,用4%多聚甲醛固定后,常规石蜡包埋、切片,厚4 μm, 行HE及VG染色,于光镜下观察摄片。采用图像分析系统对VG染色图片进行心肌组织胶原容积分数(collagen volume fraction,CVF)分析,CVF=胶原面积/总面积。
2.3 Western blotting检测心肌组织中Ⅰ型胶原蛋白、PPARγ和NF-κB蛋白含量 取大鼠新鲜左心室组织,提取蛋白后进行蛋白定量;以SDS-聚丙烯酰胺凝胶电泳后,湿转法将蛋白质转移至PVDF膜。5% BSA封闭2 h后,以Ⅰ型胶原、PPARγ、NF-κB和GAPDH I抗(稀释度均为1∶400)37 ℃孵育1 h后4 ℃过夜,TBST洗膜3 次,洗膜后用HRP标记的II抗(稀释度为1∶4 000)37 ℃孵育1 h,同样用TBST洗膜3 次,ECL发光,曝光后扫描,以目的条带和内参照条带GAPDH的灰度比值分别表示Ⅰ型胶原蛋白、PPARγ及NF-κB的表达水平。
3 统计学处理
采用SPSS 18.0软件进行统计分析。计量资料以均数±标准差(mean±SD)表示,组间比较采用单因素方差分析,以P<0.05为差异有统计学意义。
结 果
1 大鼠心肌组织的HE染色结果
4组大鼠左心室心肌组织HE染色结果显示STZ组大鼠心肌胶原纤维分布显著增多,存在明显心肌纤维化,而STZ+H2S组大鼠心肌纤维化较STZ组明显改善,见图1。
Figure 1.HE staining of myocardial tissues from the rats with different treatment (×200).
图1 大鼠心肌组织HE染色结果
2 大鼠心肌组织VG染色结果
4组大鼠左心室心肌组织VG染色结果显示STZ组大鼠心肌组织存在大量被染成红色的胶原纤维,而STZ+H2S组大鼠心肌胶原纤维较STZ组明显减少。胶原半定量分析结果显示,STZ组 CVF 明显高于对照组(P<0.05),而STZ+H2S组CVF明显低于STZ组(P<0.05),见图2。
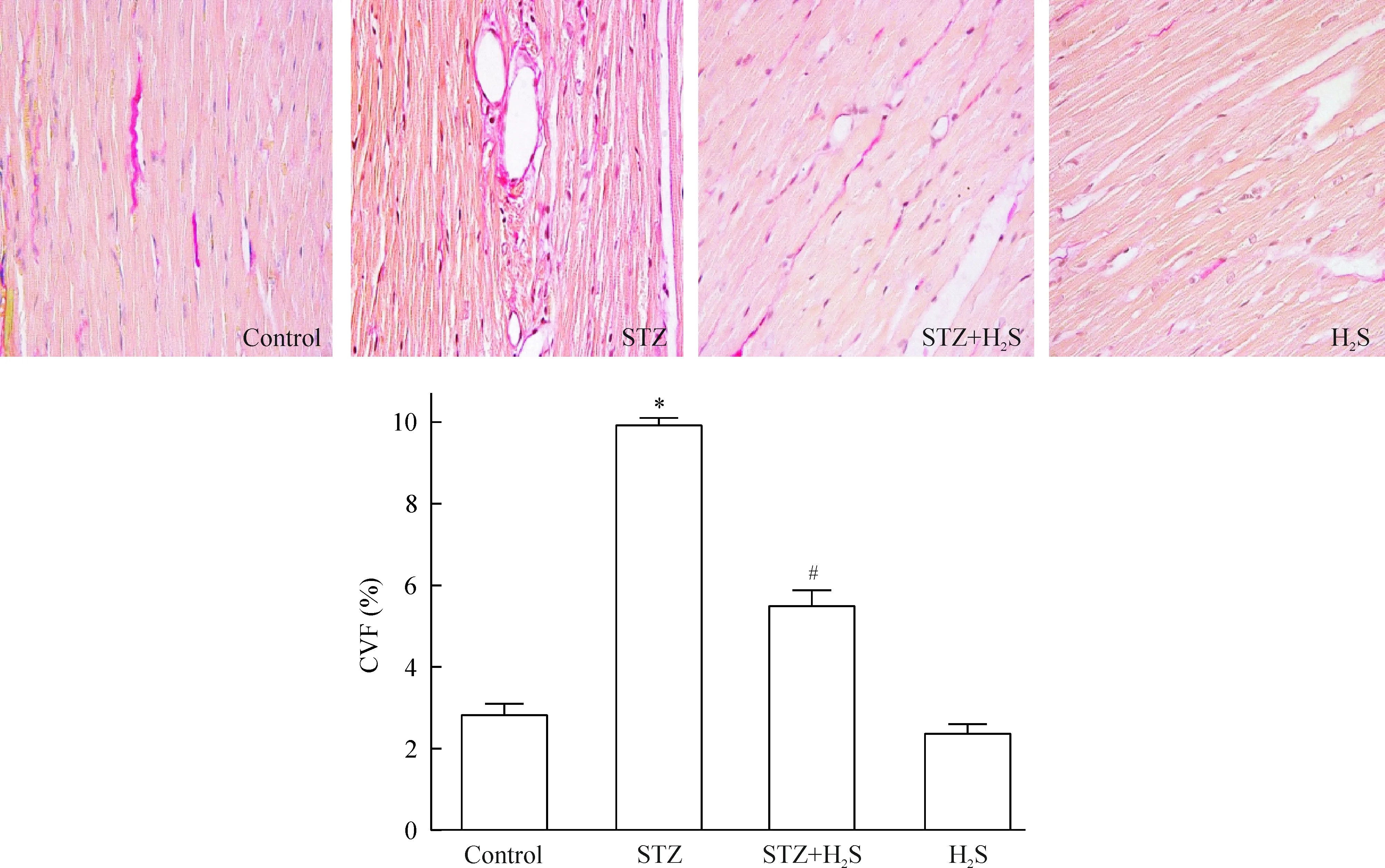
Figure 2.VG staining of myocardial tissues from the rats with different treatment (×200). Mean±SD.n=3.*P<0.05vscontrol group;#P<0.05vsSTZ group.
图2 大鼠心肌组织VG 染色结果
3 4组大鼠心肌Ⅰ型胶原表达的比较
如图3所示,与正常对照组比较,STZ组大鼠心肌组织中的Ⅰ型胶原表达水平明显升高,两者差异有统计学意义(P<0.05),STZ+H2S组大鼠心肌Ⅰ型胶原表达与STZ组大鼠组相比明显下调(P<0.05)。与正常对照组相比,H2S组心肌Ⅰ型胶原表达无明显差异。

Figure 3.The effect of hydrogen sulfide on collagen Ⅰ expression in the myocardial tissues of diabetic rats. Mean±SD.n=3.*P<0.05vscontrol group;#P<0.05vsSTZ group.
图3 硫化氢对糖尿病大鼠心肌组织Ⅰ型胶原表达的影响
4 4组大鼠心肌组织中PPARγ和NF-κB蛋白的表达
如图4所示,与正常对照组相比,STZ组大鼠组心肌组织PPARγ表达水平显著减少(P<0.05),STZ+H2S组PPARγ较STZ组明显上调(P<0.05)。与正常对照组相比,STZ大鼠组心肌组织NF-κB表达水平显著升高(P<0.05),STZ+H2S组NF-κB较STZ组明显下调(P<0.05)。H2S组大鼠心肌PPARγ和NF-κB蛋白表达与正常对照组无明显差异。
讨 论
糖尿病心肌病是糖尿病严重的心血管并发症。心肌纤维化是糖尿病心肌病主要病理特征。有研究用链脲佐菌素诱导糖尿病模型,发现糖尿病大鼠血清和心脏中多种炎症细胞因子表达升高[4]。依贝沙坦可通过下调促炎因子IL-1β表达,减轻心肌纤维化程度,从而缓解糖尿病导致的左心室功能障碍,进一步提示炎症与糖尿病心肌纤维化密切相关[5]。并且还有研究表明,通过减轻炎症反应可缓解高血压心肌纤维化[6]。硫化氢是一种重要的细胞信号分子,被证实在高压力负荷和心肌缺血再灌注等病理状态下发挥一定的心肌保护作用。与此同时,有研究发现气体分子硫化氢在抑制炎症方面具有重要的作用,并可能与其心肌保护作用有关。还有学者发现硫化氢可通过下调血管紧张素Ⅱ 1型受体表达抑制高血压大鼠心肌重构[7],但关于此气体信号分子对糖尿病大鼠心肌病变的影响及机制的报道目前尚为少见。本实验发现,与正常大鼠相比,腹腔注射链脲佐菌素后大鼠体重明显下降,血糖显著升高,说明糖尿病大鼠模型建立成功。HE染色、VG染色及Ⅰ型胶原Western blotting实验结果显示,与对照组相比,糖尿病大鼠心肌组织胶原纤维明显增多,而硫化氢干预后可使糖尿病大鼠心肌中胶原的表达降低,结果提示硫化氢可在一定程度上改善糖尿病导致的心肌纤维化。
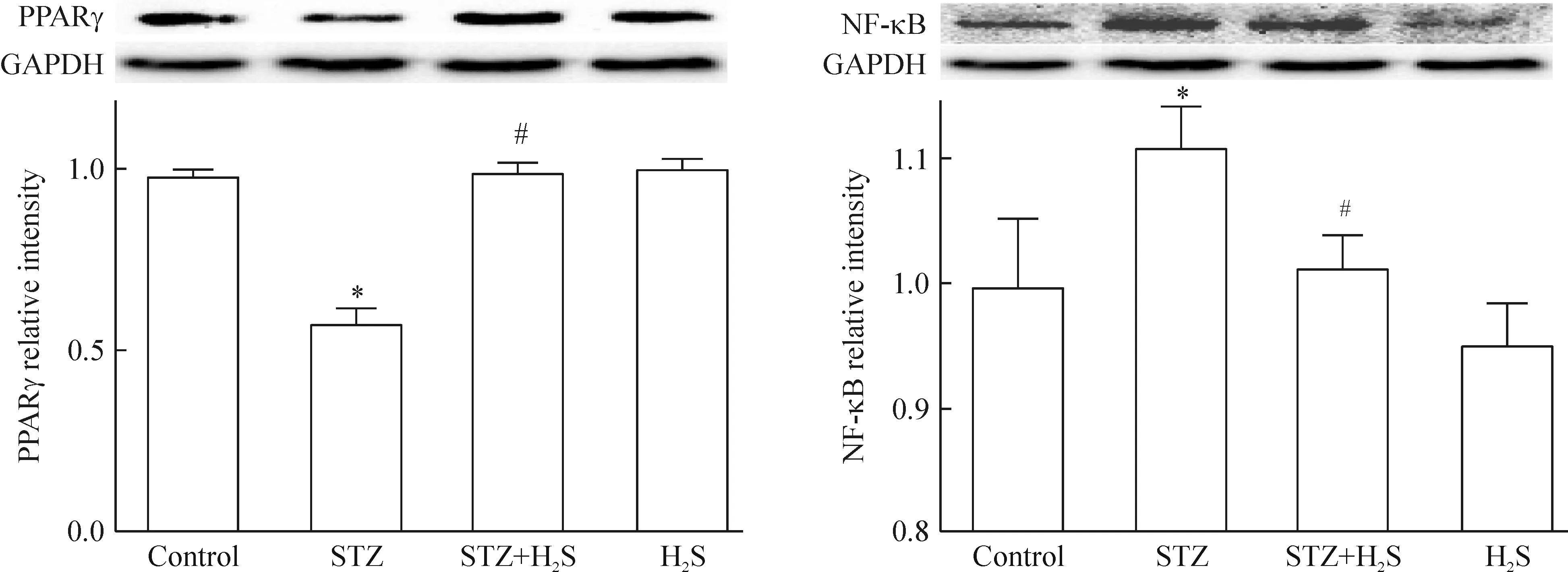
Figure 4.The effects of hydrogen sulfide on PPARγ and NF-κB expression in the myocardial tissue of diabetic rats. Mean±SD.n=3.*P<0.05vscontrol group;#P<0.05vsSTZ group.
图4 硫化氢对糖尿病大鼠心肌组织PPARγ和NF-κB蛋白表达的影响
NF-κB存在于多种组织细胞中,多种参与炎症反应的细胞因子、黏附分子和蛋白酶类的基因转录过程均受其调控, 因此NF-κB与炎症的发生密切相关。NF-κB被抑制后,转录过程受其调节的促炎因子、黏附分子等也会受到抑制。本实验检测了糖尿病大鼠心肌组织中NF-κB的表达,结果显示,糖尿病大鼠心肌组织中NF-κB表达较正常大鼠明显升高,而糖尿病硫化氢干预组NF-κB表达较糖尿病组下降,说明糖尿病心脏组织表达升高的NF-κB可能与糖尿病心肌纤维化发生发展有关,而硫化氢在一定程度上可抑制NF-κB蛋白表达的上调,这也可能是硫化氢改善糖尿病导致的心肌纤维化的机制之一。
有学者认为PPARγ-NF-κB途径是调控炎症反应的一个重要的靶点。PPARγ属于核受体超家族成员,在组织中分布广泛,PPARs有α、β/δ 和 γ 3 种亚型。而PPARγ与其配体结合而被激活后, 不仅能直接与靶基因启动子区域的PPAR反应元件结合发挥作用,还可通过抑制转录因子(包括NF-κB)活性来发挥负向的间接转录调控。研究发现PPARγ和NF-κB在组织中经常呈负相关表达,PPARγ具有明显的免疫抑制和抗炎效应。更值得关注的是,近年发现PPARγ参与多种器官纤维化的发生路径,影响纤维化的进程。如有研究发现PPARγ激动剂罗格列酮治疗非酒精性脂肪性肝炎大鼠,使大鼠肝纤维化显著改善[8]。本实验中,糖尿病组大鼠心肌组织PPARγ表达下降,我们可推测,PPARγ蛋白表达下调可能参与了糖尿病大鼠心肌纤维化的发生发展过程。而糖尿病硫化氢干预组大鼠心肌组织的PPARγ表达较糖尿病组大鼠明显升高,因此,硫化氢可能通过上调PPARγ表达,通过PPARγ-NF-κB途径减轻糖尿病心肌纤维化。
本研究提示硫化氢可能通过PPARγ-NF-κB途径改善糖尿病心肌纤维化,结果可为糖尿病心肌纤维化的发病机制研究,以及糖尿病心肌纤维化临床治疗提供了新的思路。
[1] Delerive P, Gervois P, Fruchart JC, et al. Induction of IκBα expression as a mechanism contributing to the anti-inflammatory activities of peroxisome proliferator-activated receptor-α activators[J]. J Biol Chem, 2000, 275(47):36703-36707.
[2] Calvert JW, Coetzee WA, Lefer DJ. Novel insights into hydrogen sulfide-mediated cytoprotection[J]. Antioxid Redox Signal, 2010, 12(10):1203-1217.
[3] 徐文明,郭润民,陈景福,等. 硫化氢通过调控NF-κB通路抑制阿霉素引起的心肌细胞炎症与细胞毒性[J]. 中国病理生理杂志, 2013, 29(9):1561-1566.
[4] Song Y, Wang J, Li Y, et al. Cardiac metallothionein synthesis in streptozotocin-induced diabetic mice, and its protection against diabetes-induced cardiac injury[J]. Am J Pathol, 2005, 167(1):17-26.
[5] Burrell LM, Johnston CI, Tikellis C, et al. ACE2, a new regulator of the renin-angiotensin system[J]. Trends Endocrinol Metab, 2004, 15(4):166-169.
[6] 黄帧桧,柏 松,张年宝,等.葛根素对自发性高血压大鼠心肌纤维化的影响及其机制[J]. 中国病理生理杂志,2014,30(3):518-523.
[7] 黄贤生,王东明,郑锦滨. 硫化氢下调血管紧张素Ⅱ1型受体表达抑制高血压大鼠心肌重构[J]. 中国动脉硬化杂志, 2012, 20(9):787-791.
[8] 矫 杰,李雅君,李晓沛,等. 罗格列酮对非酒精性脂肪性肝炎大鼠的抗纤维化研究[J]. 肝脏, 2009, 14(3):227-229.
Effect of hydrogen sulfide on myocardial fibrosis and PPARγ and NF-κB expression in rat model of diabetes
XIAO Ting, LUO Jian, WU Zhi-xiong, LI Fang, ZHANG Jing-jing, YANG Jun
(DepartmentofCardiology,TheFirstAffiliatedHospital,UniversityofSouthChina,Hengyang421001,China.E-mail:yangjunincn@163.com)
AIM: To explore the effects of hydrogen sulfide (H2S) on the myocardial fibrosis in a rat model of diabetes and its mechanism. METHODS: Single intraperitoneal injection of streptozotocin (STZ) was utilized to establish a rat model of diabetes. Sodium hydrosulfide was used as an exogenous donor of hydrogen sulfide. Male SD rats were randomly divided into control group, STZ group, STZ+H2S group and H2S group. Eight weeks later, HE and VG staining methods were used to observe the collagen distribution and collagen volume fraction was measured by image analysis. The expression levels of type I collagen, PPARγ and NF-κB in the cardiac tissues were determined by Western blotting. RESULTS: Compared with control group, collagen distribution and the expression levels of type I collagen and NF-κB in the cardiac tissues were markedly increased (P<0.05), while PPARγ was significantly decreased in STZ group (P<0.05), but these indexes were reversed significantly in STZ+H2S group (P<0.05). The expression levels of type I collagen, PPARγ and NF-κB had no significant difference between H2S group and control group. CONCLUSION: Hydrogen sulfide attenuates cardiac fibrosis in diabetic rats, and its mechanism may be related to PPARγ-NF-κB signaling pathway.
Hydrogen sulfide; Diabetic myocardial fibrosis; Type I collagen; Peroxisome proliferator-activated receptor γ; Nuclear factor-κB
1000- 4718(2015)04- 0635- 05
2014- 11- 07
2014- 12- 08
国家自然科学基金资助项目(No. 81202830);湖南省自然科学基金资助项目(No. 11JJ2046)
R363
A
10.3969/j.issn.1000- 4718.2015.04.011
△通讯作者 Tel: 0734-8578767; E-mail: yangjunincn@163.com

