miR-375对人结肠癌细胞株HCT116活性、细胞周期及凋亡的影响*
刘宝龙, 吴斌文, 黄素军, 李东风
(1南方医科大学,广东 广州 510515; 2广东省人民医院,广东省老年医学研究所,广东省医学科学院,广东 广州 510080; 3广州市红十字会医院,广东 广州 510220)
miR-375对人结肠癌细胞株HCT116活性、细胞周期及凋亡的影响*
刘宝龙1,2, 吴斌文2△, 黄素军3, 李东风2
(1南方医科大学,广东 广州 510515;2广东省人民医院,广东省老年医学研究所,广东省医学科学院,广东 广州 510080;3广州市红十字会医院,广东 广州 510220)
目的: 探讨微小RNA-375(microRNA-375,miR-375)对人结肠癌细胞HCT116活性、细胞周期及凋亡的影响。方法: Real-time PCR检测不同结直肠癌细胞中miR-375的表达情况。脂质体转染法将miR-375模拟物(mimics)转入HCT116细胞,用real-time PCR法检测miR-375及AEG-1 mRNA的表达情况;MTT法检测细胞活性的改变情况;流式细胞技术检测miR-375对细胞凋亡及细胞周期的影响。结果: Real-time PCR结果显示HCT116在4个结直肠癌细胞株中miR-375的表达量最低;miR-375 mimics组中miR-375表达量较对照组明显上调;miR-375高表达可以显著抑制AEG-1 mRNA的表达水平。miR-375 mimics组细胞活性明显受到抑制,同时细胞凋亡率明显增加,G1期所占细胞数增加,而S期所占细胞数减少。结论: miR-375可以抑制结肠癌HCT116细胞的活性,介导细胞周期阻滞并促进其凋亡。miR-375作为一种抑癌因子,在结肠癌中可能通过抑制AEG-1发挥抑癌作用。
结直肠癌; 微小RNA-375; 细胞活性; 细胞周期; 细胞凋亡
结直肠癌(colorectal cancer,CRC)是最常见的消化道恶性肿瘤之一,在世界多数国家的发病率呈上升趋势,据统计,美国每年有近14万新诊断CRC病例[1]。微小RNA(microRNA,miRNA)是一类长20~25个核苷酸的内源性单链非编码小RNA。miR-375是miRNA家族中的一员,目前已证实与多种恶性肿瘤相关,可通过调节多种靶基因的表达,发挥抑癌或促癌作用。研究发现,miR-375可通过靶向调节星形胶质细胞升高基因1(astrocyte elevated gene-1,AEG-1)/异黏蛋白(metadherin,MTDH)基因的表达,从而参与肝癌和头颈部鳞状细胞癌发生发展过程[2-3],但miR-375与AEG-1的关系尚未在结直肠癌中得到证实。本实验通过研究miR-375对结肠癌HCT116细胞生物学行为的影响,旨在为结肠癌的发病机制提供新的理论依据。
材 料 和 方 法
1 主要材料
人结肠癌细胞株Caco-2、HCT-116、SW-480和SW-620均购自CTCC;DMEM培养基、RPMI-1640培养基和胎牛血清均购自Gibco;0.25%胰蛋白酶购自杭州吉诺生物有限公司;miR-375 mimics和negative control转染试剂盒购自广州锐博生物科技有限公司;LipofectamineTM2000及TRIzol试剂均购自Invitrogen;噻唑蓝(MTT)购自广州威佳公司;二甲基亚砜购自Sigma;细胞周期及凋亡检测试剂盒购于杭州联科生物技术股份有限公司;RevertAid First Strand cDNA Synthesis Kit购自Fermentas;SYBR Premix Ex TaqⅡ(Tli RNaseH Plus)为TaKaRa产品。
2 方法
2.1 细胞培养 Caco-2和HCT-116细胞用含10%胎牛血清的DMEM培养基进行培养,SW-480和SW-620细胞用含10%胎牛血清的RPMI-1640培养基进行培养。培养条件:置于37 ℃、5% CO2的培养箱中培养。根据细胞生长情况每1~2 d换液1次,当细胞覆盖瓶底壁大部分表面时,进行细胞传代或收集细胞。
2.2 Real-time PCR检测不同结肠癌细胞中miR-375的表达情况 收集细胞,按照TRIzol试剂说明书抽提结直肠癌细胞株Caco-2、HCT-116、SW-620和SW-480中的总RNA,-80 ℃冻存备用。采用real-time PCR检测结肠癌细胞中miR-375的表达,以U6作为内参照,引物均购自广州锐博公司。结果采用2-ΔCt法计算目的基因的相对表达量,ΔCt=目的基因平均Ct值-内参照基因平均Ct值。
2.3 细胞转染 转染前1 d,将适量(约4×104~5×104)生长状态稳定的HCT-116细胞接种在24孔细胞培养板上,每孔加入不含抗生素的细胞培养液400 μL。密切观察细胞生长情况,当细胞密度达到 30%~50%时,开始进行实验组(miR-375 mimics)和对照组(negative control,NC)的转染。用50 μL不含血清的培养基Opti-MEM对5 μL浓度为20 μmol/L的miR-375 mimics和negative control进行稀释,轻轻振荡混匀,室温下温育5 min。用50 μL的不含血清培养基Opti-MEM对1.5 μL LipofectamineTM2000进行稀释,轻轻振荡混匀,室温下温育5 min。将稀释好的miR-375 mimics和negative control与LipofectamineTM2000混合,轻柔混匀,室温下温育20 min,以形成混合物。100 μL混合物加到培养板的孔中,轻轻摇晃细胞培养板使其与培养液混匀。将细胞培养板置于5% CO2的培养箱中,在37 ℃下培养6 h后,移除每孔中含有混合物的培养液,更换新的培养液。继续在37 ℃、5% CO2的条件下培养24 h后,进行转染后的其它实验检测。
2.4 Real-time PCR检测各转染组细胞中miR-375和AEG-1 mRNA的表达情况 转染48 h后收集细胞,按照TRIzol说明书抽提细胞中的总RNA,-80 ℃冻存备用。采用real-time PCR检测结肠癌细胞中miR-375的表达,以U6作为内参照,引物购自广州锐博公司。real-time PCR检测细胞中AEG-1 mRNA的表达情况,以GAPDH作为内参照,引物购自TaKaRa。AEG-1的上游引物序列为5’-TCGATGATGAATGGTCTGGGTTA-3’,下游引物为5’-AGGAATTGGTTCCTGGGACTTTAG-3’; GAPDH的上游引物序列为 5’-GCACCGTCAAGGCTGAGAAC-3’,下游引物为5’-TGGTGAAGACGCCAGTGGA-3’。结果采用2-ΔCt法计算目的基因的相对表达量,ΔCt=目的基因平均Ct值-内参照基因平均Ct值。
2.5 MTT法检测细胞的生长情况 将转染后的实验组和阴性对照组细胞分别接种于96孔培养板中,每孔接种细胞3 000个(每孔加培养液100 μL),置于37 ℃、5% CO2体积分数为5%的培养箱中进行培养。分别于培养4 h、24 h、48 h和72 h后加入MTT工作液,每孔加入0.5% MTT 20 μL,继续培养4 h后,轻轻吸出孔内液体,然后在每孔中加入二甲基亚砜150 μL,应用全自动酶标仪,检测波长490 nm下的吸光度(A)值。以时间作为横坐标,计算所得A值的均数为纵坐标,绘制细胞生长曲线。
2.6 流式细胞术检测细胞周期 转染48 h后消化收集细胞,制成单细胞悬液,然后1 200 r/min离心5 min,弃上清。预冷PBS洗涤细胞2次,PI细胞染色,即加入1 000 μL staining buffer(A)及10 μL reagent B染色,混匀后室温避光孵育30 min,立即上流式细胞仪进行检测。
2.7 流式细胞术检测细胞凋亡 转染48 h后消化收集细胞,制成单细胞悬液,然后1 200 r/min离心5 min,弃上清。预冷PBS洗涤细胞2次,用500 μL 1×binding buffer重悬细胞,加入5 μL FITC标记的Annexin V,加入10 μL的PI。混匀后室温避光孵育5 min,立即上流式细胞仪检测。
3 统计学处理
应用SPSS 20.0统计学软件对实验数据进行统计学分析。所有的细胞学实验均重复3次,计量数据以均数±标准差(mean±SD)表示,符合正态分布且方差齐者采用t检验或者单因素方差分析检验,方差不齐采用Dunnett T3校正,以P<0.05为差异有统计学意义。
结 果
1 miR-375在结肠癌细胞株中的表达情况
4种人结直肠癌细胞系Caco-2、HCT-116、SW-620和SW-480中miR-375相对表达量分别为0.002 024±0.000 104、0.000 687±0.000 111、0.007 543±0.002 696和0.004 935±0.000 619。其中以HCT116细胞中miR-375的表达水平最低,因此选取HCT116细胞系作为我们进一步研究的对象。
2 miR-375 mimics对HCT 116细胞中miR-375和AEG-1 mRNA表达的影响
miR-375 mimics瞬时转染HCT116细胞48 h后,采用real-time PCR检测转染后实验组及阴性对照组HCT116细胞中miR-375和AEG-1 mRNA的表达水平。结果显示,转染miR-375 mimic后miR-375的表达水平明显上调,其表达水平约是阴性对照组2 000倍(P<0.01),同时miR-375的高表达导致AEG-1 mRNA表达下调(P<0.05)。以上结果提示,miR-375 mimics可上调miR-375的表达,同时过表达miR-375可抑制AEG-1 mRNA的表达,见图1。
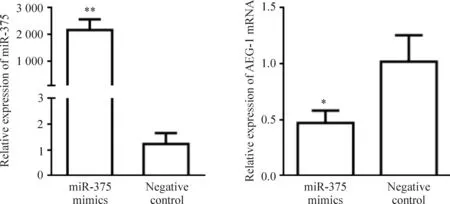
Figure 1.The expression levels of miR-375 and AEG-1 mRNA in human colon cancer HCT116 cells after transfection detected by real-time PCR. U6 or GAPDH served as an internal standard. Mean±SD.n=3.*P<0.05,**P<0.01vsnegative control.
图1 miR-375 mimics对HCT 116细胞中miR-375和AEG-1 mRNA表达的影响
3 miR-375过表达对HCT116细胞生长的影响
MTT法检测结果显示,miR-375 mimics组细胞转染24 h、48 h和72 h时的A值均低于阴性对照组,差异有统计学意义(P<0.01)。miR-375过表达对HCT116细胞的活力具有明显抑制作用,见图2。
4 miR-375过表达对HCT116细胞周期的影响
流式细胞仪检测转染48 h后各组细胞的周期分布,结果显示,阴性对照组与miR-375 mimics组比较,miR-375 mimics组G1期细胞所占比例明显增多(P<0.01),S期细胞所占比例明显减少(P<0.05),见图3、表1。
5 miR-375过表达对HCT116细胞凋亡率的影响
流式细胞术检测转染48 h后各组细胞的凋亡率,结果显示,miR-375 mimics组和阴性对照组的细胞凋亡率分别为(8.47±1.55)%和(6.25±1.20)%,阴性对照组的细胞凋亡率明显低于miR-375 mimics组,差异有统计学意义(P<0.05),见图4。
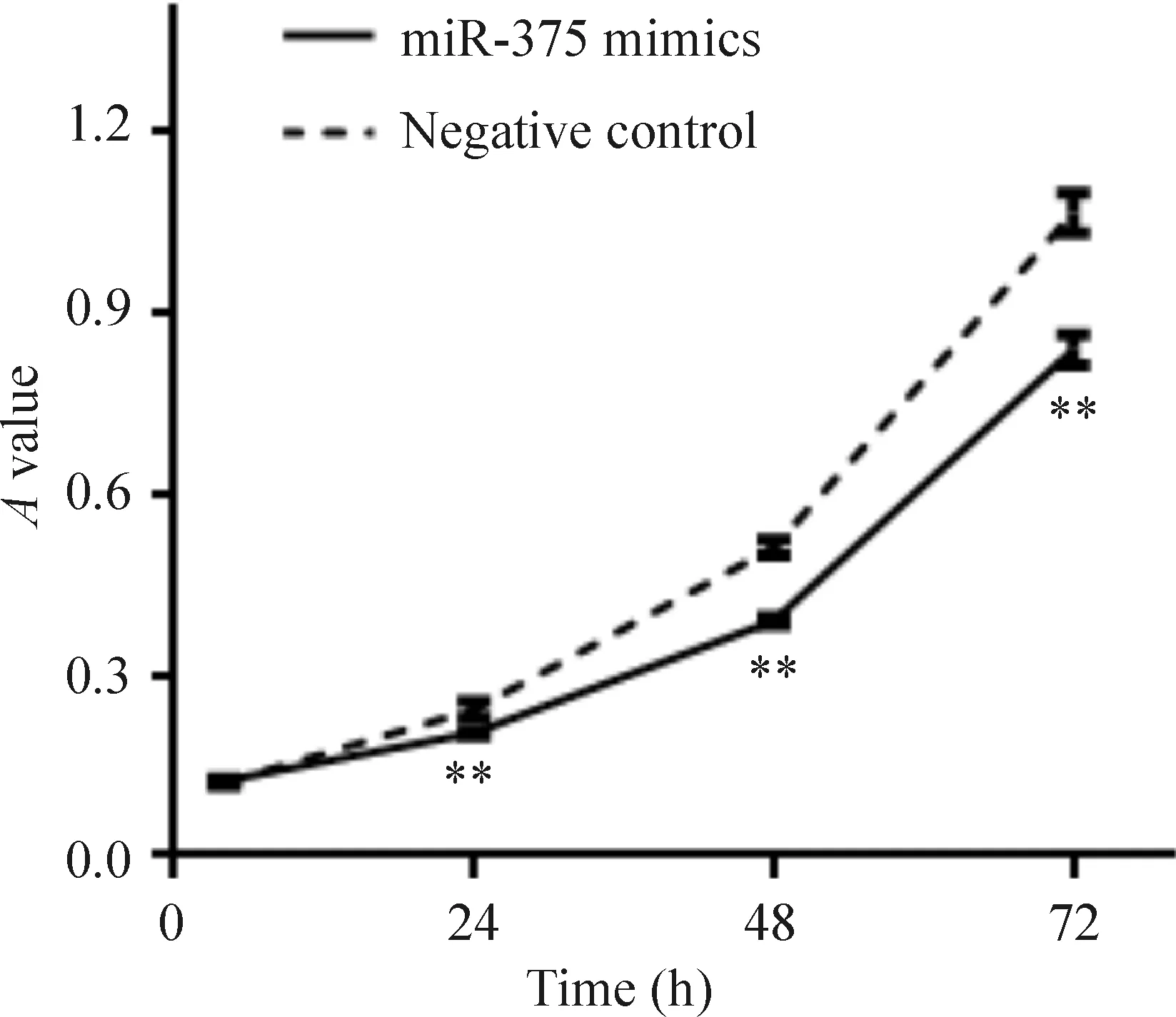
Figure 2.The effect of miR-375 over-expression on the viability of HCT116 cells detected by MTT assay. Mean±SD.n=4.**P<0.01vsnegative control.
图2 MTT法检测miR-375过表达对HCT116细胞活力的影响
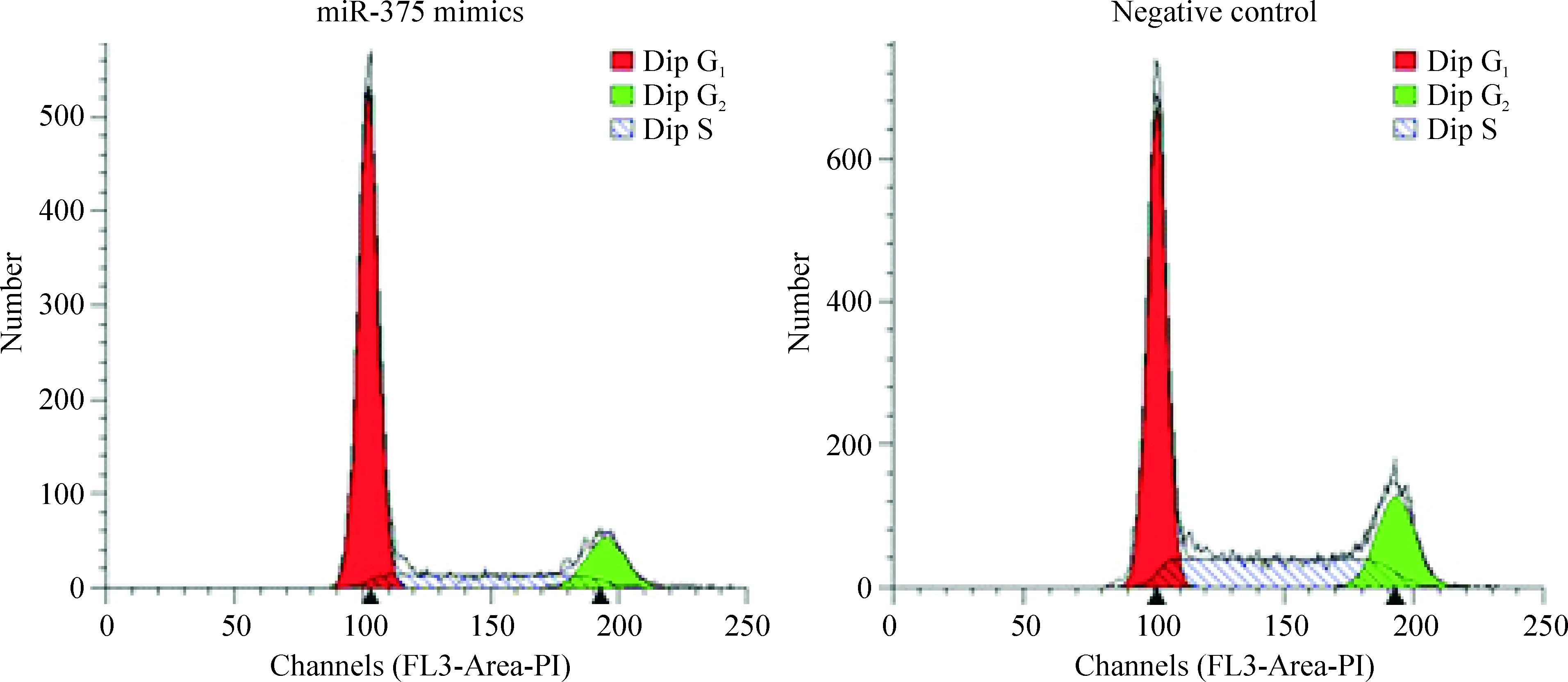
Figure 3.The cell cycle distribution of HCT116 cells 48 h after transfection detected by flow cytometry.
图3 miR-375过表达对HCT116细胞周期分布的影响

表1 miR-375过表达对HCT116细胞细胞周期分布的影响
*P<0.05,**P<0.01vsnegative control.
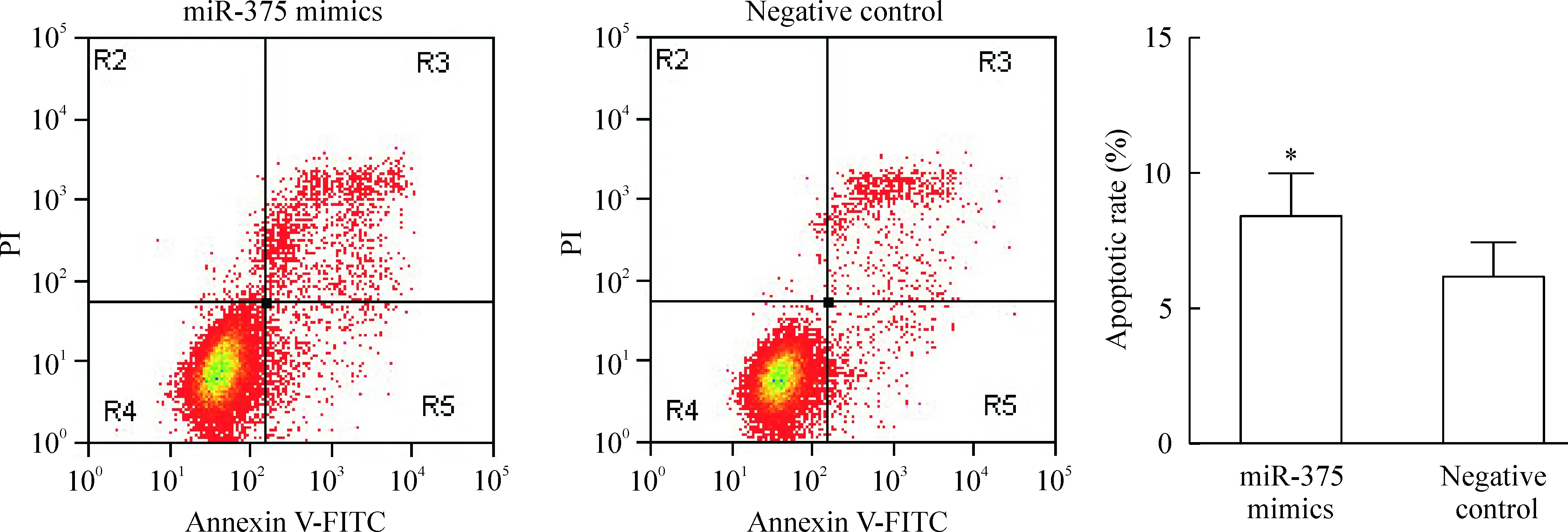
Figure 4.The effect of miR-375 over-expression on the apoptosis of HCT116 cells detected by flow cytometry. Mean±SD.n=3.*P<0.05vsnegative control.
图4 miR-375过表达对HCT116细胞凋亡率的影响
讨 论
miRNA是重要基因调节因子,它在细胞内具有多种重要的调节作用,包括细胞生长、增殖、分化、凋亡和代谢等,并参与肿瘤的形成和发展等众多病理过程。miRNA主要是通过与靶mRNA上的3’非翻译区域(untranslated region,UTR)的特异序列结合,于转录后水平促进靶mRNA的降解和(或)抑制翻译过程而参与肿瘤的发生和发展的,每个miRNA可以有多个靶基因,调节多种蛋白水平,同样,几个miRNAs也可以调节同一个基因,在调控过程中,多条信号通路交叉形成复杂的网络[4]。miRNA在肿瘤中的作用是多样性的,同一种miRNA也可能同时扮演致癌因子和抑癌因子的角色,但从整体效应来看,在肿瘤中高表达的miRNA多表现为致癌作用,而低表达的miRNA多表现为抑癌作用。
近来研究发现,miR-375在多种恶性肿瘤中均有异常表达,但其在不同肿瘤中的表达情况却不尽相同,具有一定的肿瘤特异性。Simonini等[5]研究发现在雌激素受体α(estrogen receptor α,ERα)阳性的乳腺癌细胞株中miR-375高表达,并可通过负调控靶基因地塞米松诱导的Ras相关蛋白1(dexamethasone-induced Ras-related protein 1,RASD1),参与了ERα阳性乳腺癌的形成过程。Szczyrba等[6]研究发现miR-375在前列腺癌细胞中高表达,通过检测肿瘤组织miR-375的表达水平,有利于判断前列腺癌的进程和预后。然而,另外一些学者报道,miR-375在肿瘤中呈低表达,如在胃癌[7-8]、肝癌[2]、头颈部鳞状细胞癌[3]、黑素细胞痣[9]、宫颈癌[10]、结直肠癌[11]等中。有多项研究表明miR-375作为抑癌因子可抑制肿瘤细胞的增殖、迁移及侵袭,并诱导肿瘤细胞凋亡。有学者研究表明胃癌细胞中,miR-375低表达,并通过靶向调节3-磷酸肌醇依懒性蛋白激酶1(3-phosphoinositide-dependent protein kinase-1,PDK1)、抗凋亡基因14-3-3zeta以及Janus激酶2(Janus kinase 2,JAK2)的表达,抑制胃癌细胞的增殖,发挥抑癌基因的作用[7-8]。Mazar等[9]研究发现上调miR-375的表达水平,能明显抑制黑色素瘤细胞的增殖、迁移及侵袭。Wang等[10]在对宫颈鳞癌的研究中发现,miR-375以转录因子特异蛋白1(specificity protein-1,SP1)为靶基因起抑癌基因的作用,参与了宫颈癌的发生过程。Dai等[11]利用实时定量PCR检测miR-375在95对结直肠癌和癌旁正常组织中及3株人结直肠癌细胞株(HT29、HCT116和SW620)和人正常结肠黏膜组织中的表达,结果均提示miR-375表达量显著降低。为了深入了解miR-375在结肠癌发病过程中的作用及其对结肠癌细胞生物学行为的影响,本研究使用化学合成的miR-375模拟物转染结肠癌HCT116细胞,上调结肠癌HCT116细胞中miR-375的表达,通过MTT检测细胞的生长情况,流式细胞技术检测细胞周期分布和细胞凋亡情况来初步探讨miR-375在结直肠癌发生中的作用。结果显示结肠癌HCT116细胞miR-375 mimics组与negative control组相比,各个时点细胞生长活力均显著降低,表明上调miR-375的表达能够抑制结肠癌细胞HCT116的细胞活性。我们发现与negative control组相比,miR-375 mimics组中G1期细胞所占比例明显增多,S期细胞所占比例明显减少,提示miR-375 过表达能够使更多的细胞阻滞在G0/G1期。同时,上调miR-375的表达能增加细胞的凋亡率,说明miR-375在促进结肠癌细胞凋亡的过程中起了重要作用。由此笔者推测,miR-375可能是通过抑制了某些癌基因的表达,从而抑制细胞生长活性,介导细胞周期阻滞并促进细胞凋亡,表现为抑癌基因的功能。
AEG-1位于人染色体8q22,是重要的促癌基因,目前已被证实在包括宫颈癌[12]、结直肠癌[13]、神经母细胞瘤[14]等在内的多种恶性肿瘤中高表达,通过影响细胞的增殖、凋亡、迁移、侵袭及血管生成等过程,参与多种肿瘤的发生发展。秦瑞英等[12]研究发现AEG-1在宫颈癌中高表达可能与宫颈癌的发生发展密切相关,其表达下调介导的细胞周期静止和侵袭能力降低可能与细胞周期相关蛋白细胞周期素D1(cyclin D1)、细胞周期素依赖性激酶2(cyclin-dependent kinase 2,CDK2)及基质金属蛋白酶9(matrix metalloproteinase-9,MMP-9)蛋白表达下调密切相关。Huang等[15]研究发现AEG-1在结直肠癌的发生发展过程中起重要作用,抑制AEG-1的表达可以抑制结直肠癌细胞的增殖、克隆形成和侵袭能力,诱导凋亡,并可增加肿瘤细胞对5-Fu的敏感性。我们在进一步的研究中发现,转染miR-375 mimics后,miR-375的表达明显增加,同时发现miR-375的高表达显著抑制了AEG-1的转录。我们推测miR-375可能通过调控癌基因AEG-1的表达而发挥抑制肿瘤细胞生长活性、介导肿瘤细胞周期阻滞及促进肿瘤细胞凋亡的作用,这与其在肝癌、头颈部肿瘤等的研究结论一致。
总之,miR-375可以抑制结肠癌细胞HCT116的细胞活性,介导细胞周期阻滞并诱导其凋亡,提示miR-375在结直肠癌的发生中发挥重要作用,同时证实了miR-375与AEG-1的关系,进一步探讨二者的相互关系,可为阐明miR-375的抑癌机制提供一条新的思路。
[1] Koelzer VH, Lugli A. The tumor border configuration of colorectal cancer as a histomorphological prognostic indicator[J]. Front Oncol, 2014, 4:29.
[2] He XX, Chang Y, Meng FY, et al. MicroRNA-375 targets AEG-1 in hepatocellular carcinoma and suppresses liver cancer cell growthinvitroandinvivo[J]. Oncogene, 2011, 31(28):3357-3369.
[3] Nohata N, Hanazawa T, Kikkawa N, et al. Tumor suppressive microRNA-375 regulates oncogene AEG-1/MTDH in head and neck squamous cell carcinoma (HNSCC)[J]. J Hum Genet, 2011, 56(8):595-601.
[4] Lovat F, Valeri N, Croce CM. MicroRNAs in the pathogenesis of cancer[J]. Semin Oncol, 2011, 38(6):724-733.
[5] Simonini PS, Breiling A, Gupta N, et al. Epigenetically deregulated microRNA-375 is involved in a positive feedback loop with estrogen receptor a in breast cancer cells[J]. Cancer Res, 2010, 70(22):9175-9184.
[6] Szczyrba J, Nolte E, Wach S, et al. Downregulation of Sec23A protein by miRNA-375 in prostate carcinoma[J]. Mol Cancer Res, 2011, 9(6):791-800.
[7] Tsukamoto Y, Nakada C, Noguchi T, et al. MicroRNA-375 is downregulated in gastric carcinomas and regulates cell survival by targeting PDK1 and 14-3-3zeta[J]. Can-cer Res, 2010, 70(6):2339-2349.
[8] Ding L, Xu Y, Zhang W, et al. MiR-375 frequently downregulated in gastric cancer inhibits cell proliferation by targeting JAK2[J]. Cell Res, 2010, 20(7): 784-793.
[9] Mazar J, DeBlasio D, Govindarajan SS, et al. Epigenetic regulation of microRNA-375 and its role in melanoma development in humans[J]. FEBS Lett, 2011, 585(15):2467-2476.
[10]Wang F, Li Y, Zhou J, et al. miR-375 is down-regulated in squamous cervical cancer and inhibits cell migration and invasion via targeting transcription factor SP1[J]. Am J Pathol, 2011, 179(5):2580-2588.
[11]Dai X, Chiang Y, Wang Z, et al. Expression levels of microRNA-375 in colorectal carcinoma[J]. Mol Med Rep, 2012, 5(5):1299-1304.
[12]秦瑞英, 夏永华, 任艳芳, 等. AEG-1 表达下调对人宫颈癌细胞细胞周期和侵袭能力的影响及其机制[J]. 中国病理生理杂志, 2013, 29(6): 1020-1024.
[13]Gnosa S, Shen YM, Wang CJ, et al. Expression of AEG-1 mRNA and protein in colorectal cancer patients and colon cancer cell lines[J]. J Transl Med, 2012, 10: 109.
[14]Lee SG, Jeon HY, Su ZZ, et al. Astrocyte elevated gene-1 contributes to the pathogenesis of neuroblastoma[J]. Oncogene, 2009, 28(26):2476-2484.
[15]Huang S, Wu B, Li D, et al. Knockdown of astrocyte elevated gene-1 inhibits tumor growth and modifies micro-RNAs expression profiles in human colorectal cancer cells[J]. Biochem Biophys Res Commun, 2014, 444(3):338-345.
源于人诱导多能干细胞并表达脑啡肽酶2的巨噬细胞可降解β淀粉样蛋白
近日,日本科学家发现人诱导多能干细胞(iPS细胞)衍生的巨噬细胞在阿尔茨海默病(AD)的治疗中具有应用前景。在前期研究中,他们建立了从人iPS细胞生成具有增殖活性的巨噬细胞样髓系细胞(iPS-ML)的技术,并发现iPS-ML能降低加入到培养基中的Aβ水平,且iPS-ML的培养上清液能减轻Aβ的神经毒性。在该研究中,他们又构建了表达Aβ特异性单链抗体Fc受体融合形式(anti-Aβ scFv)的iPS-ML;此外,还让iPS-ML表达脑啡肽酶2(NEP2;一种能够降解Aβ的蛋白酶)。在体外,NEP2而非anti-Aβ scFv的表达可以增强iPS-ML降解培养基中可溶性Aβ寡聚体并减轻Aβ神经毒性的能力。将表达NEP2的iPS-ML(iPS-ML/NEP2)注入5XFAD小鼠(AD小鼠模型)脑内,可见有iPS-ML/NEP2注入的脑组织液中Aβ的水平显著降低。这些结果表明,iPS-ML/NEP2可能成为治疗AD的一种有效药物。
Stem Cell Res, 2014, 13(3 Pt A): 442-453(黄翠芹)
Effect of miR-375 on viability, cell cycle and apoptosis of colon cancer HCT116 cells
LIU Bao-long1, 2, WU Bin-wen2, HUANG Su-jun3, LI Dong-feng2
(1SouthernMedicalUniversity,Guangzhou510515,China;2GuangdongGeneralHospital,GuangdongProvincialInstituteofGeriatrics,GuangdongAcademyofMedicalSciences,Guangzhou510080,China;3GuangzhouRedCrossHospital,Guangzhou510220,China.E-mail:wubinwengd@aliyun.com)
AIM: To investigate the effect of microRNA-375 (miR-375) on the viability, cell cycle and apoptosis of HCT116 cells. METHODS: The expression of miR-375 in different colorectal cancer cell lines was detected by real-time PCR. The miR-375 mimics was transfected into HCT116 cells by LipofectamineTM2000. The mRNA expression of miR-375 and AEG-1 was detected by real-time PCR. The HCT116 cell viability was detected by MTT assay. The changes of apoptosis and cell cycle distribution were analyzed by flow cytometry. RESULTS: Real-time PCR showed that miR-375 expression was the lowest in HCT116 among 4 colorectal cancer cell lines. The expression level of miR-375 significantly increased in miR-375 mimics group compared with that in the negative control group. The high expression level of miR-375 significantly inhibited the mRNA expression of AEG-1. After transfection with miR-375 mimics, the cell viability was inhibited, the apoptotic rate was increased, the proportion of G1-stage cells was increased, and the proportion of S-stage cells was decreased. CONCLUSION: miR-375 inhibits the viability, mediates the cell cycle arrest and promotes the apoptosis of colon cancer HCT116 cells. miR-375 may act as a tumor suppressor in colorectal cancer by inhibiting AEG-1.
Colorectal cancer; MicroRNA-375; Cell viability; Cell cycle; Apoptosis
1000- 4718(2015)04- 0609- 06
2014- 11- 30
2015- 02- 10
广东省科技计划(No. 2011B031800001)
R735.3; R730.23
A
10.3969/j.issn.1000- 4718.2015.04.006
△通讯作者 Tel: 020-83827812; E-mail: wubinwengd@aliyun.com

